利多卡因局部阻滞结合针康法治疗脑卒中后上肢痉挛状态临床研究
李 季,张 立,关 莹,王 璐,辛贵乐,邢艳丽,唐 强
黑龙江中医药大学附属第二医院,黑龙江 哈尔滨150001
通信作者:唐强,E-mail:tangqiang1963@163.com
脑卒中是神经系统的常见病,具有发病率高、致残率高等特点,是我国成年人致残的首要病因[1]。肢体的痉挛状态则是脑卒中后最常见的并发症,是由上运动神经元损害后运动感觉控制障碍导致的各种间歇或持续的非自主肌肉活动,包括牵张反射亢进、联合反应、协同运动、痉挛性肌张力障碍、屈肌反射增强等异常肌肉活动[2]。痉挛状态常导致主被动活动受限、关节的僵硬变形、疼痛、护理困难等一系列问题,严重阻碍脑卒中患者肢体功能的恢复[3]。另外,康复训练是帮助患者恢复功能的有效途径,但其中困扰康复医师和治疗师的一个重要问题就是痉挛。因此,脑卒中后肌肉痉挛的治疗具有重要的研究价值和社会意义[3]。
人体上肢运动功能与日常生活活动密切相关,上肢的痉挛状态显著降低患者的生活质量,给患者的生活和工作带来极大的痛苦。所以,寻求切实有效地解决脑卒中后上肢痉挛状态的治疗方法,具有广泛的临床应用意义。近年来有关上肢痉挛状态的治疗被逐渐重视起来,应运产生了多种治疗方法[4-9]。本研究对脑卒中患者上肢痉挛状态采用利多卡因局部阻滞结合针康法进行治疗,取得满意疗效。
1 临床资料
1.1 病例选择标准
1.1.1 纳入标准 符合脑卒中的诊断标准,病程2周~6个月;男女均可;年龄20~70岁;所有患者均经过MRI或CT确诊;偏瘫侧上肢肌力经神经系统检查法在1级以上;偏瘫侧上肢肌张力根据改良Ashworth量表评定,肌张力1+~4级;无严重认知障碍,无感觉性失语,能够理解基本指令,病情基本稳定(MMSE评分不低于20分,即患者可进行简单阅读及基本理解能力);无其他严重的心脑肾疾病,无血栓性静脉炎,无重度营养不良,无严重的骨骼关节问题;无明显的神经官能症及精神疾病;自愿参与本研究,患者或家属签署知情同意书。
1.1.2 排除标准 蛛网膜下腔出血、继发性脑梗死,或伴有严重颈、腰椎病变或上肢有骨关节疾病,其他神经系统疾病及前庭功能或小脑功能障碍等;有认知及交流障碍而不能进行训练和有效评价;伴有血液系统疾病、痴呆、癫痫或意识障碍;上肢有异位骨化或疼痛;怀孕妇女及不能配合治疗和检查者;对利多卡因注射液过敏者;在治疗前1个月内应用巴氯芬、妙纳、替扎尼定、氯硝西泮等肌松类药物者。
1.1.3 剔除与脱落标准 符合纳入标准,但治疗依从性差,未按规定治疗或疗程不够,无法判断,资料不全等影响疗效或安全性判断者;私自使用其他治疗方案,而影响本研究疗效判定的患者;出现严重不良事件或反应的受试者。
1.2 一般资料
收集2017年6月—2020年6月黑龙江中医药大学附属第二医院就诊的60例脑卒中后存在上肢痉挛状态的门诊及住院患者。运用SPSS 22.0统计软件生成随机数字表,产生60组数字。纳入受试者按入组时间顺序编号,根据随机数字表被分入观察组和对照组,每组各30例。由于本试验方案存在一定特殊性,未能做到盲法,故而在试验过程中评定者固定为1人,并对其采取盲法,以尽量摒除偏倚因素。本研究经医院伦理委员会批准,患者或家属知情并签署同意书。2组性别、年龄、病程、脑卒中类型、偏瘫侧等一般资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。
表1 2组一般资料比较(±s)Table 1 Comparison of general data between two groups(±s)
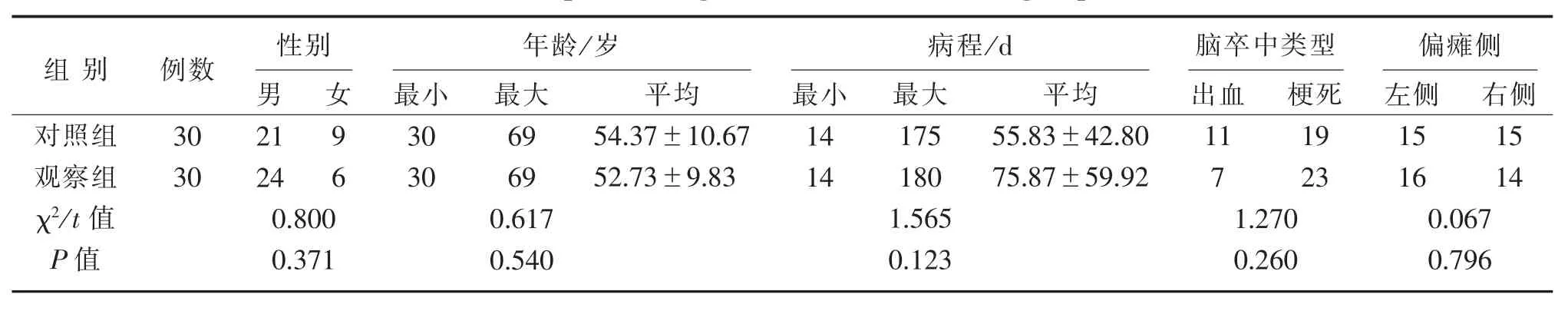
表1 2组一般资料比较(±s)Table 1 Comparison of general data between two groups(±s)
?
2 方 法
2.1 治疗方法
基础治疗采用当前已相对比较成熟的针康法治疗体系[10-13],肢体功能障碍的方案具体如下:
2.1.1 头穴丛刺长留针法 顶区:前顶透百会,及其向左、右各1寸及2寸的平行线向后透刺,共5针;顶前区:囟会透前顶,及其向左、向右各1寸及2寸的平行线向后透刺,共5针。采用φ0.35 mm×40 mm安迪牌一次性针灸针进行针刺,常规进针刺至帽状腱膜下,深约30 mm。针后连接英迪KWD-808-Ⅱ型脉冲针灸治疗仪,采用疏密波治疗(变化次数为10~50次/min,输出脉冲幅度控制在10~20 V),刺激强度以患者能耐受为度,30 min/d,留针6~8 h。每日1次,每周6次,共治疗4周。
2.1.2 抗痉挛针法(活化拮抗肌) 采用φ0.35 mm×40 mm安迪牌一次性针灸针针刺肩髃、臂臑、天井、臑会、手三里、外关。肩髃、臂臑连一组导线促进三角肌收缩使肩外展;臑会、天井连一组导线使肱三头肌收缩,产生肘伸展动作;手三里、外关连一组导线促进腕伸肌群、指伸肌收缩,产生伸腕、伸指动作。连接英迪KWD-808-Ⅱ型脉冲针灸治疗仪,采用疏密波治疗,刺激强度以患者能耐受为度,30 min/次,每日2次,每周6次,共治疗4周。
2.1.3 康复训练 ①良肢位摆放:上肢肩胛带下降,肩外展外旋,肘关节伸展,伸腕,手指全部伸展,拇指外展,该方法可以抑制异常姿势模式,促进拮抗肌维持正常功能位。②运动疗法:牵伸训练(每日持续被动牵伸肩关节、肘关节、腕关节,每次持续时间不少于20 min,用于抑制痉挛肌的持续性收缩);维持关节活动度(被动活动肩关节、肘关节、腕关节,每个关节被动活动时间不少于5 min。用以改善主动肌与拮抗肌间的协调与平衡);神经生理疗法主要采用Bobath疗法,通过控制关键点可抑制异常姿势模式和运动模式,促进上肢正常运动功能恢复。③作业疗法:利用负重练习或在负重状态下的作业活动降低患侧上肢肌痉挛。每日1次,每周6次,共治疗4周。
治疗期间,对照组采取上述常规针康法治疗。观察组在上述针康法治疗基础上引入利多卡因局部阻滞。选取患侧肱二头肌肌腹隆起处、内外侧肌束分别注射2%利多卡因1 mL,肱桡肌(肱二头肌止点与肱骨外侧髁之间连线中点处)注射2%利多卡因1 mL。注意注射药物时需回抽,无血方可推注药物,避免药物入血。每周注射3次,共治疗4周。
2.2 评定标准
2.2.1 Ashworth量表 根据改良Ashworth肌张力评定量表(Modified Ashworth Scale,MAS)评价痉挛情况,从0级“无肌张力增加”至4级“受累部分肢体强直性屈曲或伸直”共6级。
2.2.2 Fugl-Meyer量表 根据上肢简化Fugl-Meyer运动功能评定表(Fugl-Meyer Assessment Upper Extremity Scale,FMA-UE)评价肢体运动功能,该量表涉及反射活动、运动模式、关节运动范围、运动协调性及速度等方面,总分66分,评分越高表明患肢运动功能障碍越小。FMA-UE的最小临床意义变化值(minimal clinically important difference,MCID)为4.25~7.25分[14],即患者治疗前后上肢运动功能评分差值>MCID,则认为该患者上肢运动功能得以改善,治疗有效而且能够超越随机误差[15]。
2.2.3 改良Barthel指数评定量表 根据改良Barthel指数(Modified Barthel Index,MBI)评定量表评价日常生活活动能力,该量表主要通过修饰、进食、洗澡、穿衣等10项内容评估患者的日常生活能力,MBI评分越高,表明患者生活能力越好。
2.2.4 主动关节活动度量表 根据主动关节活动度(active range of motion,AROM)评价肘关节的活动范围的变化,间接反映出肘关节周围肌肉的力量及张力的变化。
2.2.5 安全性评估 记录2组治疗过程中出现皮下血肿、晕针、感染等不良反应发生的情况。
2.3 统计学方法
采用SPSS 22.0统计软件进行数据分析。计量资料采用t检验,计数资料采用Pearsonχ2检验,等级资料采用秩和检验。计量资料均近似满足正态分布,并且所有对比结果均接受方差齐同的假设(P>0.05),因此符合两独立样本t检验的要求,保证t检验结果的可信度;数据采用(±s)表示,组间比较采用两独立样本t检验,组内治疗前后比较采用配对样本t检验。P<0.05为差异有统计学意义。
3 结 果
3.1 2组治疗前后MAS分级比较
2组治疗后MAS分级均较治疗前提高(P<0.01);与对照组治疗后比较,观察组MAS评分具有实质性改善(Z=-3.105,P=0.002)。见表2。
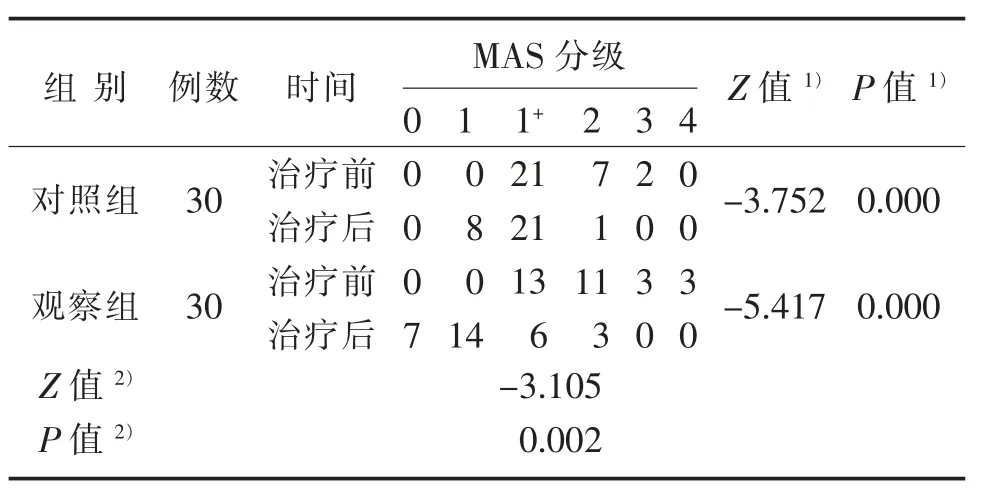
表2 2组治疗前后MAS分级比较Table 2 Comparison of MAS grading between two groups before and after treatment
3.2 2组治疗前后FMA-UE评分比较
2组治疗前FMA-UE评分比较,差异无统计学意义(P>0.05),具有可比性;2组治疗后FMA-UE评分均较治疗前提高(P<0.01);观察组和对照组FMA-UE评分差值分别为(14.7±3.7)分、(9.7±2.5)分,均大于FMA-UE的MCID;与对照组治疗后比较,观察组FMA-UE评分有实质性改善(P<0.05)。见表3。
表3 2组治疗前后FMA-UE评分比较(±s) 分Table 3 Comparison of FMA-UE scores between two groups before and after treatment(±s)Scores
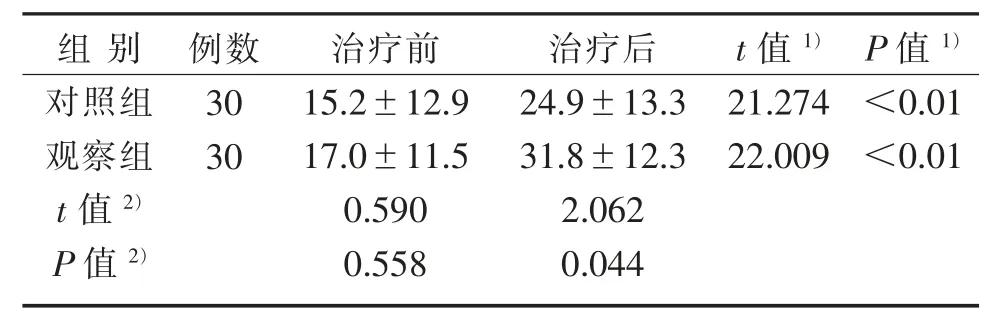
表3 2组治疗前后FMA-UE评分比较(±s) 分Table 3 Comparison of FMA-UE scores between two groups before and after treatment(±s)Scores
注:1)与本组治疗前比较;2)与对照组治疗后比较。Note:1)Comparison in same group before and after treatment;2)Comparison with the control group after treatment.
?
3.3 2组治疗前后M BI评分比较
2组治疗前MBI评分比较,差异无统计学意义(P>0.05),具有可比性;2组治疗后MBI评分均较治疗前显著提高(P<0.01);观察组和对照组MBI评分差值分别为(28.3±5.1)分、(20.3±5.1)分,与对照组治疗后比较,观察组MBI评分有实质性改善(P<0.05)。见表4。
表4 2组治疗前后MBI评分比较(±s) 分Table 4 Comparison of MBI scores between two groups before and after treatment(±s)Scores
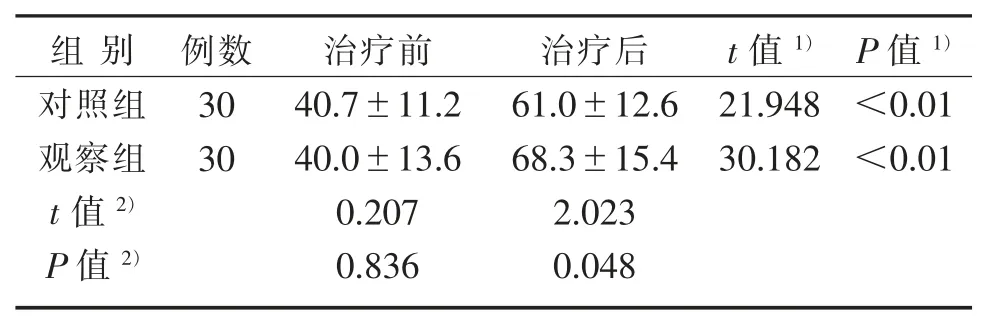
表4 2组治疗前后MBI评分比较(±s) 分Table 4 Comparison of MBI scores between two groups before and after treatment(±s)Scores
注:1)与本组治疗前比较;2)与对照组治疗后比较。Note:1)Comparison in same group before and after treatment;2)Comparison with the control group after treatment.
?
3.4 2组治疗前后AROM评分比较
2组治疗前AROM评分比较,差异无统计学意义(P>0.05),具有可比性;2组治疗后AROM评分均较治疗前提高(P<0.01);观察组和对照组AROM评分差值分别为(42.0±34.5)分、(25.5±18.7)分,与对照组治疗后比较,观察组AROM评分有实质性改善(P<0.05)。见表5。
3.5 安全性评估
研究期间2组均未出现皮下血肿、晕针、感染等不良事件;观察组未出现肌肉瘫痪、感觉减退、疼痛等不良事件。
表5 2组治疗前后AROM评分比较(±s) 分Table 5 Comparison of AROM scores between two groups before and after treatment(±s)Scores
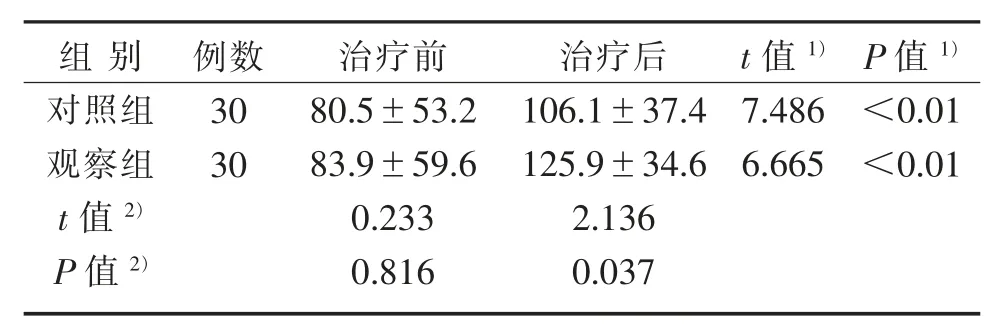
表5 2组治疗前后AROM评分比较(±s) 分Table 5 Comparison of AROM scores between two groups before and after treatment(±s)Scores
注:1)与本组治疗前比较;2)与对照组治疗后比较。Note:1)Comparison in same group before and after treatment;2)Comparison with the control group after treatment.
?
4 讨 论
痉挛是上运动神经元损伤导致的一种慢性运动障碍,是速度依赖的紧张性牵张反射过度活跃的表现,也是脑卒中后一个最重要的损害。肢体痉挛主要表现为肌肉短缩、姿势异常、疼痛和关节挛缩,以及由此导致的肌力减退及各种主动运动控制和协调能力受损等[16]。临床上出现以上肢屈肌群和下肢伸肌群为主肌张力增高的异常姿势模式。
痉挛如果不及早治疗,就会发生恶性循环,如受累肌群无法有效对抗痉挛状态所致的收缩,出现姿势模式异常以及软组织缩短,肌肉短缩导致生物力学变化又阻碍肌肉的伸长,进一步导致肌张力增高。因此,较长时间的肌肉痉挛可使患侧肢体挛缩畸形,甚至造成终生残疾。综上,在脑卒中痉挛期,当以降低肌张力、缓解或抑制痉挛作为康复治疗的重点,这是患者重建正常运动模式不可缺少的步骤,越早干预效果越好。公认的治疗痉挛措施包括被动扩大关节活动度、促进肢体主动运动、联合应用抗痉挛药物治疗等[16],抗痉挛药物包括口服药物和注射药物。对于全身痉挛且运动功能训练效果不佳的患者常常应用巴氯芬、替扎尼定等口服药物。对于局部肌肉痉挛的患者常常选用去神经化学阻滞剂,如肉毒毒素、酚类、乙醇类、局麻药物等。脑卒中患者抗痉挛药物治疗的对照研究比较有限,大多数研究的结论是口服药物可缓解痉挛和疼痛,但没有明显可改善功能的结果[17]。近年来,通过注射药物治疗痉挛状态的神经阻滞疗法成为研究热点。其中肉毒毒素注射治疗已被证实具有确切的疗效,并形成了比较规范的治疗体系[18-22]。然而,一方面肉毒毒素属于神经毒性药物,需要专业化管理,注射人员需要取得资质方可使用;另一方面,多点注射肉毒毒素时常引发疼痛;此外,肉毒毒素价格昂贵,成本效益较低[23]。
相比于肉毒毒素,盐酸利多卡因属于中效酰胺类局部麻醉药,其溶液状态趋于稳定,不易发生化学变化或者药物变质。利多卡因注射液局部阻滞时,其对神经纤维的影响规律首先是小的有髓细胞运动纤维和感觉纤维,然后是大的有髓运动纤维和感觉纤维,最后是非常小的有髓B纤维和无髓C纤维;在注射利多卡因后本体感觉和运动功能比痛觉更早被抑制,可使被阻滞肌肉动作延迟,通常运动神经阻滞是在注射局麻药15 min内,大约持续时间为60 min到数小时[24-26]。利多卡因局部阻滞具有以下显著优点:①药物成本低廉、弥散快、性质稳定,并且能应用于不适用A型肉毒毒素的患者,因而适用范围较广;②利多卡因注射液由于体内代谢迅速,故不易导致肌肉瘫痪,临床安全性更佳;③利多卡因局部阻滞技术操作简单,可重复性高,易于掌握。当前包括利多卡因在内的局麻药物主要作为诊断及试验性治疗出现在临床中,仍缺乏系统的临床观察。
神经阻滞疗法主要选取运动神经入肌点进行,神经入肌点含有高密度的神经纤维或运动终板,故而神经阻滞选取的注射部位常常与肉毒毒素选取的注射点相似[24,27]。参考肉毒毒素常规注射部位,选取肱二头肌肌腹隆起处、内外侧肌束及肱桡肌(肱二头肌止点与肱骨外侧髁之间连线中点处)进行注射[3],结果显示,利用利多卡因注射液缓解痉挛肌肉过度活动的作用,配合针灸、康复的综合使用,可以更加有效地减轻上肢的痉挛程度。2组治疗后MAS评分均较治疗前提高(P<0.01),并且与对照组治疗后比较,观察组MAS评分改善更加明显(P<0.01),观察组对于痉挛级别为3、4级的患者治疗亦有效。2组治疗后AROM评分均较治疗前提高(P<0.01),表明2组肘关节的主动关节活动度均有明显增大,与对照组治疗后比较,观察组AROM评分有实质性改善(P<0.05)。2组均能降低中风病患者的肢体功能障碍,治疗后的组内FMA-UE评分均较治疗前提高(P<0.01),与对照组治疗后比较,观察组FMAUE评分有实质性改善(P<0.05)。2组治疗后MBI评分均较治疗前提高(P<0.01),证实了患者日常生活活动能力的改善,与对照组比较,观察组MBI评分有实质性改善(P<0.05)。
根据试验结果可以看出,利多卡因局部阻滞结合针康疗法更适用于脑卒中后病程较长、痉挛较重的后遗症,尤其在改善患肢运动功能及上肢痉挛状态方面具有起效快、安全性高且成本较低的优势,可减轻家庭及社会的经济负担,为脑卒中的临床治疗提供新思路和客观依据。本研究亦存在不足之处:由于本研究患者绝大多数为住院患者,因评定与观察不良反应等因素,较普通患者所受关注增多,故不能排除霍桑效应对本研究结果的干扰;本试验选择治疗4周后评价疗效,并未随访观察治疗后的长期效应。下一步研究应扩大样本量,增加随访观察,增加动物实验,进一步探索研究其远期疗效及作用机制。

