神经复元方对卒中后抑郁大鼠BDNF/TrkB表达及海马神经元突触可塑性的影响
蔡丽 刘毅 李文涛 陈敏
摘要 目的:研究神經复元方对卒中后抑郁(PSD)模型大鼠脑源性生长因子(BDNF)/酪氨酸激酶受体B(TrkB)表达及海马神经元突触可塑性的影响,探讨其改善抑郁症状的作用机制。方法:采用经典的线栓大脑中动脉加用慢性不可预见温和应激结合孤养法,建立PSD大鼠模型,分为假手术组、PSD模型组、氟西汀组、神经复元方低、中、高剂量组。造模成功后干预28 d,比较各组大鼠行为学变化,用荧光定量RT-PCR和蛋白质免疫印迹法检测各组BDNF/TrkB-mRNA及生长相关蛋白-43(GAP-43)及突触素I(SYN I)和突触囊泡素(SYNA)的表达水平,用透射电镜观察海马神经元突触的超微结构。结果:高剂量神经复元方干预后的PSD模型大鼠学习记忆功能提升,海马BDNF和TrkB-mRNA表达比较模型组显著增高,差异有统计学意义(P<0.05),海马神经元突触相关蛋白SYN I和SYNA的表达水平比较模型组明显提高,差异有统计学意义(P<0.05)。高剂量神经复元方组海马神经元突触密度和突触后致密物厚度均显著高于模型组。结论:神经复元方可改善PSD模型大鼠抑郁症状,提升大鼠学习记忆能力,其作用机制可能是通过增加海马BDNF/TrkB的含量,促进海马突触素I和SYNA等突触生长相关蛋白表达,增强PSD模型大鼠海马神经元可塑性而发挥作用。
关键词 神经复元方;卒中后抑郁;脑源性神经营养因子;酪氨酸激酶B;海马;突触可塑性;中医药;实验研究
Effect of Shenjing Fuyuan Decoction on the Expression of BDNF/TrkB and the Synaptic Plasticity of Hippocampal Neurons in PSD Model Rats
CAI Li,LIU Yi,LI Wentao,CHEN Min
(Department of Neurology,Shanghai Municipal Hospital of Traditional Chinese Medicine,Shanghai University of Traditional Chinese Medicine,Shanghai 200071,China)
Abstract Objective:To investigate the effect of Shenjingfuyuan Decoction in regulating BDNF/TrkB signal pathway and the synaptic plasticity of hippocampal neurons in PSD model rats,and to explore its mechanism of improving depression symptoms.Methods:PSD rat model was established by using the classical method of the middle cerebral artery embolism and chronic unforeseeable mild stress combined with solitary nutrition,which were divided into sham-operation group,PSD model group,fluoxetine group,Shenjing Fuyuan Decoction low,middle and high dose group.After 28 days' intervention,the behavioral changes of each group were compared.The expression levels of BDNF/TrkB-mRNA and synapse-related proteins SYN-I,SYNA and GAP-43 were detected by quantitative RT-PCR and immunoblotting.The ultrastructure of hippocampal neuron synapses were observed by transmission electron microscopy.Results:The learning and memory function of PSD model rats was improved after the intervention of high-dose Shenjing Fuyuan Decoction.The expression of BDNF and TrkB gene in hippocampus was significantly higher than that in model group (P<0.01).The expression of SYN-I and SYNA in hippocampus neurons was significantly higher than that in model group (P<0.01).The synaptic density and postsynaptic density of hippocampal neurons in the high-dose SD group were significantly higher than those in the model group.Conclusion:Shenjing Fuyuan Decoction can effectively improve the depression of PSD model rats,and improve the learning and memory abilities of rats.Its mechanism may be related to the regulation of BDNF/TrkB signal pathway,promoting the expression of synaptophysin I and SYNA in hippocampus and other synaptic growth-related protein expression,and the enhancement of synaptic plasticity of hippocampal neurons.
Keywords Shenjingfuyuan Decoction; Post-stroke depression; Brain-derived neurotrophic factor; Tyrosine kinase B; Hippocampus; Synaptic plasticity; Traditional Chinese medicine; Experimental study
中图分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.04.013
卒中后抑郁(Post-stroke Depression,PSD)是卒中后常见并发症,严重影响患者的神经功能康复和生命质量,导致脑卒中的复发率和死亡率明显增高。据流行病学数据,目前我国PSD发病率为29%~37.9%[1]。对于PSD的治疗近年有很多中药复方表现出良好治疗效果。前期研究证实神经复元方对改善PSD患者抑郁症状有较好疗效[2-3],但对其作用机制尚无研究。且研究发现脑源性神经营养因子(BDNF)水平与PSD具有相关性。本研究通过建立PSD大鼠模型,予以不同剂量神经复元方干预,并设置对照组比较研究,探讨神经复元方对PSD模型大鼠BDNF/TrkB表达及海马神经元突触可塑性的影响,进而分析改善PSD患者抑郁症状的作用机制。
1 材料与方法
1.1 材料
1.1.1 动物
清洁级健康雄性Sprague-Dawley(SD)大鼠60只,3个月龄,体质量(210±30)g,上海实验动物研究中心提供。所有大鼠分笼喂养于循环房内,温度(22±2)℃,湿度60%,光/暗周期为12 h/12 h,适应饲养1周,允许动物自由获取食物和水。所有实验操作经上海市中医医院医学伦理委员会批准并指导进行,尽量减轻动物的痛苦(伦理审批号:2016SHL-KY-20)。
1.1.2 药物
神经复元方,采用单味中药配方颗粒,由江苏省江阴市天江药业有限公司生产提供。盐酸氟西汀胶囊(苏州礼来制药有限公司,国药准字J20170022)。
1.1.3 试剂与仪器 PrimeScriptTM RT reagent Kit(TAKARA公司,日本,货号:RR037A)、SYBR Premix Ex TaqTM Ⅱ试剂(TAKARA公司,日本,货号:RR820A)。兔抗BDNF多克隆抗体(上海威奥生物科技有限公司,货号:H00000627-D01P)、BDNF免疫组化试剂盒及DAB顯色试剂盒(上海威奥生物科技有限公司,货号:PAB0745)。BCA蛋白浓度测定试剂盒及RIPA裂解液(碧云天生物工程有限公司,货号:ab174837)。罗氏LC96荧光定量PCR仪(上海土森视觉科技有限公司,型号:Roche LC96)、低温高速离心机(上海赵迪仪器重点实验室,型号:TGL20M)、-80 ℃冰箱和4 ℃冰箱(海尔公司,型号:DW-86L828J)、Morris水迷宫(上海欣软信息科技有限公司,型号:XR-XM101)、恒温浴槽(上海诺顶仪器设备有限公司,型号:HX-101)、Moticam 3000显微摄影成像系统(麦克奥迪实业集团有限公司,型号:Moticam 3000)、酶标仪(上海土森视觉科技有限公司,型号:BIO-RAD iMark)等。
1.2 方法
1.2.1 分组与模型制备
将60只健康SD大鼠采用随机数字法分为假手术组、模型组、氟西汀组、神经复元方高剂量组、神经复元方中剂量组、神经复元方低剂量组,共6组,每组10只。假手术组每笼饲养5只,共饲养10只,在其他大鼠进行造模的同时,给予相同的MCAO手术流程,但不插入线栓,不进行温和应激处理和孤养,旨在后续作为一组排除手术对大鼠抑郁状态的影响。模型组和药物干预组大鼠每笼1只,按以上造模方法进行造模。最后选取8只假手术老鼠为1组,其余5组也各选8只成功造模大鼠。
采用经典的线栓法大脑中动脉阻塞手术(MCAO)建立脑缺血模型,加用慢性不可预见温和应激(CUMS)结合孤养,建立大鼠PSD模型[4-5]。MCAO模型参照改良的Koizumi方法建立[6]。术后24 h按Longa等[7]标准行神经功能评分。用蔗糖水消耗试验评价抑郁模型的可靠程度[8]。
1.2.2 干预方法
中剂量组以临床常用剂量为标准算出,高剂量组为中剂量组的2倍,低剂量组为中剂量组的1/2倍。假手术组、模型组予以0.9%生理盐水灌胃,2 mL/d;神经复元方高、中、低剂量组按比例予以神经复元方冲剂灌胃,分别按照0.4 g/kg、0.2 g/kg、0.1 g/kg的标准2 mL/d。氟西汀组予以氟西汀灌胃,每日给予5 mg/kg,混悬液2 mL。神经复元方的剂量是根据人日用剂量折算成大鼠日用剂量而成。自第22天起(应激结束后)连续干预28 d。
1.2.3 检测指标与方法
1.2.3.1 糖水消耗与Morris水迷宫测试
糖水消耗测试,实验开始手术前训练动物适应含糖饮水,禁水24 h后进行动物糖水消耗试验[8]。给予每只大鼠定量的1瓶1%蔗糖水,1 h后取走水瓶并称重(测试前后瓶中蔗糖水消耗)。测试分别安排在手术前、应激第14天、应激第21天和药物干预第28天进行,记录大鼠蔗糖水消耗量。
Morris水迷宫测试安排在应激和药物干预结束后1星期,采用定位航行实验测试学习功能,采用空间探索实验测试记忆功能[4,9]。1)定位航行实验。通过观察大鼠从入水到寻找到并爬上平台所用时间(即逃避潜伏期)来测量其学习记忆能力。前5 d,将大鼠分别从不同的象限放入水中,放入时面向池壁,计算机跟踪分析大鼠寻找平台的潜伏期,若120 s内仍未找到平台,则人为引到平台并停留30 s,此时逃避潜伏期记为120 s。每只动物训练4次/d,每次训练之间间隔10 min,连续训练5 d。将4次/d的平均逃避潜伏期作为当天大鼠的学习指标。2)空间探索实验,于5 d训练结束后移除平台,在水池第3象限周边壁上做黑色三角标记,将大鼠放入任一象限,分析60 s内大鼠在平台所在象限的停留时间(空间探索时间)和跨平台次数,作为记忆能力的评价指标。
1.2.3.2 样本采集方法
待各组大鼠Morris水迷宫测试完成后,分别采集透射电镜观察、免疫荧光染色、实时荧光定量PCR(Real-time PCR)所需用脑组织标本和蛋白质免疫印迹法(Western-Blotting)所需用海马组织标本[10]。
1.2.3.3 透射電镜观察
采用透射电镜观察各组大鼠海马神经元突触TEM超微结构[11]。1)样品取材:将麻醉大鼠的大脑海马组织取出,解剖并分离CA3区,取下组织,组织块大小约1 mm3。2)固定:将组织块快速放入2.5%戊二醛、磷酸盐缓冲液配置的固定液中振荡固定3 h,然后倒掉固定液,用0.1 mol/L(pH值7.0)磷酸盐缓冲液漂洗样品,15 min×3次,再用1%的四氧化锇在4 ℃磷酸盐缓冲液中固定2 h,随后再用0.1 mol/L(pH值7.0)磷酸盐缓冲液漂洗,15 min×3次。3)乙醇梯度脱水:在4 ℃冰箱内,采用50%、70%、90%3种浓度的乙醇溶液对样品分别脱水15 min,再以90%乙醇与90%丙酮按1∶1配制的溶液脱水15 min,然后90%丙酮脱水15 min。完成后取出,室温下予以100%丙酮液脱水,15 min×3次。4)包埋剂梯度渗透:室温下用按照比例2∶1的纯丙酮+包埋液处理样品3~4 h;再用比例1∶2的纯丙酮+包埋液处理样品,过夜;最后在37 ℃用纯包埋液处理样品2~3 h。5)固化:37 ℃烘箱内过夜。6)超薄切片机切片,片厚70 nm。7)3%醋酸铀-枸橼酸铅双染色。8)透射电镜观察并拍片[12]。
1.2.3.4 实时荧光定量PCR检测
采用实时荧光定量PCR(Real-time PCR)检测BDNF/TrkB mRNA及突触生长相关蛋白-43(GAP-43)、突触素I(SYN I)和突触囊泡素(SYNA)mRNA的表达水平。主要步骤分为Total RNA的提取和鉴定、cDNA合成和定量PCR,最后经过上机扩增检测,利用2-△△Ct法计算各组BDNF、TrKB、GAP-43、SYN I、SYNA的相对表达量[13]。
1.2.3.5 蛋白质免疫印迹法检测
采用蛋白质免疫印迹法进行分析,测定PSD大鼠经干预后海马神经元突触相关蛋白SYN I、SYNA和GAP-43的表达水平。主要实验步骤包括蛋白质抽提、蛋白质定量、SDS-PAGE电泳、蛋白质转移及显像、免疫检测和化学发光检测[13]。
1.3 统计学方法
采用SPSS 17.0统计软件进行数据分析。计量资料以均数±标准差(±s)表示,采用t检验;计数资料以百分率表示,比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
本实验PSD大鼠模型成功建立47只,按每组8只分配到假手术组外的其他5组。由于意外等原因,实验过程中模型组、神经复元方低剂量组各死亡1只大鼠。
2.1 各组糖水消耗量比较
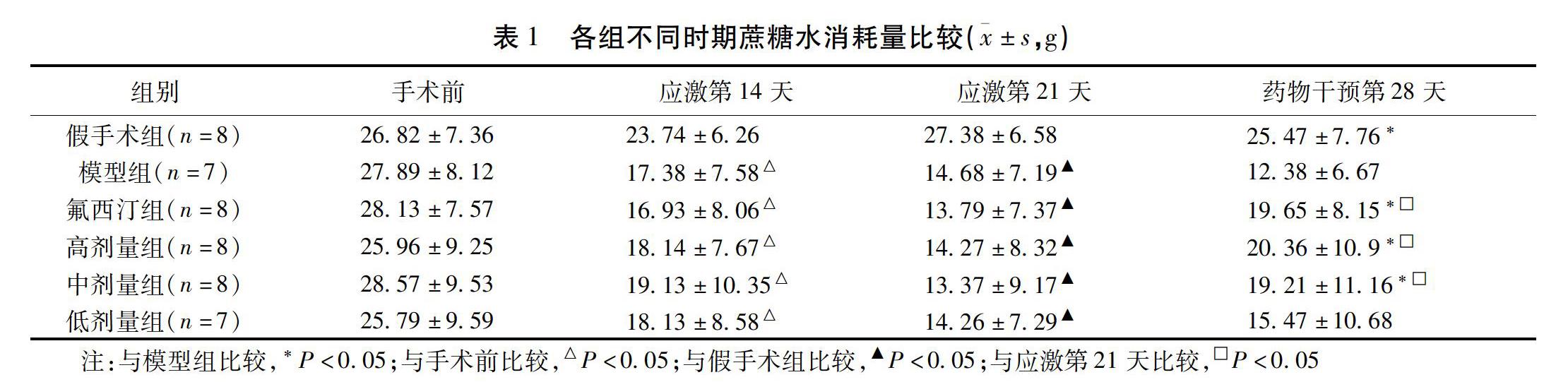
手术前,各组糖水消耗差异无统计学意义,应激第14天、第21天,模型组、氟西汀组及高、中低剂量组的糖水消耗量逐步降低,与手术前比较,差异有统计学意义(P<0.05)。经药物干预28 d后,氟西汀组、高、中剂量组糖水消耗量较应激第21天时明显增多,且明显高于模型组,差异有统计学意义(P<0.05)。假手术组糖水消耗量前后无明显变化。见表1。
2.2 各组大鼠学习与记忆能力受影响情况比较
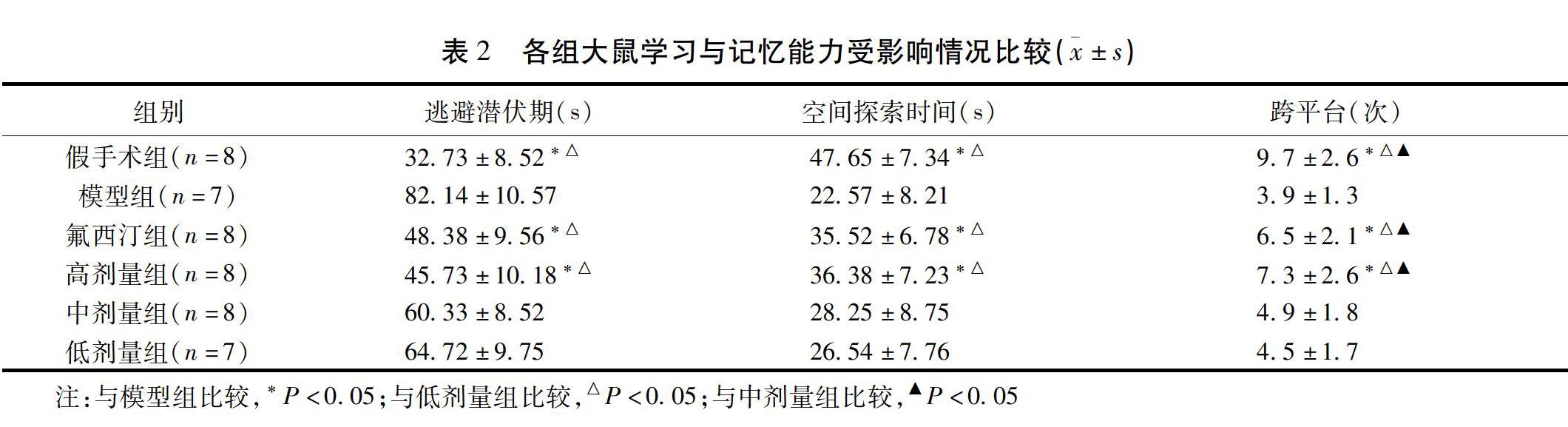
逃避潜伏期,假手术、氟西汀和高剂量组显著短于低剂量组和模型组,差异有统计学意义(P<0.05);空间探索时间,假手术、氟西汀与高剂量组显著长于低剂量组和模型组,差异有统计学意义(P<0.05)。跨平台次数,假手术、氟西汀与高剂量组明显多于中、低剂量组和模型组,差异有统计学意义(P<0.05)。见表2。
2.3 透射电镜观察结果
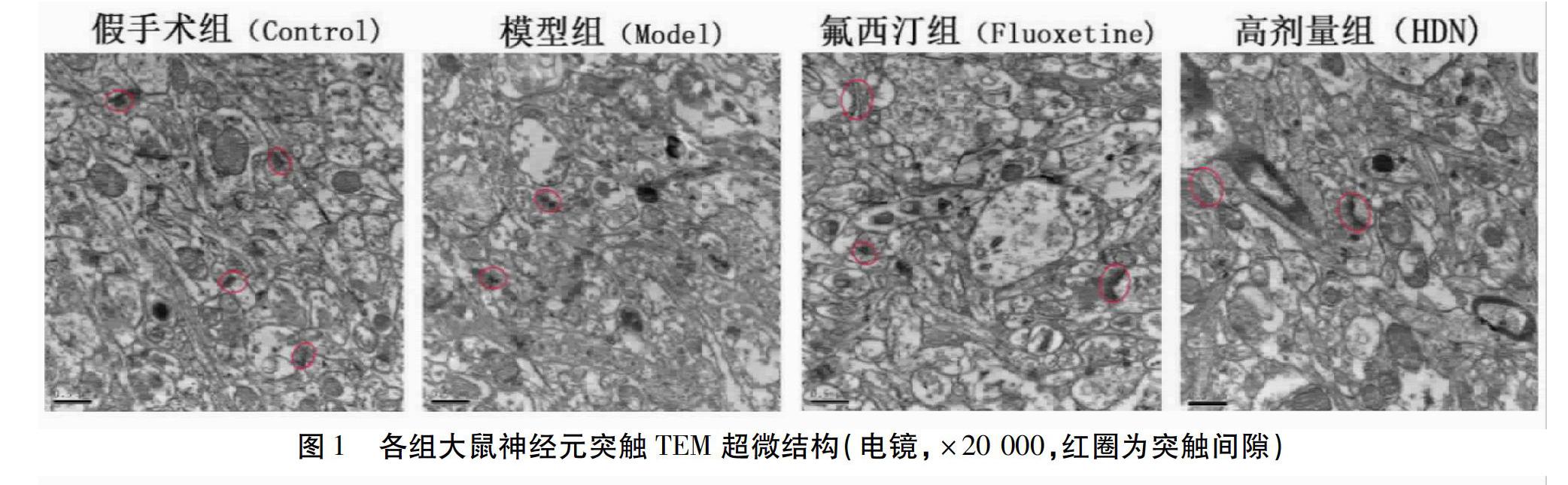
与假手术组比较,模型组PSD大鼠的神经元突触体密度(Synapse Density)降低,且突触后致密物厚度(PSD length)更小,差异有统计学意义(P<0.05);氟西汀组和高剂量神经复元方组神经元突触体密度和突触后致密物厚度明显高于模型组,差异有统计学意义(P<0.05)。见图1~3。
2.4 实时荧光定量PCR检测结果
模型组和低剂量组的BDNF-mRNA表达水平明显低于其他组,经氟西汀和高剂量的神经复元方干预后,BDNF的基因表达显著增高,差异有统计学意义(P<0.05),作为BDNF受体的TrKB的表达也显著增加。中剂量组的BDNF和TrKB基因表达有所增加,但增加的幅度低于高剂量组,差异有统计学意义(P<0.05)。见图4~5。
2.5 蛋白质免疫印迹法分析结果
与假手术组比较,PSD模型大鼠中BDNF蛋白及其特异性受体TrKB的蛋白表达显著受到抑制,但氟西汀和高剂量神经复元方可增加PSD模型大鼠BDNF和TrKB蛋白表达水平。PSD模型组SYNA和SYN I的表达比较假手术组显著降低,差异有统计学意义(P<0.05);氟西汀、高剂量神经复元方组均可提升SYNA和SYN I的表达,干预后表达水平上升,与模型组比较,差异有统计学意义(P<0.05)。模型组GAP-43的表达水平比较假手术组明显降低,差异有统计学意义(P<0.05),但与其他组比较,差异无统计学意义(P>0.05)。见图6。
3 讨论
慢性温和不可预见性应激是抑郁症的一个主要促发因素,本研究采用经典的线栓大脑中动脉加用慢性不可预见温和应激结合孤养法建立PSD大鼠模型。建模21 d后,模型组大鼠糖水消耗量和体质量明显减少,在Morris水迷宫中定位航行潜伏期延长,空间搜索时在目标象限的持续时间及路程缩短、穿越次数减少,差异均有统计学意义,提示建模成功。氟西汀作为一种选择性5-羟色胺再摄取抑制剂,具有高度选择性抑制突触前膜5-羟色胺再摄取的作用,可增加突触间隙中5-羟色胺水平,同时还能作用于突触后膜受体,促进突触可塑性,起到抗抑郁作用,其疗效在临床实践和多项研究中已经得到充分证实[14-15]。本实验中,神经复元方高剂量与氟西汀一样,能明显升高模型大鼠穿越目标象限的次数,降低在目标象限的潜伏时间,且能增强大鼠食欲,2组糖水消耗量在药物干预28 d后比较应激21 d时均有所增加。由此证实神经复元方在剂量上达到一定程度时可较明显改善模型大鼠抑郁症状,提升大鼠学习记忆功能。
目前,研究者认为抑郁症发生是由神经可塑性降低引起,且低水平的神经可塑性是抑郁症遗传倾向性的决定因素[16]。海马神经可塑性主要包括海马神经元的生存、增殖以及突触形态的改变,包括神经末梢发芽、生长,形成新的突触等。神经营养因子与神经可塑性之间具有紧密的联系[17],BDNF是人体含量最多的神经营养因子,其主要生理作用是增加突触可塑性、促进神经发生和神经细胞生存,影响神经传导前遞质5-羟色胺能(5-HT)和多巴胺能(DA)等的释放和突触后递质的传递,对各种神经元的发育分化与生长再生起到一定作用,维持神经细胞生存。TrkB是BDNF的特异性高亲和力受体,广泛分布于中枢神经系统,对神经元的生存、生长、分化有重要影响[18]。本研究通过实时荧光定量PCR实验发现PSD模型大鼠中BDNF及其高亲和力受体TrKB mRNA表达显著受到抑制,而高剂量神经复元方和氟西汀一样可增加PSD模型大鼠BDNF与TrkB mRNA的表达,提示神经复元方可能是通过提高海马组织BDNF和TrkB的表达来发挥治疗PSD的作用。通过透射电镜观察发现,PSD模型大鼠的突触密度和突触后致密物厚度降低,而高剂量神经复元方组和氟西汀组,药物干预后,神经元突触密度和突触后致密物厚度均明显增加,提示药物改善抑郁症状可能机制是促进其突触形成和可塑性改变[19]。
突触素既是一种突触囊泡膜的钙结合蛋白,其本身的磷酸化亦依赖Ca2+,具有调节神经递质释放、学习记忆及突触可塑性等作用。SYN I是神经元特有的一类与突触囊泡相连的磷蛋白,在学习记忆及突触可塑性等生理活动中具有重要作用。SYNA是研究神经细胞可塑性的特异性标志物,其表达与神经可塑性功能成正比,并参与神经元细胞早期非分化突起延伸及其后分化为轴突与树突的过程。GAP-43是神经元特异性磷蛋白,国际上将其作为神经生长发育和损伤修复等神经可塑性研究的首选分子探针,是神经元轴突再生的分子标志物。本实验通过Western Bloting分析发现PSD模型大鼠突触可塑性相关蛋白SYNA和SYN I的表达以及突触生长蛋白GAP-43比较假手术对照组明显降低,提示以上3种蛋白与PSD的发生有一定关系;同时,发现经高剂量神经复元方和氟西汀干预的2组大鼠神经元SYNA和SYN I蛋白表达得到提升,与模型组比较差异明显,GAP-43的表达水平也有所提升但差异不甚明显。
综合所述,可见高剂量神经复元方在治疗PSD模型大鼠时,能显著提升海马BDNF及其特异性受体TrKB的mRNA表达,增强PSD模型大鼠海马神经元突触可塑性。结果表明,神经复元方是一种可有效治疗PSD的中药,其作用机制可能是通过增加海马BDNF/TrkB的含量,促进海马SYN I和SYNA等突触生长相关蛋白表达,增强PSD模型大鼠海马神经元可塑性,从而达到改善抑郁症状,提升学习记忆能力的功效。神经复元方如何介导BDNF/TrkB信号通路产生作用尚需进一步验证。
参考文献
[1]杨弘文,汤春琼,区嘉欢,等.缺血性脑卒中后抑郁的相关影响因素分析[J].中国当代医药,2018,25(10):59-61,64.
[2]蔡丽,谭子虎,刘毅.口服中药与针刺结合治疗脑卒中后抑郁症57例临床研究[J].江苏中医药,2012,44(2):49-51.
[3]张凌凌,金如锋,英洪友,等.神经复元方治疗脑梗死恢复期病人125例临床疗效观察[J].中西医结合心脑血管病杂志,2018,16(23):3419-3421.
[4]尤林,张红雷.盐酸舍曲林治疗老年卒中后抑郁患者的疗效观察[J].中国药物经济学,2018,13(11):118-120.
[5]方力群,樊自豪,刘利.卒中后抑郁模型大鼠海马BDNFmRNA的表达及舍曲林的干预作用[J].黑龙江医学,2011,35(5):333-337.
[6]Koizumi J,Yoshida Y,Nakazawa T,et al.Experimental studies of ischemic brain edema:a new experimental model of cerebral embolism in rats in which recirculation can be introduced in the ischemic area[J].Jpn J Stroke,1986,8:1-7.
[7]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[8]李德强,李旭娟,段金凤,等.乌灵胶囊增加慢性不可预见性温和应激大鼠海马连接蛋白43的表达改善神经再生[J].中西医结合学报,2010,8(7):662-669.
[9]毛雪璇,皮荣标.Morris水迷宫实验影响因素的研究进展[J].中国行为医学科学,2008,17(9):853-855.
[10]孟盼,王宇红,张秀丽,等.百事乐胶囊对慢性应激抑郁模型大鼠海马神经元凋亡的影响[J].中国实验方剂学杂志,2013,19(19):203-207.
[11]戴彦成.健脾清肠方调节DSS诱导结肠炎小鼠肠道运动功能ICC自噬的机制研究[D].上海:上海中医药大学,2016.
[12]章惺惺.Ndrg2、IL-6与糖尿病微血管病变相关性研究及机制探讨[D].苏州:苏州大学,2017.
[13]黄珊.不对称二甲基精氨酸调控胰岛素敏感性的作用及机制研究[D].上海:第二军医大学,2017.
[14]Djordjevic A,Djordjevic J,Elakovi'c I,et al.Fluoxetine affects hippocampal plasticity,apoptosis and depressive-like behavior of chronically isolated rats[J].Prog Neuropsychopharmacol Biol Psychiatry,2012,36(1):92-100.
[15]Djordjevic A,Djordjevic J,Elakovi'c I,et al.Effects of fluoxetine on plasticity and apoptosis evoked by chronic stress in rat prefrontal cortex[J].Eur J Pharmacol,2012,693(1-3):37-44.
[16]Pittenger C,Duman RS.Stress,depression,and neuroplasticity:a convergence of mechanisms[J].Neuropsychopharmacology,2008,33(1):88-109.
[17]Castrén E,Rantamki T.Role of brain-derived neurotrophic factor in the aetiology of depression:implications for pharmacological treatment[J].CNS Drugs,2010,24(1):1-7.
[18]Martinowich K,Manji H,Lu B.New insights into BDNF function in depression and anxiety[J].Nat Neurosci,2007,10(9):1089-1093.
[19]朱奕潼.BDNF对高糖状态下海马神经元保护作用的实验研究[D].上海:上海交通大学,2015.
(2020-03-24收稿 责任编辑:杨觉雄)

