胸腔镜下解剖性肺切除治疗I期肺癌临床效果
周叶枫,胡青,林永德,周浩
江苏省东台市人民医院胸外科,江苏东台 224200
肺癌的发生率一直居高不下,病死率也在各恶性肿瘤中居于前列,对人类生命健康有严重威胁[1]。对于早期确诊的肺癌患者,手术切除是主要治疗方案,以往肺叶切除术结合纵隔淋巴结清扫一直是治疗肺癌的标准术式[2]。既往多为开胸肺叶切除术,这一术式创伤明显,出血量大,术后并发症多,威胁患者预后[3]。随着医学技术的进步,胸腔镜逐渐应用于外科治疗中,有研究认为胸腔镜下肺切除术可获得与开放性手术接近的效果,有研究认为胸腔镜下肺切除术会由于视野受限影响操作[4-5]。为了了解胸腔镜手术在肺癌治疗中的具体应用价值,该研究分析胸腔镜下解剖性肺切除治疗I期肺癌的疗效,以该院2017年1月—2020年4月收治的85例患者为对象分析如下,现报道如下。
1 对象与方法
1.1 研究对象
方便选取85例I期肺癌患者为研究对象,按照入院顺序分为两组,胸腔镜组43例,男27例以及女16例;年龄33~82岁,年龄平均(59.86±13.73)岁。开胸组42例,男31例以及女11例;年龄33~82岁,年龄平均(61.37±12.84)岁。两组年龄、性别差异无统计学意义(P>0.05),具有可比性。纳入标准:①病理结果确诊为肺癌Ⅰ期;②肿块直径≤2 cm;③符合手术适应证;④择期手术;⑤患者签署知情同意书,通过所在医院的伦理审批。排除标准:①癌细胞转移;②以往有恶性肿瘤史;③伴有心肾功能严重障碍;④心肺代偿功能过差影响手术进行;⑤凝血功能障碍。
1.2 方法
胸腔镜组具体操作:患者保持侧卧,腋下垫宽,实施全麻气管插管,选择双腔管对病灶一侧的支气管进行分隔处理,促使该侧肺部塌陷。采取三孔操作法,一组操作孔在腋前线第3~4肋间,长度2.0~3.5 cm;一辅助孔在腋后线第7或8肋间,长度1.5~2.0 cm;一胸腔镜观察孔在腋中线第7或8肋间,长度1.0~1.5 cm。置入胸腔镜探查以确定病灶位置,对相应肺段支气管以及动静脉进行游离、解剖处理。①肺段发育良好患者:肺裂中将肺动脉分离,血管鞘打开后对对应远端肺段动脉进行游离处理,双重结扎后通过超声刀剪断。经肺段动脉向深面对对应肺段支气管行游离处理,通过胸腔镜绿色切割缝合器将其切断。然后顺肺静脉远端游离相应肺段静脉血管,通过白色切割缝合器将其切断。肺段边界:将肺段支气管切断后松开支气管堵塞球囊,患侧保持低压力下通气,保证病变肺段之外的其他肺组织正常膨胀,使需切除肺段的边界显露出来并标记好,选择切割缝合器保证与肿瘤有2 cm间距的前提下将对应肺段切除。②肺裂发育不良患者:将血管鞘打开对肺叶静脉进行游离处理,后继续对远端对应肺段静脉进行游离处理,选择胸腔镜白色切割缝合器将其切断。继续解剖至深面,对对应肺段支气管进行游离处理,选择绿色切割缝合器将支气管切断。对肺段动脉进行游离后行双重结扎后通过超声刀离断。肺段边界处理方法同肺段发育良好患者。术中实施肺段内、肺段间淋巴结活检,送检淋巴结、肿瘤块,最后对纵隔、肺门、肺段淋巴结进行清扫。
开胸组具体操作:患者保持侧卧,腋下垫宽,实施全麻气管插管,作后外侧切口,切口长度20~25 cm,从第5肋间到第6后肋,进入胸腔后对肿瘤位置、大小、浸润情况等进行观察判断,直接清扫肺门、纵膈淋巴结后将肺叶切除。
1.3 观察指标与评价标准
手术情况:切口长度、手术时间、术中出血量、淋巴结清扫数、住院时间。
术后并发症:比较两组术后肺部感染、肺复张不良、心律失常、支气管胸膜瘘、乳糜胸发生率。
生存质量:分别在术前、术后3个月利用EORTC生命质量测定量表QLQ-C30(V30)中文版[6]进行评价,共30个问题,1~28项为1~4级评分,相应表示没有、有点、相当、非常,总分28~112分;29~30项为1~7级评分,表示从非常差到非常好,1~28项得分越高生存质量越差,29~30项得分越高生存质量越好。
1.4 统计方法
采用SPSS 23.0统计学软件对数据进行分析,计量资料用均数±标准差(±s)表示,进行t检验,计数资料采用[n(%)]表示,进行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 手术情况
胸腔镜组切口长度、住院时间短于开胸组,术中出血量少于开胸组,差异有统计学意义(P<0.05),手术时间、淋巴结清扫数与开胸组,差异无统计学意义(P>0.05),见表1。
2.2 术后并发症
胸腔镜组术后并发症发生率为9.30%,低于开胸组术后并发症发生率26.19%,差异有统计学意义(P<0.05),见表2。
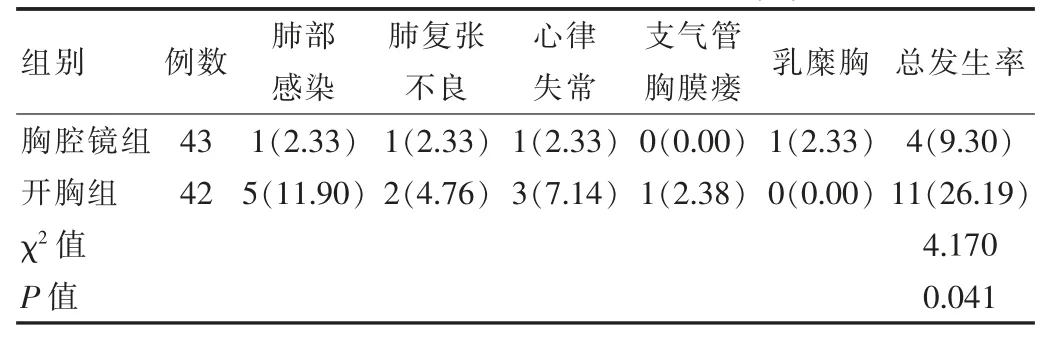
表2 两组术后并发症发生率比较[n(%)]
2.3 生存质量
术前两组生存质量评分差异无统计学意义(P>0.05),术后3个月两组1~28项评分均有下降,29~30项评分均有升高,胸腔镜组术后3个月1~28项评分低于开胸组,29~30项评分高于开胸组,差异有统计学意义(P<0.05),见表3。
表1 两组手术各情况比较(±s)

表1 两组手术各情况比较(±s)
?
表3 两组术前、术后生存质量变化比较[(±s),分]
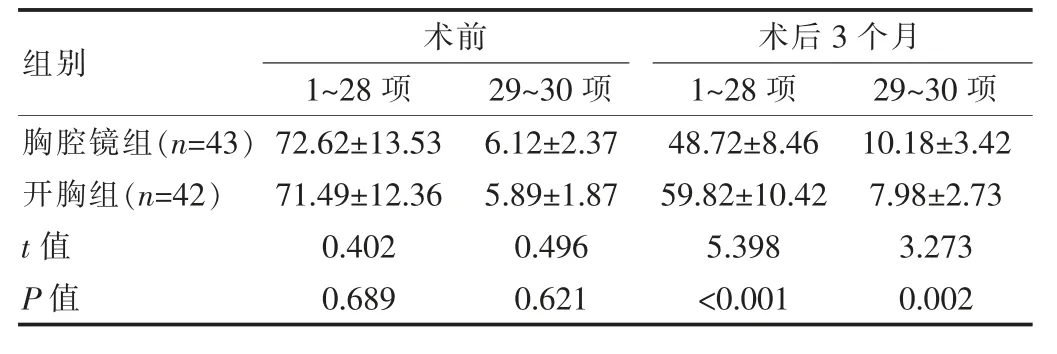
表3 两组术前、术后生存质量变化比较[(±s),分]
?
3 讨论
肺癌患者接受肺叶切除术治疗后肺功能受损伤严重,患者术后恢复难度较大[7]。临床还有一种肺楔形切除术,相较肺叶切除术可减小切除范围,不过其属于非解剖性切除,对于切缘的阴性、阳性不能准确区分,容易出现肺段间淋巴结残留,术后复发风险高[8-9]。随着研究的深入,逐渐发现胸腔镜下解剖性肺段切除术的实施效果更满意,从解剖学上分析,左肺包括上下肺
叶,右肺包括上中下肺叶,进一步细分可以将左肺分为8个肺段,右肺则可以分为10个分段,在胸腔镜下解剖性肺段切除术下,能够更为细致划分病灶,对病灶与正常组织进行了更为精准的鉴别,从而能够最大程度准确切除病灶的同时不损伤正常组织,有助于加快术后恢复[10-12]。
该研究胸腔镜组采取胸腔镜下解剖性肺切除术进行治疗,显示手术时间、淋巴结清扫数与接受开胸肺叶切除的开胸组差异不大,但切口长度、住院时间较开胸组更短,术中出血量更少,表明选择胸腔镜术式不仅不会增加手术时间,能获得接近开胸手术的淋巴结清除效果,且能够减少出血,加快术后出院。该研究胸腔镜组术后并发症发生率为9.30%,低于开胸组26.19%,同时胸腔镜组术后3个月生存质量1~28项、29~30项评分均优于开胸组(P<0.05),表明采取胸腔镜术式能够提升手术治疗安全性,通过减小切口,减轻创伤,从而实现术后并发症的控制,患者生存质量也因为手术质量更高而可得到更快恢复。类似研究[13]也显示,胸腔镜组患者术后共有9例(23.08%)患者出现术后并发症,显著低于传统组的46.15%(χ2=5.135,P<0.05),与该研究结果一致。上述结果显示胸腔镜组效果更优,分析是由于肺段切除术下可对病变组织、正常组织进行准确区分,能够使正常肺组织创伤减轻,使原有肺功能得到最大限度保留,因而能保证术后恢复速度更快,患者生存质量改善更迅速[14]。
综上所述,胸腔镜下解剖性肺切除治疗I期肺癌相较开放术式效果更好,术后并发症更少,生存质量更高。

