MicroRNA-766-3p靶向调控Epac-1影响H9C2心肌细胞凋亡的机制研究
艾克热木·吐尔逊
心肌细胞凋亡属于心肌细胞的程序性死亡,在心肌梗死后的心脏重塑中发挥着重要作用,同时在心力衰竭病理生理过程中也扮演着重要角色。抑制心肌细胞凋亡能有效减轻心肌缺血再灌注损伤,改善心脏重塑过程,延缓心力衰竭的发生,因此,抑制心肌细胞凋亡逐渐成为治疗各种心血管疾病的关键[1-2]。miRNA 是在真核生物中发现的一类内源性的非编码RNA分子,主要在转录后水平调控基因的表达[3]。研究指出,miRNAs参与动脉粥样硬化斑块形成、心肌梗死后血管再生、心肌重构等多项心血管疾病的发生发展,某些miRNAs还可帮助减少心血管事件中心肌细胞的凋亡,抑制组织损伤,促进血管再生,控制室壁纤维化程度,从而改善病人预后[4-5]。miR-766 是近年来被鉴定出具有抑制心肌细胞凋亡作用的miRNA之一。本研究拟明确miR-766在心肌细胞凋亡中的作用及其与相关靶基因的作用关系,为探讨心肌细胞凋亡的分子信号通路研究提供参考。
1 材料与方法
1.1 实验材料 细胞:H9C2心肌细胞购于ATCC(American type culture collection)。主要试剂:DMEM/F12培养基、胰蛋白酶、胎牛血清(GIBCO公司),TRIZOL、PBS缓冲液(Sigma公司),SYBR Premix Ex Taq(TAKARA公司)。miR-766 NC、miR-766 mimics、miR-766 NC inhibitor、miR-766 inhibitor(Thermo Fisher Scientific)。
1.2 方法
1.2.1 细胞培养 将H9C2细胞置于含10%胎牛血清FBS和DMEM/F12培养基中,于5%二氧化碳、37 ℃条件下培养。取对数生长期细胞制成细胞悬液,接种于六孔板中,每孔约105个细胞。
1.2.2 细胞转染 提前1 d将所需离心管与枪头高压灭菌,根据GenMuteTm reagent (signagen)试剂操作指南进行转染(六孔板为例),当细胞生长密度为50%~60%时,取对数生长期细胞1.5×105个接种于六孔板,以次日贴壁细胞量达50%~60%为宜,次日分别以miR-766 NC、miR-766 mimics、miR-766 NC inhibitor、miR-766 inhibitor转染不同孔中,以50 nmol浓度的转染物转染方案为:按每孔一根离心管的原则进行配液,每管先加入100 μL缓冲液(试剂盒中的缓冲液需根据实际加样量,先用ddH2O稀释后方可使用),然后每管对应加入5 μL 10 μmol的miR-766 NC/miR-766 mimics/miR-766 NC inhibitor/miR-766 inhibitor,轻轻吹打混匀,再各加入4 μL转染试剂,吹打混匀,室温孵育15 min后取离心管中的混合液加入六孔板中对应的孔,常规培养48 h后进行后续实验。
1.2.3 RT-PCR实验 H9C2细胞总RNA提取按照RNAprep Pure Micro Kit说明操作,细胞总RNA采用Trizol法,用紫外分光光度仪测定总RNA浓度与纯度,A260/280在1.8~2.0。按照miRNA反转录试剂盒操作说明进行反转录,每个样本逆转录产物cDNA需要量为2.0 μL,利用SYBR Green I法[试剂盒 SYBR Premix Ex Taq Kit (Takara)]在荧光定量PCR仪上行qPCR检测。反应条件:Stage 1 预变性,95 ℃, 30 s;Stage 2扩增反应(共40个循环),95 ℃变性, 5 s,55 ℃退火, 30 s,72 ℃延伸, 30 s,经过qPCR反应后,得到各标本目的基因和管家基因GAPDH表达量的有关数据(Ct值)。Ct值的含义是指每个反应管内的荧光信号达到所设定的阈值时经历的扩增循环数。所有试验重复3次,采用相对定量分析,按照2[△△Ct(实验组)-△△CT(对照组)]计算Epac-1 mRNA表达水平。
1.2.4 细胞凋亡实验(流式细胞术) 分组干预72 h后,将各组细胞培养基分别转移到15 mL的锥形管中并置于冰上。用2 mL PBS 溶液轻轻润洗培养板内细胞,去除PBS 溶液,加0.5 mL 0.25%不含EDTA胰酶孵育,直到显微镜下观察到细胞开始从培养板壁脱落,加完全培养基终止消化。轻轻连续拍打使细胞从培养板壁上完全脱落,将细胞轻轻重悬于预冷缓冲液中制成1×106/mL细胞悬液,取0.5 mL细胞悬液转移至干净离心管内,1 000 r/min离心5 min后加入100 μL Buffer重悬,加入1.25 μL细胞凋亡检测试剂 Annexin V-FITC。室温避光反应1 000 r/min离心15 min后,去除上清,将细胞用0.5 mL预冷的1×结合缓冲液轻轻悬,一管加5 μL Annexin V-FITC,一管加5 μL PI,最后一管加入5 μL Annexin V-FITC+5 μL PI,避光静置20 min后加400 μL Buffer,将悬液经40 μm细胞滤网过滤,立即使用流式细胞仪检测分析。
1.2.5 蛋白质印迹法(Western Blot)实验 待H9C2细胞融合度达90%以上,弃去培养基,加入1 mL预冷的PBS洗涤细胞,轻轻吹打后弃去PBS,每孔加入200 μL预热的胰蛋白酶(含EDTA)进行常规消化,加入适量混匀的细胞裂解液及蛋白酶抑制剂,置冰上裂解30 min,收集细胞置于4 ℃、12 000 r/min 离心15 min,吸取上清液,-80 ℃保存。将待检测蛋白样品用去离子水稀释至适当浓度,取20 μL样品,加入200 μL BCA工作液,混匀后常温放置30 min,然后以A号孔为对照,测定样品在562 nm处的吸收值,根据标准曲线计算蛋白含量。各组以30~60 μg相同的蛋白上样量,煮沸变性后进行10% SDS-PAGE 凝胶电泳。电泳完成后,使用半干转仪转移至PVDF膜,将膜移至含有5%脱脂牛奶封闭液大皿中,PVDF膜的蛋白面朝上,室温下4°摇床上慢摇封闭1~2 h,随后用1%脱脂牛奶稀释一抗,4 ℃孵育过夜。次日使用TBST洗脱一抗,同上方法稀释二抗并将膜转移至二抗稀释液中,室温下孵育1~2 h后,用PBST或TBST在室温下摇床上清洗3次,每次5 min,最后使用化学发光剂进行显影。
1.2.6 靶基因预测及双荧光素酶报告基因 使用TargetScan(http://www.targetscan.org)和microRNA.org-Targets and Expression(http://www.microrna.org) 数据库预测 miR-766 与 Epac-1的结合区域。将Epac-1的miR-766预测靶点序列或突变序列3′-UTR构建于pmirGLO载体。突变序列以正常Epac-1Epac-1的 3′-UTR序列为模板,在与 miR-766 相结合的预测位点进行点突变。将 miR-766 NC、miR-766 mimic、miR-766 NC inhibitor、miR-766 inhibitor 分别与所构建的载体同时利用 DharmFECT Duo 试剂进行转染待测细胞,置于培养箱中培养48 h,采用 Dual-Glo Luciferase分析系统分析实验结果。具体按双荧光素酶报告基因试剂盒说明书操作。
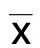
2 结 果
2.1 转染后心肌细胞H9C2中miR-766表达情况 RT-PCR结果显示,与miR-766 NC组细胞相比,miR-766 mimics组细胞中miR-766高表达(P<0.001);与miR-766 NC inhibitor组细胞相比,miR-766 inhibitor组细胞中miR-766则呈低表达(P<0.001)。详见图1。

与miR-766 NC组细胞相比,*P<0.001;与miR-766 NC inhibitor组细胞相比,#P<0.001。
2.2 转染后心肌细胞H9C2中Epac-1表达情况 RT-PCR结果显示,与miR-766 NC组细胞相比,miR-766 mimics组细胞中Epac-1表达降低(P<0.001);与 miR-766 NC inhibitor组细胞相比,miR-766 inhibitor组细胞中Epac-1表达则升高(P<0.001)。
与miR-766 NC组细胞相比,*P<0.001;与miR-766 NC inhibitor组细胞相比,#P<0.001。
详见图2。
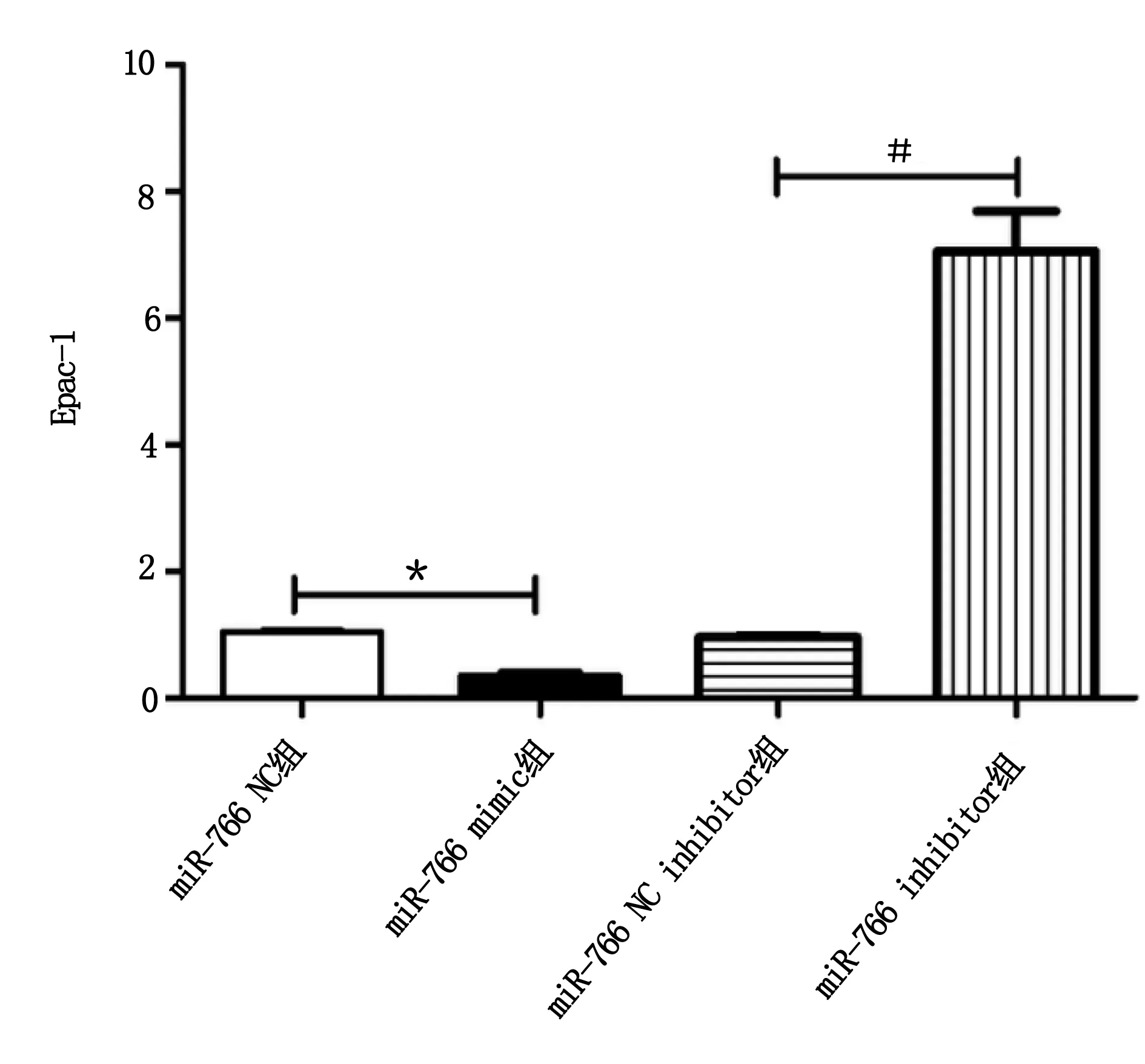
2.3 不同组别心肌细胞凋亡率比较 流式细胞凋亡实验结果显示,与miR-766 NC组细胞相比,miR-766 mimics组细胞凋亡率均增加(P<0.05),与miR-766 NC inhibitor组细胞相比,miR-766 inhibitor组细胞凋亡率则降低,组间差异具有统计学意义(P<0.05)。详见图3、图4。
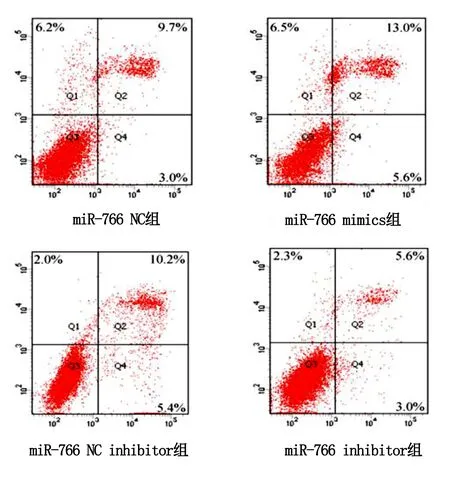
图3 流式细胞凋亡检测不同组别心肌细胞凋亡情况
与miR-766 NC组细胞相比,*P<0.05;与miR-766 NC inhibitor组细胞相比,#P<0.05。
2.4 不同组别心肌细胞中Epac-1及凋亡相关蛋白表达情况 Western Blot实验结果显示,与miR-766 NC组细胞相比,miR-766 mimics组细胞中Epac-1蛋白呈低表达(P<0.05),Bcl-2、Caspase-3等凋亡相关蛋白则呈高表达(P<0.05);相反,与 miR-766 NC inhibitor组细胞相比,miR-766 inhibitor组细胞中Epac-1蛋白呈高表达(P<0.05),Bcl-2、Caspase-3等凋亡相关蛋白则呈低表达(P<0.05)。详见图5。

图5 不同组别心肌细胞Epac-1及凋亡相关蛋白表达情况
2.5 miR-766-3p与Epac-1的靶向关系 结合生物信息学网站预测成熟miR-766-3p序列的靶基因,结果提示miR-766-3p与Epac-1 3′UTR存在结合位点。为了进一步证实 miR-766-3p与Epac-1的直接结合作用,构建了Epac-1野生型和突变型荧光报告载体,并对H9C2心肌细胞进行了转染。双荧光素酶报告基因结果显示,转染野生型Epac-1荧光报告载体的胶质瘤细胞中,miR-766 mimic组细胞荧光活性明显低于miR-766 NC组细胞(P<0.05),miR-766 inhibitor组细胞荧光活性则明显高于miR-766 NC inhibitor组细胞(P<0.05)。miR-766-3p与Epac-1存在直接靶向作用关系。详见图6。
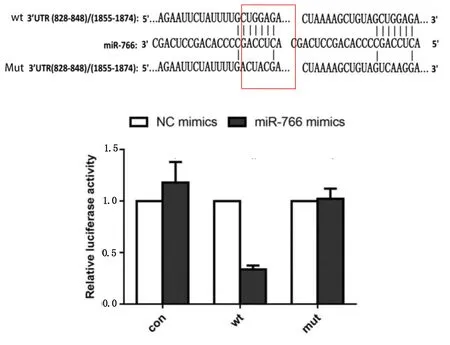
图6 miR-766与Epac-1预测结合位点
3 讨 论
急性心肌梗死是死亡率较高的心血管事件之一,研究指出,心肌梗死的发生主要与相关动脉血管阻塞、心肌细胞缺血缺氧继发的心肌细胞坏死和凋亡有关[6]。心肌梗死病灶中央通常以坏死心肌细胞为主,梗死灶周边部分则以凋亡心肌细胞为主。研究指出,心肌细胞的坏死和凋亡造成心肌细胞数量减少,是引起心力衰竭发生发展的主要原因之一[7-9]。如何减少心肌细胞的凋亡现已成为心肌梗死研究的热点及难点。
miRNAs是一类小分子非编码单链RNA,长18~24个碱基,主要通过与靶基因 3′UTR区域的结合,发挥降解靶基因mRNA或抑制靶基因翻译的作用。miRNAs可通过调控其靶基因作用,参与调节细胞增殖、分化、凋亡等生理病理过程,在机体生长发育的各个阶段发挥着重要的调节作用。近年来,有证据显示, miRNAs参与调控心血管疾病的发生发展,包括内皮细胞功能障碍、细胞黏附力改变、血小板的生长和破裂、心肌细胞的增殖凋亡等,都离不开miRNAs的调控[10]。miRNAs在心血管疾病诊断、治疗及预后评估中的价值也越来越受到人们的关注,miRNA也逐渐成为临床治疗和预防心肌细胞凋亡及相关疾病的靶标分子。李瑞萍等[11]研究发现,在缺氧预处理条件下,心肌细胞中miRNA-30c-2-3p呈低表达,低表达miRNA-30c-2-3p可通过促进XBP1s表达水平增加,减轻心肌细胞缺氧再灌注损伤,发挥心肌保护效应。miRNA-223可通过靶向作用PARP-1,通过(Akt/mTOR)信号通路途径保护新生大鼠心肌细胞,减少心肌细胞凋亡的发生[12]。miR-142-3p可通过直接抑制(HMGB1)表达,影响转化生长因子-β1(TGFβ1)/Smad3信号通路作用,从而抑制心肌细胞凋亡和纤维化的发生,起到心肌细胞保护作用[13]。另有研究发现,miRNA-1和 miRNA-133a在大鼠心肌细胞氧化应激中调控凋亡信号途径,在氧化应激时miRNA-1 表达明显升高,可促进细胞凋亡的发生,提示miRNA广泛参与心肌细胞的凋亡调控[14]。作为miRNA家族成员之一,miR-766也可通过调控靶基因的表达参与调控多种疾病的发生发展。有体外实验发现,miR-766在高糖环境呈明显高表达,抑制心肌细胞中miR-766表达可明显降低细胞凋亡率,进一步的凋亡实验结果显示,高糖培养的心肌细胞中高表达的miR-766可促进心肌细胞凋亡,提示在心肌细胞凋亡过程中,miR-766发挥着一定的调节作用[15]。为了进一步探究miR-766调控心肌细胞凋亡的靶基因及信号通路作用,本研究结合蛋白实验、细胞凋亡实验及双荧光素酶报告基因实验进行进一步探究。结果显示,外源性上调miR-766表达,可明显促进心肌细胞的凋亡,靶向抑制miR-766的表达,则可抑制心肌细胞凋亡的发生,且其对心肌细胞凋亡的调控作用与Bcl-2、Caspase-3等相关凋亡蛋白表达相关。靶基因预测结果提示,miR-766在心肌细胞中可直接靶向Epac-1。Epac-1 是近年来新发现的一个环腺苷酸感应蛋白家族,是调节心脏活动的主要受体,与心肌细胞的凋亡密切相关,在高糖处理的H9C2细胞中表达明显下调,沉默 Epac-1可显著逆转肠促胰素exendin-4的抗凋亡作用[16]。本研究发现,miR-766靶向Epac-1调控心肌细胞凋亡主要与Bcl-2、Caspase-3等凋亡相关蛋白表达有关,但具体作用机制及相关信号通路尚未明确。有待后续研究进一步反向分析miR-766与Epac-1的靶向作用关系。
综上所述,miR-766 可通过负向调控 Epac-1 促进心肌细胞凋亡,miR-766与Epac-1有望成为干预心肌细胞凋亡的临床治疗新靶点。

