急性心肌梗死合并多支血管病变病人首次PCI术后未干预病变斑块进展的危险因素分析
张 扬,辛 璐
急性心肌梗死(acute myocardial infarction,AMI)是目前临床上常见的心血管疾病之一,具有极高的致死率、致残率,临床研究发现其发病是由于冠状动脉的先天畸形、炎症、粥样硬化或持续痉挛等原因而引起的血栓所导致的冠状动脉分支堵塞,从而使一部分心肌出现心肌急性缺血的症状[1-2]。而合并多支血管病变的病人出现严重弥漫性心肌损伤的可能性更大,发生心力衰竭等危重并发症的危险性也明显增加[3]。对AMI合并多支血管病变病人行冠状动脉介入(PCI)术可通过再灌注治疗使病人冠状动脉重新疏通,可通过快速、有效地恢复血液循环而改善病人预后[4]。近年来,临床研究发现,AMI合并多支血管病变病人PCI术后未干预病变斑块会随着病情进展而进一步加重,明显增加PCI术后不良心血管事件的发生率,不利于病人预后[5]。本研究旨在探讨AMI合并多支血管病变病人首次PCI术后未干预病变斑块进展的危险因素,以期为AMI合并多支血管病变的临床治疗提供指导。
1 资料与方法
1.1 临床资料 回顾性分析2018年2月—2019年4月于本院行PCI术治疗的93例AMI合并多支血管病变病人的临床资料,根据首次PCI术后未干预病变斑块进展情况将其分为再次行PCI术组(24例)与未再次行PCI术组(69例)。再次行PCI术组,男14例,女10例;年龄56~75岁。未再次行PCI术组,男41例,女28例;年龄53~72岁。纳入标准:①所有病人病历资料完整;②参照2010年中华医学会心血管病学分会制定的《AMI诊断和治疗指南》中AMI相关诊断标准[6];③病人发病12 h内经冠状动脉造影证实合并多支血管病变[≥2支冠状动脉主要血管(直径≥2 mm)明显狭窄达到70%及以上];④经诊断病人伴缺血性胸痛发作时间<12 h或≥12 h但仍有缺血性胸痛;⑤经冠状动脉造影检查确定梗死相关动脉,首次PCI术中仅对梗死血管进行干预,以残余狭窄<20%为PCI手术成功判定标准;排除标准:①伴有凝血功能障碍;②有先天性心脏病;③伴有免疫系统、造血系统疾病或严重感染性疾病;④植入冠状动脉支架时有冠状动脉夹层或无复流;⑤合并恶性肿瘤;⑥有精神类疾病史[7-8]。本研究经本院伦理委员会审核通过。
1.2 方法 收集两组病人性别、年龄等基线资料,以及两组病人首次PCI术前24 h心肌肌钙蛋白I(cTnI)、肌酸激酶同工酶(CK-MB)、氨基末端脑钠肽前体(NT-proBNP)、超敏C-反应蛋白(hs-CRP)、白细胞介素-6(IL-6)水平。入院后抽取病人空腹外周肘静脉血3~5 mL于干燥抗凝试管中,以3 000 r/min离心10 min(离心半径12 cm)后抽取上清液,置于-80 ℃冰箱待测。采用化学发光免疫分析法测定cTnI、CK-MB,采用胶体金法测定NT-proBNP,采用荧光定量免疫层析法测定hs-CRP、IL-6。VI-180全自动化学发光免疫分析系统及配套试剂盒由北京贝尔生物工程有限公司提供,HF-240全自动生化分析仪及配套试剂盒由济南汉方医疗器械有限公司提供,以上操作均由本院经验丰富的检验科医师完成。对血管直径狭窄率超过50%的病变进行血管内超声检查,其中血管直径狭窄率=病变处管腔丢失直径/病变前或后相对正常管腔直径×100%,未干预病变斑块为斑块面积负荷超过50%者。由桡动脉入路进行冠状动脉造影检查,将导丝送至左右两侧冠状动脉开口处,然后注入造影剂显影,由影像科医师裸眼观察左右冠状动脉病变情况,在检查过程中应注意行多角度投照以全面观察病变情况;入院后对血管直径狭窄率超过50%、初始PCI未干预的病变进行冠状动脉造影检查,将直径再狭窄程度超过10%的病变定义为未干预病变斑块进展。
2 结 果
2.1 两组基线资料比较 两组左室射血分数(LVEF)、Killip分级、心肌梗死溶栓试验(TIMI)血流分级及Gensini评分比较,差异均有统计学意义(P<0.05);其余基线资料比较差异均无统计学意义(P>0.05)。详见表1。
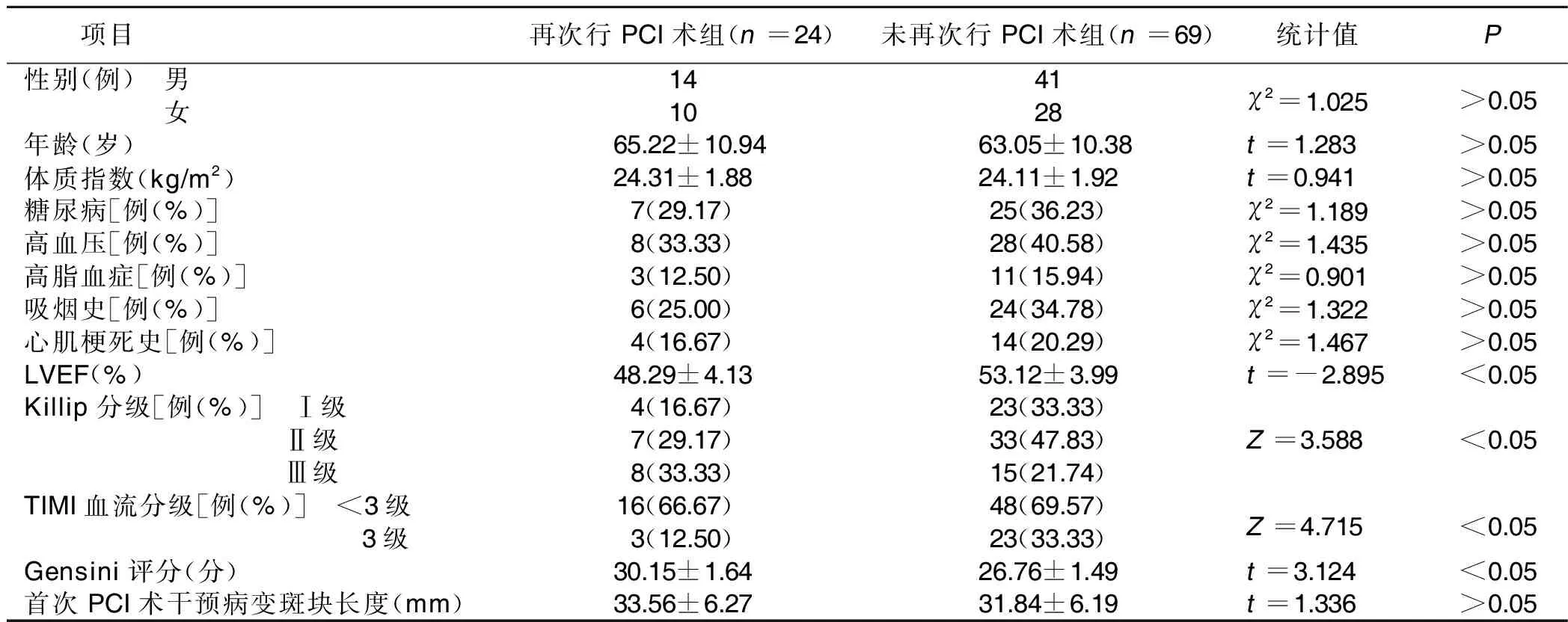
表1 两组基线资料比较
2.2 两组首次PCI术前24 h实验室指标比较 再次行PCI术组首次PCI术前24 h cTnI、CK-MB、NT-proBNP、hs-CRP及IL-6水平均高于未再次行PCI术组(P<0.05)。详见表2。
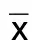
表2 两组PCI术前24 h实验室指标比较 (±s)
2.3 首次PCI术后未干预病变斑块病人冠状动脉病变程度与cTnI、CK-MB、NT-proBNP、hs-CRP及IL-6水平的相关性 Spearman等级相关分析显示,AMI合并多支血管病变病人cTnI、CK-MB、NT-proBNP、hs-CRP及IL-6水平与Gensini评分均呈正相关(r值依次为0.541、0.534、0.502、0.657、0.611,P均<0.05)。表明AMI合并多支血管病变病人cTnI、CK-MB、NT-proBNP、hs-CRP及IL-6水平越高则冠状动脉病变程度越严重,首次PCI术后未干预病变斑块进展风险越高。
2.4 AMI合并多支血管病变病人首次PCI术后未干预病变斑块进展的危险因素分析 以AMI合并多支血管病变病人再次行PCI术治疗为因变量,对单因素分析中的可能影响因素进行多因素Logistic回归分析,结果显示,Killip分级、TIMI血流分级、cTnI、CK-MB、NT-proBNP、hs-CRP及IL-6为AMI合并多支血管病变病人首次PCI术后未干预病变斑块进展的独立危险因素(P均<0.05)。详见表3。
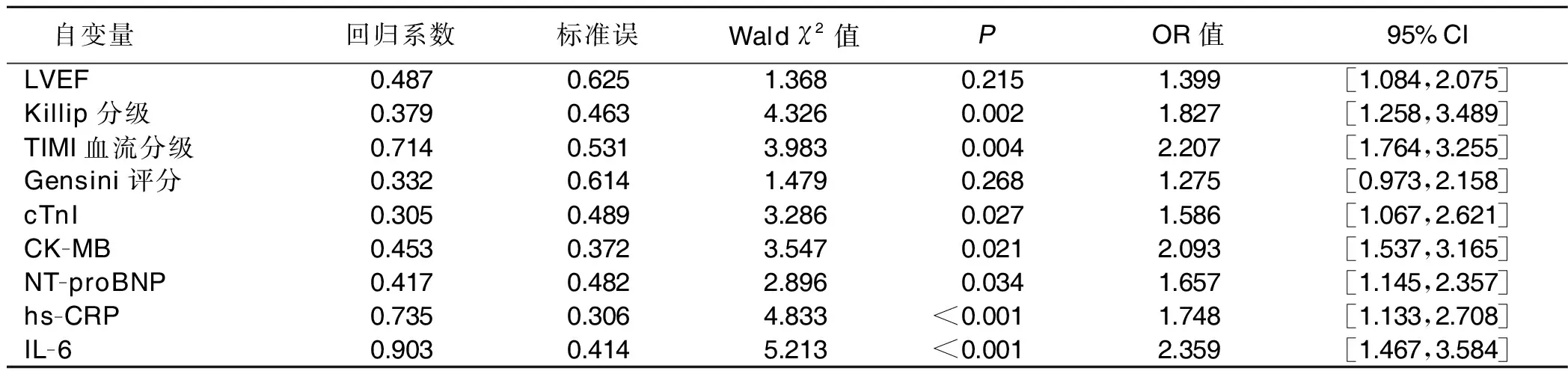
表3 AMI合并多支血管病变病人首次PCI术后未干预病变斑块进展的危险因素分析
3 讨 论
AMI合并多支血管病变病人治疗的关键是重新疏通梗死相关血管,使冠状动脉血流灌注得以恢复[9]。目前,PCI术是AMI合并多支血管病变病人的重要治疗手段,可有效拯救缺血心肌细胞,积极改善血流供应,但部分AMI合并多支血管病变病人虽然首次PCI术较为成功,但首次PCI术后未干预病变斑块仍有进展为冠脉综合征的风险[10-11]。未干预病变斑块由于狭窄率较低一般暂时不会发生心肌缺血,但由于大部分病变斑块稳定性较差,随着病情进展极易发生破损而导致心血管事件的发生。据统计,因首次PCI术后未干预病变斑块而引起的不良心血管事件约占术后不良心血管事件的12%[12]。有研究表明,体内炎症反应是AMI合并多支血管病变病人首次PCI术后未干预病变斑块进展的危险因素之一[13],究其原因可能是病人机体内炎性因子具有对细胞外基质加速降解及增大管径的作用,可促进内膜上斑块的生长,使斑块稳定性持续变差,最终导致斑块受损程度加重[14]。
AMI合并多支血管病变病人术前cTnI、CK-MB、NT-proBNP、hs-CRP及IL-6水平均明显升高,而AMI合并多支血管病变病人首次PCI术后未干预斑块进展相关性的报道较少见,且并不全面[15]。本研究结果发现,两组LVEF、Killip分级、TIMI血流分级及Gensini评分比较,差异有统计学意义(P<0.05),再次行PCI术组AMI合并多支血管病变病人首次PCI术前24 h cTnI、CK-MB、NT-proBNP、hs-CRP及IL-6水平均高于未再次行PCI术组,表明AMI合并多支血管病变病人首次PCI术前24 h cTnI、CK-MB、NT-proBNP、hs-CRP水平明显升高,提示其可能与首次PCI术后未干预病变斑块进展有关。Spearman相关分析表明,AMI合并多支血管病变病人cTnI、CK-MB、NT-proBNP、hs-CRP及IL-6水平与Gensini评分均呈正相关,表明AMI合并多支血管病变病人cTnI、CK-MB、NT-proBNP、hs-CRP及IL-6水平越高则冠状动脉病变程度越严重,首次PCI术后未干预病变斑块进展风险越高。多因素Logistic回归分析结果显示,Killip分级、TIMI血流分级、cTnI、CK-MB、NT-proBNP、hs-CRP及IL-6为AMI合并多支血管病变病人首次PCI术后未干预病变斑块进展的独立危险因素。可见斑块性质除受Killip分级与TIMI血流分级影响外,首次PCI术前24 h较高的血清cTnI、CK-MB、NT-proBNP、hs-CRP及IL-6水平也与斑块性质密切相关,分析其原因为[16-17]:①血清cTnI、CK-MB、NT-proBNP水平可准确反映病人心肌受损程度及斑块进展;②hs-CRP及IL-6作为常见的炎性因子,可通过激活粥样斑块内部补体,以促使血管壁内单核细胞不断涌入及促炎介质的释放,进而降低斑块稳定性,使斑块发生破损的风险增加;③较高水平的血清hs-CRP、IL-6可通过促进活性氧簇释放而引起血管内皮功能异常,对动脉粥样硬化的进展起到一定的推动作用,进而诱发斑块破裂。
本研究存在以下局限性:纳入的样本量偏少,可能因研究人员之间的差异造成统计结果的偏差,因此,AMI合并多支血管病变病人首次PCI术后未干预病变斑块进展的影响因素仍有待于扩大样本量进行更深入的多中心、前瞻性研究。
综上所述,AMI合并多支血管病变再次行PCI术病人血清cTnI、CK-MB、NT-proBNP、hs-CRP及IL-6水平均明显升高,均与入院时Gensini评分呈正相关,且为AMI合并多支血管病变病人首次PCI术后未干预病变斑块进展的独立危险因素。

