双胎妊娠孕早期甲状腺功能及其与早产的关联性
宋沁峰,李宏田,杨 静,原鹏波,程志浩,刘建蒙△,赵扬玉△
(1.北京大学生育健康研究所,国家卫生健康委员会生育健康重点实验室,北京 100191;2.北京大学公共卫生学院流行病与卫生统计学系,北京 100191;3.北京大学第三医院妇产科,北京 100191)
甲状腺是成年人最大的内分泌腺,评价其功能的主要指标包括促甲状腺激素(thyroid stimulating hormone,TSH)、游离甲状腺素(free thyroxine,FT4)、甲状腺过氧化物酶抗体(antithyroperoxidase anti-body,TPOAb)和甲状腺球蛋白抗体(antithyroglobulin antibody,TgAb)。女性甲状腺功能受多种因素影响,其中妊娠是重要因素之一。女性妊娠后体内人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)升高,其α亚单位与TSH相似,作用于甲状腺后可致FT4水平上升,TSH水平因FT4升高会有所下降[1];TPOAb和TgAb滴度也会因母体对胎儿的免疫耐受作用而有所下降[2]。同单胎妊娠相比,双胎妊娠hCG基础水平更高,高水平hCG持续时间更长,故双胎妊娠孕妇体内甲状腺激素变化幅度更大[3-4]。由于hCG浓度在孕早期达到高峰[1],孕早期甲状腺功能指标水平变化幅度最大,且孕12周前胎儿完全依赖母体甲状腺激素[5],故在全孕程中,孕妇孕早期甲状腺功能状况尤为重要。
鉴于甲状腺激素水平随妊娠状态变化而变化,国内外研究一致认为有必要根据妊娠期特异性参考范围开展妊娠期甲状腺疾病的诊断和治疗[1,3,6]。值得注意的是,虽有研究探索建立了单胎与双胎妊娠特异的甲状腺激素参考范围[7-8],但其临床应用较为有限。绝大多数医疗机构报告妊娠期甲状腺激素检测结果时仅提供普通成人参考范围,这不仅有碍于妊娠期甲状腺疾病的诊疗,还有可能因甲状腺激素超出化验单标识的参考范围而给孕妇带来不必要的心理负担。不同妊娠胎数的甲状腺激素参考范围应用相对滞后,亟待开展相关研究。
早产是常见不良妊娠结局,也是造成新生儿死亡的重要原因[9],其发生与孕妇甲状腺功能密切相关。单胎妊娠研究发现,同甲状腺功能正常者相比,甲状腺功能亢进(简称“甲亢”)者早产发生风险增加80%,甲状腺功能减退(简称“甲减”)者增加30%[10],甲状腺自身抗体阳性也是早产危险因素[11]。对于双胎妊娠,由于子宫过度膨胀、高浓度FT4增加胎盘血管阻力等原因,胎儿对孕妇甲状腺功能变化可能更为敏感[12],但鲜有研究探讨双胎妊娠孕妇甲状腺功能状况与早产的关联性。
基于前瞻性双胎妊娠队列,本研究根据普通成人、单胎和双胎参考范围分别判定双胎妊娠孕妇孕早期甲亢与甲减发生情况,评价其与早产的关联性,以期揭示双胎妊娠孕妇孕早期甲状腺功能对早产的潜在影响,为建立双胎妊娠特异性甲状腺功能指标参考范围提供科学数据。
1 资料与方法
1.1 资料来源与研究对象
选取2017年3月至2020年2月在北京大学第三医院产科就诊的821例孕早期双胎妊娠孕妇为研究对象,其中743例随访至分娩。通过问卷收集研究对象的社会人口学特征、孕产史、临床常规检查信息(包括甲状腺功能指标)及妊娠结局发生情况。在剔除108例不良妊娠结局者(死胎死产、减胎)、52例孕5~13周未接受甲状腺功能指标检测者及13例甲状腺功能指标可疑异常者后,共纳入570例孕妇。本研究经北京大学第三医院医学科学研究伦理委员会批准(批准号:IRB00006761-2016145),所有研究对象均签署知情同意书。
1.2 定义及分类
甲状腺功能指标(TSH、FT4、TPOAb、TgAb)检测仪器为ADVIA Centaur XP全自动化学发光免疫分析仪,检测试剂盒生产企业为Siemens Healthcare Diagnostics股份有限公司。根据三种甲状腺激素参考范围判定甲亢和甲减,第一种参考范围是普通成人参考范围,该参考范围是试剂盒说明书指定的参考范围,研究医院检测报告所示参考范围与其基本一致;第二种参考范围是基于254例单胎妊娠孕妇建立的参考范围[7];第三种参考范围是基于160例双胎妊娠孕妇建立的参考范围[8],第二种和第三种参考范围对应研究的检测方法和检测试剂盒与本研究一致。普通成人、单胎和双胎参考范围的TSH上、下限和FT4上限详见图1,FT4下限依次为8.9、10.4和9.7 ng/L。TSH低于参考范围下限则判定为甲亢;TSH高于参考范围上限且FT4低于下限判定为临床甲减,TSH高于参考范围上限但FT4未超出参考范围判定为亚临床甲减,二者均归为甲减[1]。三种参考范围的甲状腺自身抗体阳性均指TPOAb或TgAb滴度超过试剂盒参考范围上限(6×104U/L)[1]。
以三种参考范围判定均正常的孕妇为对照,并将甲亢和甲减孕妇分为多个亚类。根据TSH下限呈现普通成人参考范围>单胎特异参考范围>双胎特异参考范围的特点,将甲亢孕妇划分为三类:普通成人参考范围判定甲亢但单胎特异参考范围判定正常者、单胎特异参考范围判定甲亢但双胎特异参考范围判定正常者、双胎特异参考范围判定甲亢者,此三类孕妇甲亢严重程度由轻到重,可依次视为轻度、中度和重度甲亢。根据TSH上限呈现双胎特异参考范围<普通成人/单胎特异参考范围、FT4上限呈现双胎特异参考范围>普通成人/单胎特异参考范围的特点,将甲减孕妇划分为两类:双胎特异参考范围判定甲减但普通成人和单胎特异参考范围判定正常者、普通成人或单胎特异参考范围判定甲减者,此两类孕妇甲减严重程度由轻到重,可分别视为轻度和重度甲减,详见图1。以上严重程度分类仅为便于研究结果展示,并非临床实践真实分类。
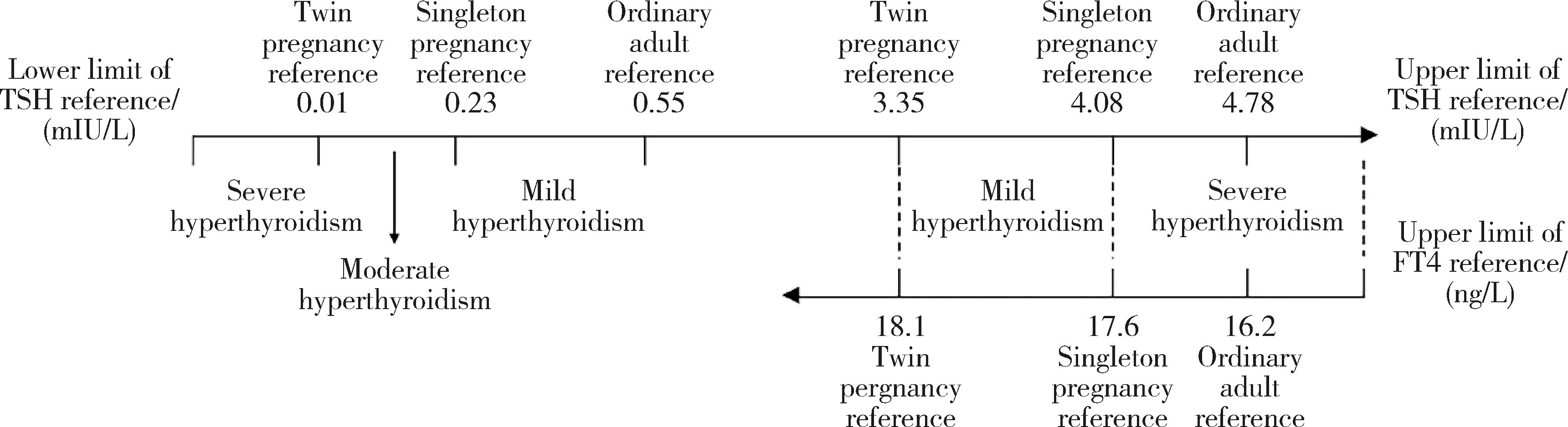
TSH,thyroid stimulating hormone;FT4,free thyroxine.图1 TSH、FT4参考范围及甲亢、甲减亚组分类Figure 1 TSH and FT4 references and classification of hyperthyroidism and hypothyroidism
早产指所有不满37周的分娩[13],高龄产妇为分娩年龄≥35岁者。孕前体重指数(body mass index,BMI)<18.5 kg/m2为偏瘦,18.5 kg/m2≤BMI<24.0 kg/m2为正常,24.0 kg/m2≤BMI<28.0 kg/m2为超重,BMI≥28.0 kg/m2为肥胖[14]。宫颈机能不全判定依据为宫颈长度<2.5 cm或宫颈内口开大。
1.3 质量控制
参与研究的所有人员经由统一培训,所有数据经由统一平台录入,数据平台通过限定范围、交叉互验等方式保障数据质量。另在开展分析前对甲状腺功能指标做了严格的核查与清理,基于末次月经日期与超声报告孕周对分娩孕周做了双重核查。
1.4 统计学分析
采用中位数(四分位数间距)描述非正态分布计量资料;采用频数(%)及χ2检验描述与比较计数资料。采用单变量和多变量对数二项式模型分析孕早期甲状腺功能与早产的关联性,分别以粗相对危险度(crude risk ratio,CRR)和调整相对危险度(adjusted relative risk,ARR)评价关联强度。采用后退法在孕妇基本特征中筛选调整变量,最终模型仅保留回归系数显著变量。数据清理与统计分析均使用R 4.0.2软件,所有检验均为双侧,P<0.05为差异具有统计学意义。
2 结果
2.1 基本特征
研究共纳入570例双胎妊娠孕妇,其中高龄占36.5%,汉族占92.6%,多数具有大专及以上文化程度(90.9%);初产妇占86.7%,通过辅助生殖技术受孕者占72.7%,双绒毛膜双胎占75.8%;分娩方式以剖宫产为主(92.6%),详见表1。

表1 研究对象基本特征Table 1 Characteristics of participants
2.2 孕早期甲状腺功能状况
孕妇进行甲状腺功能指标检测的孕周中位数为8周(四分位数间距:7~9周),TSH和FT4中位水平(四分位数间距)分别为0.92(0.40~1.54) mIU/L和13.8(12.5~15.2) ng/L,TPOAb、TgAb和甲状腺自身抗体阳性率分别为 14.9%、18.0%和21.5%。根据普通成人、单胎和双胎参考范围,甲减检出率分别为1.2%、1.6%和3.5%,甲亢检出率分别为32.6%、18.1%和1.1%。不同参考范围的甲减与甲亢检出率差异均具有统计学意义(P<0.001),详见表2。

表2 根据三种参考范围判定的双胎妊娠孕妇孕早期甲减和甲亢情况Table 2 Hypothyroidism and hyperthyroidism of first-trimester twin pregnant women according to three references
2.3 根据三种参考范围判定的孕早期甲状腺功能异常情况与早产的关联性
孕妇中早产者301例(包括6例分娩孕周<28周),单因素分析发现,与三种参考范围判定均正常的孕妇相比,重度甲亢孕妇早产发生风险显著增加。经多因素分析调整孕前BMI、产次、受孕方式、绒毛膜性4个潜在混杂因素后,重度甲亢孕妇早产发生风险显著高于正常孕妇(ARR=1.41,95%CI:1.14~1.75);中度和轻度甲亢孕妇与正常孕妇的早产发生风险差异均无统计学意义;轻度和重度甲减孕妇早产发生风险显著或临界显著高于正常孕妇(ARR=1.53,95%CI:1.03~2.28;ARR=1.40,95%CI:0.88~2.22),详见表3。
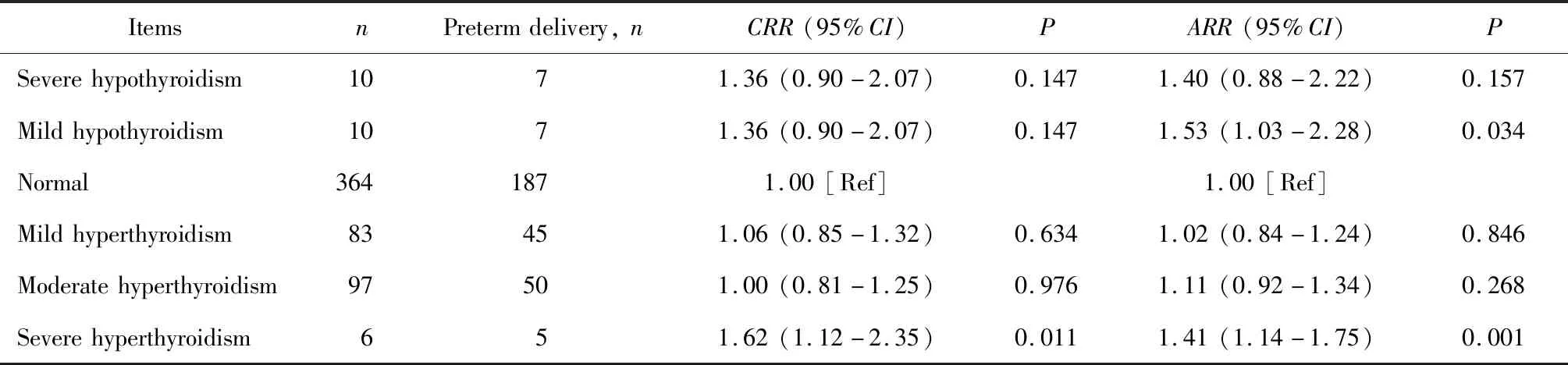
表3 各亚类甲减、甲亢与早产的关联性Table 3 Association between subtypes of hypothyroidism,hyperthyroidism and preterm delivery
2.4 孕早期甲减及甲状腺自身抗体阳性与早产的关联性
经多因素分析调整孕前BMI、产次、受孕方式、绒毛膜性4个潜在混杂因素后,双胎特异参考范围判定的单纯甲减孕妇、单纯甲状腺自身抗体阳性孕妇、甲减合并甲状腺自身抗体阳性孕妇早产发生风险分别是双胎特异参考范围判定正常且甲状腺自身抗体阴性孕妇的1.46倍(95%CI:0.93~2.27)、1.32倍(95%CI:1.15~1.52)和1.78倍(95%CI:1.30~2.44);甲减与甲状腺自身抗体阳性对早产影响的交互作用不显著(P=0.760),详见表4。
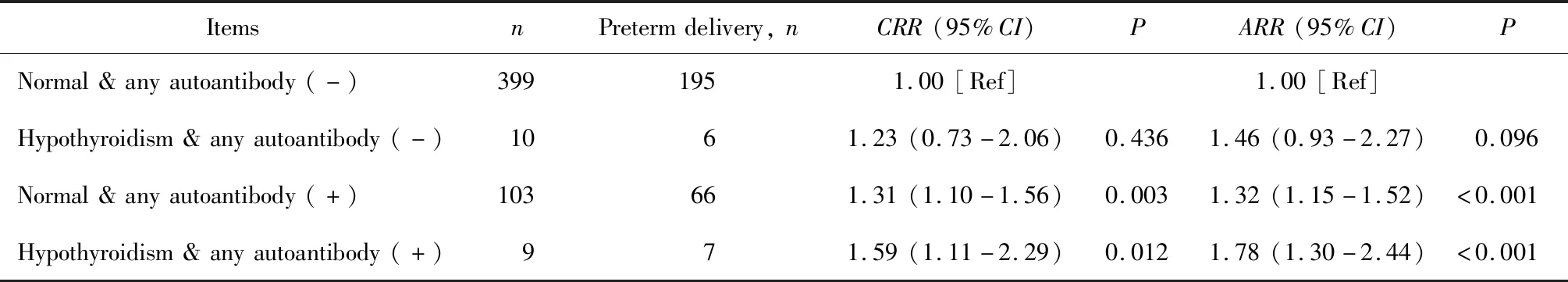
表4 甲减及甲状腺自身抗体阳性与早产的关联性Table 4 Association between hypothyroidism,positive thyroid autoantibody and preterm delivery
3 讨论
本研究根据普通成人参考范围的甲亢检出率(32.6%)是依据双胎特异参考范围(1.1%)的29倍,且仅双胎特异参考范围检出甲亢的孕妇早产风险有所增加,这表明如果在临床实践中应用普通成人参考范围,将有超过30%孕妇可能会误以为自己罹患甲亢进而产生心理负担。就甲减而言,根据双胎特异参考范围的检出率(3.5%)为根据普通成人参考范围(1.2%)的 2.9倍,而根据非双胎特异参考范围漏诊甲减的孕妇与根据非双胎特异参考范围检出甲减的孕妇早产发生风险相当,这提示如果在临床实践中根据非双胎特异参考范围判断双胎妊娠孕妇甲减发生情况,将有约2%孕妇虽被判定为正常但其早产发生风险却会增加。由此可见,根据双胎特异参考范围判断双胎妊娠孕妇孕早期甲亢与甲减发生情况极具必要性。
早产病因不清,发病机制复杂。早产史、高龄、牙周疾病、低BMI、多胎妊娠、辅助生殖、妊娠并发症或合并症等均是早产的危险因素[13,15]。单胎妊娠研究发现,甲亢和原发性甲减孕妇早产发生风险分别为正常孕妇的 1.8倍和1.3倍[10]。本研究根据双胎特异参考范围检出甲亢孕妇早产发生风险(ARR=1.41)点估计值低于上述单胎研究,可能与双胎妊娠早产发生率较高限制了相对危险度有关;即便受此影响,本研究根据双胎特异参考范围检出甲减孕妇的早产发生风险(ARR=1.53)点估计值依然高于上述单胎研究。甲状腺功能异常与早产关联的可能机制为甲状腺激素调节血管阻力进而影响胎盘功能[12],以及甲状腺激素和抗体在早产相关免疫反应和炎症过程中发挥作用[16]。另有研究表明,甲状腺功能异常可增加妊娠期糖尿病和高血压等早产高危因素的发生风险[17-19],故中、晚期妊娠合并症和并发症也可能为中间通路。在辅助生殖技术应用日益广泛、双胎妊娠发生率逐年增长的背景下[20],建立与推广双胎妊娠特异甲状腺功能指标参考范围或可为早产预防提供新思路。
甲状腺自身抗体对甲状腺造成的损伤可致其无法产生足够激素进而诱发甲减[1],鉴于甲状腺自身抗体与甲减紧密相关,研究进一步对其二者与早产的关联性进行了综合分析。同判定正常且甲状腺自身抗体阴性者相比,单纯甲减者早产发生风险增加了46%,甲减合并甲状腺自身抗体阳性者可进一步增加至78%,提示采用双胎妊娠特异参考范围判定甲减后,结合抗体情况进行孕期指导将会提升双胎妊娠特异参考范围在预防早产中的实践价值。
本研究主要优势如下:就方法而言,研究依托前瞻性队列开展,暴露和结局变量均经过仔细核查,数据质量较高;就内容而言,尽管《妊娠和产后甲状腺疾病诊治指南》(第2版)推荐在各地区或各检测机构建立方法特异、妊娠时段特异的血清甲状腺功能指标参考范围以诊断妊娠期甲状腺功能异常[1],也有学者尝试建立了双胎特异参考范围,但既往并无研究量化评估非双胎特异参考范围应用于双胎妊娠孕妇这一普遍临床现象的潜在不利影响,本研究定量评价了根据普通成人、单胎和双胎参考范围评估双胎妊娠孕妇孕早期甲状腺功能的准确性,且定量分析了根据各判定结果评估早产发生风险的效果差异,研究结果具有较高临床参考价值。然而,本研究也存在一定局限性:首先,不同检测方法、试剂盒对甲状腺功能指标检测结果存在影响,且所用单双胎妊娠参考范围均基于单中心、较小规模人群建立,故甲亢和甲减检出率外推需谨慎;其次,研究样本量虽然较大,但部分亚组阳性结局例数仍偏少,把握度较低,阴性结果有待进一步确证;再次,纳入孕妇辅助生殖率较高,而辅助生殖技术可影响内分泌和免疫系统平衡进而增加甲状腺功能异常风险[2],故所得甲亢和甲减检出率可能偏高;此外,研究评价甲状腺功能异常对妊娠结局影响时,仅选择了早产这一典型不良妊娠结局,且未探究甲状腺功能异常对不同亚型早产影响。
综上,根据不同参考范围判定的双胎妊娠孕妇孕早期甲状腺功能状况差异显著。根据普通成人或单胎特异参考范围可能会漏诊甲减、误诊甲亢。甲减漏诊孕妇早产发生风险高于正常孕妇,甲亢误诊孕妇早产发生风险与正常孕妇相仿。建立与推广双胎妊娠特异参考范围,同时结合甲状腺自身抗体情况进行综合评估,将有助于准确评估我国双胎妊娠孕妇孕早期甲状腺功能状况及潜在早产发生风险,其临床应用价值及公共卫生学意义值得尝试与实践。

