藁本内酯对血管紧张素Ⅱ诱导损伤的人脐静脉内皮细胞中miR-122表达的影响及其作用机制
杨锐,谢青,江华,毛玉娟,王莉,何亚丽,申进增,伊琳
甘肃中医药大学中西医结合学院,甘肃兰州730000
高血压是一种慢性疾病,可导致多种心血管疾病的发生发展,如心力衰竭、血管性痴呆及中风等,这些疾病均与高血压改变动脉壁的结构和功能相关[1]。血管内皮细胞通过释放旁分泌信号分子NO和前列环素来控制血管反应性,从而控制血压[1]。microRNAs(miRs)是一种小的非编码RNA,转录后通过与目标信使RNA(mRNAs)结合来调控基因的表达,从而诱导mRNA 降解或阻断翻译[2]。在前期研究中,发现当归可对自发性高血压大鼠心肌组织miR-122的表达产生影响,可能是通过调控miR-122 靶基因,即阳离子氨基酸转运体1(solutecarrierfamily7member1,Slc7a1)基因的表达来影响内皮功能[3]。
藁本内酯是从中药当归、川芎等伞形科植物中提取的主要活性成分。研究表明,藁本内酯具有舒张血管、抗炎、抗氧化、抑制肿瘤细胞增殖等作用[4]。本研究采用血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)建立人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)损伤模型,并检测藁本内酯对损伤HUVECs 中miR-122 表达及精氨酸转运通路miR-122 / 阳离子氨基酸转运蛋白-1(cationic amino acid transporter-1,CAT-1)/ NO 的影响。
1 材料与方法
1.1 细胞株 HUVECs 购自上海传秋生物科技有限公司。
1.2 主要试剂 藁本内酯购自兰州化学物理研究所;AngⅡ(批号:1220G031)、缬沙坦(批号:724A021)及NO 检测试剂盒(批号:201812110)购自中国北京索莱宝科技有限公司;ECM 培养基(批号:26327)、青-链霉素(批号:25862)、人内皮细胞生长因子(endothelial cell growth supplement,ECGS)(批号:26130)及胎牛血清(批号:26313)购自美国ScienCell 公司;胰酶(批号:2042337)购自美国Gibco 公司;CCK8 试剂盒(批号:KR675)购自日本同仁公司;兔抗CAT-1单克隆抗体(批号:00616770)、兔抗GAPDH 多克隆抗体(批号:00068668)及荧光标记的山羊抗兔IgG(H + L)(批号:20000003)购自美国 Proteintech 公司;超纯RNA 提取试剂盒、HiFiScript cDNA Synthesis Kit 及UltraSYBR Mixture(Low ROX)购自江苏康为世纪生物科技股份有限公司;RIPA 裂解液购自上海碧云天生物技术有限公司。
1.3 细胞培养 从液氮罐中取出HUVECs,37 ℃水浴1 min,加入ECM 培养基5 mL,1 000×g 离心5 min,弃上清,加入含5%胎牛血清、1%青-链霉素、1%ECGS的ECM 完全培养基,吹打混匀,移至培养瓶,于37 ℃,5% CO2培养箱中培养。稳定传代2 ~3 代后,取对数生长期细胞进行后续试验。
1.4 AngⅡ对HUVECs 存活率影响的检测 将对数生长期 HUVECs 按 7.5 × 103个 / 孔接种至 96 孔板,加入含5%胎牛血清、1% 青-链霉素,1% ECGS 的ECM 完全培养基,100 μL / 孔,37 ℃培养 12 h;待细胞贴壁后,分别加入含不同终浓度AngⅡ(分别为1 ×10-4、1 × 10-5、1 × 10-6mol / L)的 ECM 完全培养基,同时设空白组(不加AngⅡ),每组均设6 个复孔,继续培养24 h。采用CCK8 试剂盒检测A450,并按下式计算细胞存活率。选取存活率为60% ~70%的浓度为最适建模浓度,用于后续试验。
细胞存活率(%)= 试验组 A450/ 空白组 A450× 100%
1.5 藁本内酯对AngⅡ诱导损伤HUVECs 活性影响的检测 将对数生长期HUVECs 按1.4 项方法加入96 孔板,37 ℃培养12 h 后,分为空白组(不给药)、模型组(1 × 10-5mol / L AngⅡ)、缬沙坦组(1 ×10-5mol/L AngⅡ +1 × 10-4mol/L 缬沙坦)及藁本内酯低剂量组(1 × 10-5mol / L AngⅡ + 1 × 10-5mol / L藁本内酯)、中剂量组(1 × 10-5mol / L AngⅡ + 1 ×10-4mol / L 藁本内酯)、高剂量组(1 × 10-5mol / L AngⅡ + 1 × 10-3mol / L 藁本内酯),每组均设 6 个复孔,于37 ℃培养24 h。采用CCK8 试剂盒检测A450。
1.6 藁本内酯对AngⅡ诱导损伤HUVECs 分泌NO 影响的检测 按1.5 项进行细胞培养及分组,每组设 3 个重复,于 37 ℃培养 24 h;2 000 × g 离心5 min,取上清液,采用NO 检测试剂盒检测NO含量。
1.7 藁本内酯对AngⅡ诱导损伤HUVECs 中miR-122 表达及Slc7a1 基因mRNA 转录水平影响的检测 根据NCBI 中登录的Slc7a1 mRNA 序列(NM_003045.5),应用Primer 软件设计引物,引物序列见表1,由苏州泓迅生物科技股份有限公司合成。按1.5 项进行细胞培养及分组,采用超纯RNA 提取试剂盒提取各组细胞RNA,逆转录为cDNA,以其为模板进行RT-qPCR 检测。PCR 扩增条件为:95 ℃预变性 10 min;95 ℃变性 10 s,56 ℃退火 30 s,72 ℃延伸35 s,共 40 个循环。miR-122 表达水平及Slc7a1 基因mRNA 转录水平均以与β-action 的Ct 值比值表示。
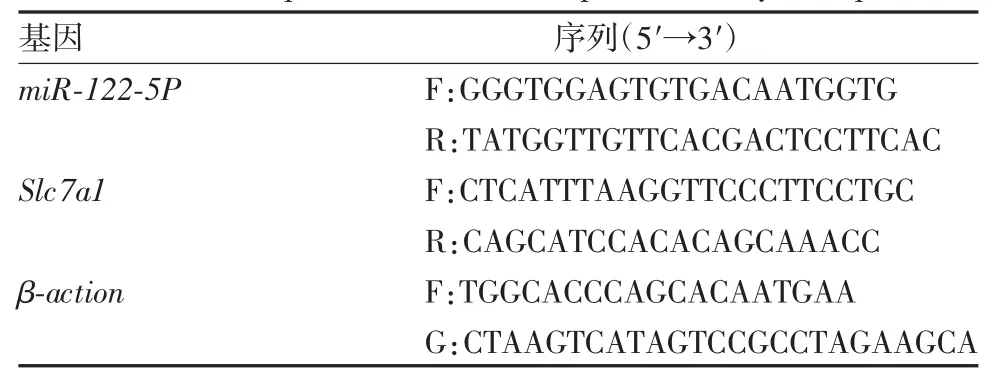
表1 用于RT-qPCR 扩增的引物序列Tab.1 Primer sequences used for amplification by RT-qPCR
1.8 藁本内酯对AngⅡ诱导损伤HUVECs 中CAT-1蛋白表达水平影响的检测 按1.5 项进行细胞培养及分组,用RIPA 裂解液提取各组细胞的总蛋白,BCA 法蛋白定量。经10% SDS-PAGE 分离蛋白后,湿法转移至PVDF 膜,用5%脱脂牛奶于4 ℃封闭1.5 h;加入兔抗 CAT-1 单克隆抗体(1 ∶2 000 稀释)及兔抗 GAPDH 单克隆抗体(1 ∶1 000 稀释),4 ℃孵育过夜;TBST 洗涤3 次,加入荧光标记的山羊抗兔IgG(H + L)(1 ∶5 000 稀释),室温孵育 2 h;TBST 洗涤3 次,用化学发光成像系统进行检测。
1.9 统计学分析 应用SPSS 23.0 软件进行统计学分析。所得数据进行正态分布检验,若数据服从正态分布,计量资料采用均数 ± 标准差(± s)表示,多组间比较采用ANOVA 方差分析,两组间比较采用LSD-t 检验;若不服从正态分布,计量资料采用中位数或四分位数进行统计描述,多组间比较采用秩和检验。均以P <0.05 为差异有统计学意义。
2 结 果
2.1 AngⅡ对HUVECs 存活率的影响 空白组及1 × 10-4、1 × 10-5、1 × 10-6mol / L AngⅡ组 A450分别为 0.830 ± 0.011、0.481 ± 0.152、0.559 ± 0.328、0.661 ± 0.135。与空白组比较,1 × 10-4、1 × 10-5、1 × 10-6mol/L AngⅡ组 A450明显下降(t 分别为-32.136、-24.839、-15.539,P < 0.01)。1 × 10-4、1 × 10-5、1 ×10-6mol / L AngⅡ组细胞存活率分别约为57.93%、68.08%、79.66%。AngⅡ浓度为 1 × 10-5mol / L 时,存活率为60% ~70%,因此选择AngⅡ浓度1 ×10-5mol / L 为最适建模浓度。
2.2 藁本内酯对AngⅡ诱导损伤HUVECs 活性的影响 空白组、模型组、缬沙坦组及藁本内酯低、中、高剂量组的A450分别为0.863±0.037、0.571±0.025、0.730 ± 0.028、0.747 ± 0.029、0.726 ± 0.035 及0.671 ± 0.009。与空白组比较,模型组 HUVECs 活性显著降低(t = -17.648,P <0.01);与模型组比较,缬沙坦组及藁本内酯低、中、高剂量组HUVECs活性显著提高(t 分别为 9.624、10.630、9.370、6.036,P 均 < 0.01)。
2.3 藁本内酯对AngⅡ诱导损伤HUVECs 分泌NO的影响 空白组、模型组、缬沙坦组及藁本内酯低、中、高剂量组细胞上清中的NO 含量分别为(15.815±0.354)、(8.721 ± 0.823)、(15.190 ± 0.341)、(17.804 ± 0.752)、(20.388 ± 0.621)、(20.752 ±0.543) μmol / L。与空白组比较,模型组细胞分泌NO 水平明显降低(t = -20.454,P < 0.01);与模型组比较,缬沙坦组及藁本内酯低、中、高剂量组分泌NO 水平明显上升(t 分别为 18.652、26.191、33.640、34.691,P 均 < 0.01)。
2.4 藁本内酯对AngⅡ诱导损伤HUVECs 中miR-122表达及Slc7a1 基因mRNA 转录水平的影响 与空白组比较,模型组miR-122 表达水平明显升高(t =10.673,P < 0.01),Slc7a1 基因 mRNA 转录水平明显降低(t = -3.656,P <0.01);与模型组比较,缬沙坦组及藁本内酯低、中、高剂组miR-122 表达水平明显降低(t 分别为-7.596、-7.698、-9.583、-10.819,P 均<0.01),缬沙坦组及藁本内酯中、高剂量组Slc7a1基因mRNA 转录水平明显升高(t 分别为3.823、3.953、6.789,P 均 < 0.01)。见表 2。
表 2 各组HUVECs 中 miR-122 表达及Slc7a1 基因mRNA 转录水平(± s,n = 6)Tab.2 The miR-122 expression and Slc7a1 mRNA transcription levels in HUVECs of various groups(± s,n = 6)
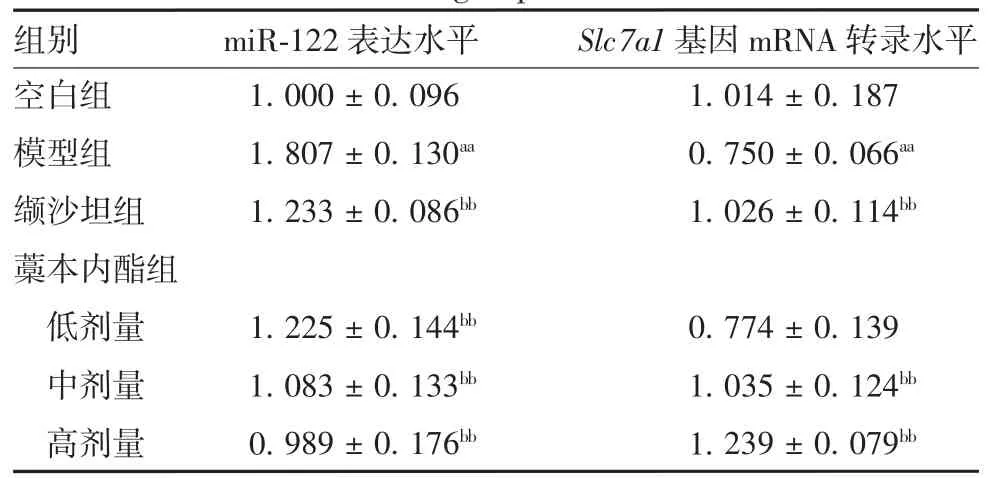
表 2 各组HUVECs 中 miR-122 表达及Slc7a1 基因mRNA 转录水平(± s,n = 6)Tab.2 The miR-122 expression and Slc7a1 mRNA transcription levels in HUVECs of various groups(± s,n = 6)
注:aa 表示与空白组比较,P <0.01;bb 表示与模型组比较,P < 0.01。
组别 miR-122 表达水平 Slc7a1 基因mRNA 转录水平空白组 1.000 ± 0.096 1.014 ± 0.187模型组 1.807 ± 0.130aa 0.750 ± 0.066aa缬沙坦组 1.233 ± 0.086bb 1.026 ± 0.114bb藁本内酯组低剂量 1.225 ± 0.144bb 0.774 ± 0.139中剂量 1.083 ± 0.133bb 1.035 ± 0.124bb高剂量 0.989 ± 0.176bb 1.239 ± 0.079bb
2.5 藁本内酯对AngⅡ诱导损伤HUVECs 中CAT-1蛋白表达水平的影响 空白组、模型组、缬沙坦组及藁本内酯低、中、高剂量组的CAT-1 表达水平分别为(0.937 ± 0.080)、(0.758 ± 0.040)、(1.253 ± 0.250)、(1.113 ± 0.018)、(1.189 ± 0.027)、(1.115 ± 0.020)。与空白组比较,模型组的CAT-1 表达水平明显降低(t = -16.394,P <0.01);与模型组比较,缬沙坦组及藁本内酯低、中、高剂量组细胞CAT-1 表达水平明显升高(t 分别为 45.368、32.529、39.530、32.681,P 均 < 0.01),见图 1。
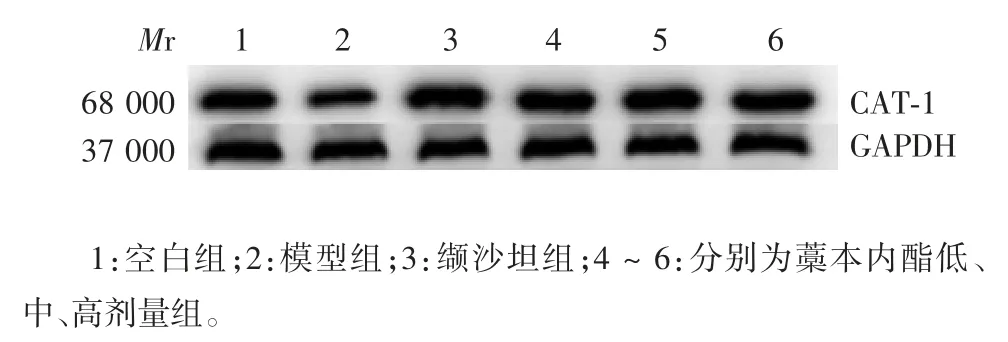
图 1 Western blot 法检测各组HUVECs 中CAT-1 蛋白的表达Fig.1 Western blotting of CAT-1 expressoin in HUVECs of various groups
3 讨 论
NO 生物利用度降低可导致内皮功能障碍和高血压,NO 由内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)在内皮细胞中产生[5]。内皮功能在较大程度上取决于eNOS 的功能和活性,L-精氨酸是eNOS 的合成NO 的底物,L-精氨酸缺乏可导致eNOS 功能障碍[6]。研究表明,L-精氨酸的转运不取决于细胞内外精氨酸的浓度,而是通过CAT-1 转运至细胞内[7]。本研究发现,AngⅡ诱导损伤的HUVECs分泌NO 水平及细胞活性均明显降低(P <0.01),与其他研究结果一致[8-9],给予缬沙坦及各剂量藁本内酯干预后,分泌NO 水平明显升高(P <0.01)。表明藁本内酯可提高AngⅡ诱导损伤HUVECs 产生NO 的水平。
KISHIKAWA 等[10]沉默了肝癌细胞内的miR-122,可通过 miR-122 / CAT-1 / NO 通路使肝癌细胞内产生的NO 水平增高,这与精氨酸转运密切相关。SHASHAR 等[11]在妊娠期高血压病的研究中发现,该病的发病机制与CAT-1 蛋白功能受到抑制及细胞内L-精氨酸水平降低导致NO 生成减少有关。内皮间连接在维持内皮完整性和调节血管功能方面发挥重要作用,CAT-1 是一种内皮细胞间黏附分子(cell adhesion molecule,CAM),直接参与调节内皮完整性,对内皮具有保护作用[12]。本研究采用AngⅡ诱导损伤HUVECs 后,细胞内miR-122 水平明显升高(P < 0.01),Slc7a1 基因 mRNA 转录水平、CAT-1蛋白表达水平、细胞活性及NO 水平均明显降低(P <0.01),给予藁本内酯治疗后,miR-122 水平明显降低(P < 0.01),Slc7a1 基因 mRNA 转录水平、CAT-1 蛋白表达水平、细胞活性及NO 水平均明显升高(P <0.01)。表明藁本内酯可缓解AngⅡ诱导的HUVECs损伤。
L-精氨酸转运增强可预防心力衰竭患者的肾纤维化、炎症和肾功能衰竭[13]。在神经母细胞瘤的研究中,通过阻断CAT-1 依赖的体外精氨酸摄取可延缓了肿瘤的发展[14]。慢性淋巴细胞白血病的研究中,肿瘤细胞CAT-1 转运体的下调显著降低精氨酸的摄取,抑制细胞增殖,降低细胞活力[15]。表明L-精氨酸转运增强,亦可能导致肿瘤的进展。
综上所述,藁本内酯可降低AngⅡ诱导损伤的HUVECs 细胞miR-122 表达水平,提高其靶基因Slc7a1转录及其蛋白CAT-1 表达的水平,增强细胞L-精氨酸转运,促进NO 的合成,保护内皮细胞功能。

