建立胃蛋白酶原及胃泌素比值评分系统预测胃癌高危风险
胡晓华,李万红,胡晓俊,张震,熊明安,邹璨,周华,张正芹
我国胃癌高发,通常以肠型胃癌多见。目前认为,经过了慢性萎缩性胃炎→肠化→异型增生→胃癌的发展过程。研究表明[1-2],血清胃蛋白酶原(PG)与胃泌素-17(G-17)的多项比值评价,对重度萎缩性胃炎、重度肠化生以及异型增生者效果明显,由于这些因素是发生癌变的重要环节,进一步针对这些因素,建立及完善胃功能评分系统,对于胃癌的早期防治具有非常重要的价值。目前,除胃镜检查以外,我国推荐使用“新型胃癌筛查评分系统”进行人群筛查,但研究表明,胃癌总体检出率在高风险组较低[3],仍需进一步探索评估[4]。由于PG、G-17比值较单纯的两个数值稳定,我们在原有比值评分研究[1]的基础上,进一步完善此系统,再结合蛋白评分[5],进行综合评价,取得了预期效果,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年3月至2020年1月在宜都市第一人民医院因胃部不适就诊的患者383例。病例纳入标准:①有慢性胃炎、胃息肉、肠上皮化生、异型增生等病史;②有恶性肿瘤家族史、或者幽门螺杆菌(H.pylori)感染史;③高盐饮食、喜食腌熏烤炸食品、吸烟饮酒、生活压力大或者不规律;④同意血清学检测、胃镜及病理活检。排除标准:①有胃部外科手术史;②有恶性肿瘤史;③近期服用质子泵抑制剂、使用激素类药物;④有严重的心、肝、肾功能不全或精神疾患。本研究经宜都市第一人民医院伦理委员会审核批准,所有患者签署知情同意书。
1.2 方法
1.2.1 胃功能及蛋白质检测、胃镜及病理活检 常规血清PGⅠ、PGⅡ(μg/L)、G-17(pg/mL)测定、计算PGⅠ/PGⅡ(PGR)、血浆白蛋白及球蛋白检测、胃镜及病理活检。
1.2.2 流行病学登记 填写患者调查表,包括生活饮水、烟酒茶、饮食习惯、14C-尿素呼气试验、H.pylori-Ab、血液分析、HBsAg、肝肾功能、凝血功能、肝胆胰肾彩超、胸片或者胸部CT、腹部CT、既往病史、手术史、肝炎结核病史、家族史等内容,对于高危患者,12个月内随访一次。
1.2.3 病理分组 高危组:胃癌及癌前病变(包括异型增生、重度肠上皮化生、重度萎缩性胃炎)。低中危组:非胃癌及癌前病变(包括慢性非萎缩性胃炎、轻中度萎缩性胃炎、轻中度肠上皮化生等)。
1.2.4 胃功能比值评分研究 ①原有评分系统(A-H值)[1]:将血清PG、G-17分成8个比值:A为PGR、B为PGⅠ/G-17,C为G-17/PGⅡ,D为PGⅠ-G-17/PGⅡ,E为A+B+C+D,F为A-B-C-D,G为(A+B+C+D)/(A-B-C-D),H为G-17-PGⅡ/PGⅠ。②进一步评分(E-Y值)研究:在A、B、C、D四值的基础上,再计算7个数值:AB,CD,S为AB-CD,T为AB/CD,W为[AB-CD]-[AB/CD],X为AB/ C或D的n倍、Y为CD/A或B的n倍。
1.2.5 蛋白评分 依据白蛋白(ALB)及球蛋白(GLB)评分法[5]进行,规定:①ALB>47.5计0分;ALB≤47.5且>44.4计5分;ALB≤44.4且>41.7计7分;ALB≤41.7计10分;②ALB-GLB≤18.5或≥26计3分;③GLB≤22.3或≥32计2分;④ALB+GLB≤64.5计1分。计分方法:①+②+③+④,结果判定:高危≥10分、低中危0~9分。
1.3 统计学方法
2 结果
2.1 两组一般资料的比较
共有383例进行血清学检测、胃镜检查及病理活检其中高危组68例,男34例、女34例;年龄34~92岁(中位56.5岁);胃癌21例,异型增生、重度萎缩性胃炎及重度肠上皮化生共47例。低中危组315例,男150例、女165例;年龄20~90岁(中位56岁);慢性非萎缩性胃炎162例、轻中度萎缩性胃炎及轻中度肠上皮化生共153例。而同时具备血清学、胃镜、病理及血浆白蛋白及球蛋白检测的共有353例,其中胃癌20例,异型增生、重度萎缩性胃炎及重度肠上皮化生共42例;慢性非萎缩性胃炎150例,轻中度萎缩性胃炎及轻中度肠上皮化生共141例。两组间性别、年龄差异无统计学意义(P>0.05)。
2.2 两组血清PG 和G-17比值比较
高危组与低中危组A、G值差异有统计学意义(P<0.05),其余指标差异无统计学意义(P>0.05),见表1。
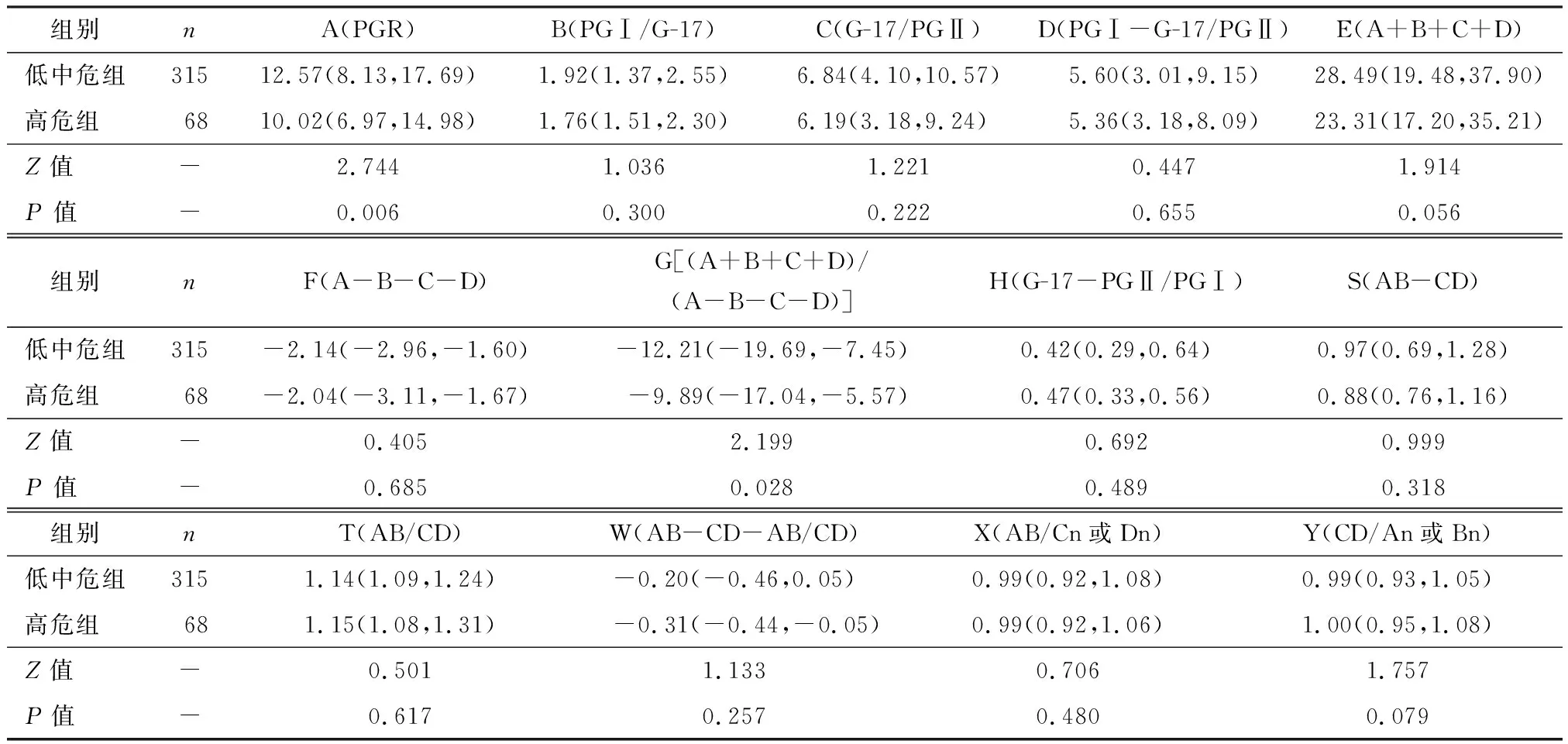
表1 两组各值结果比较[M(P25,P75)]
2.3 相关指标取值
经过ROC曲线计算每指标的最佳检测值、部分指标采用P90或P10为参考区间上限或者下限进行补充取值,原有A-H值取值不变,结果如下,各组诊断效能分别参见图1。

图1 各值(指标)诊断效能
2.3.1 A值(PGⅠ/PGⅡ) 若以A≤4.3或者>11.6为诊断界限值,对高危组诊断的敏感度、特异度分别为51.47%、38.73%。
2.3.2 B值(PGⅠ/ G-17) 若以B≤0.9或者>3.52为诊断界限值,对高危组诊断的敏感度、特异度分别为26.47%、84.13%。
2.3.3 C值(G-17/PGⅡ) 若以C<2.89或者>13.25为诊断界限值,对高危组诊断的敏感度、特异度分别为29.41%、72.06%。
2.3.4 D值(PGⅠ-G-17/PGⅡ) 若以D>6.94或者≤1.43为诊断界限值,对高危组诊断的敏感度、特异度分别为39.71%、53.65%。
2.3.5 E值(A+B+C+D) 若以E≤23.74为诊断界限值,对高危组诊断的敏感度、特异度分别为52.94%、64.44%。
2.3.6 F值(A-B-C-D) 若以 F≤-4.12或者≥-1.51为诊断界限值, F对高危组诊断的敏感度、特异度分别为27.94%,68.57%。
2.3.7 G值[(A+B+C+D)/(A-B-C-D)] 若以G>-8.29为诊断界限值,G对高危组诊断的敏感度、特异度分别为42.65%,70.79%。
2.3.8 H值(G-17-PGⅡ/PGⅠ) H组(G-17-PGⅡ/PGⅠ) 若以H>0.79或者<0.19且≥0为诊断界限值,对高危组诊断的敏感度、特异度分别为30.88%、76.51%。
2.3.9 S值(AB-CD) 若以S≤1.3或者>0.57为诊断界限值,对高危组诊断的敏感度、特异度分别为66.18%、40.32%。
2.3.10 T值(AB/CD) 若以T>1.07为诊断界限值,对高危组诊断的敏感度、特异度分别为82.35%、21.91%。若排除初次评分(A-H组)阳性的数据外,在第二次评分判断中,其对高危组的敏感度、特异度分别为 100.00%、16.60%。
2.3.11 W值([AB-CD]-[AB/CD]) 若以W≤0.07或者>-0.40为诊断界限值,对高危组诊断的敏感度、特异度分别为60.29%、55.87%。
2.3.12 X值(AB/ C或D的n倍) 若以 X>0.9或者≤1.08为诊断界限值,对高危组诊断的敏感度、特异度分别为64.71%,41.27%。
2.3.13 Y值(CD/A或B的n倍) 若以Y>0.91或者≤1.08为诊断界限值,对高危组诊断的敏感度、特异度分别为61.77%,38.73%。
2.4 比值评分对胃癌高危风险的诊断
2.4.1 A-H评分诊断 诊断界限值:A≤4.3或者>11.6; B≤0.9或者>3.52;C<2.89或者>13.25;D>6.94或者≤1.43;F≤-4.12或者≥-1.51;G>-8.29;H>0.79或者<0.19且≥0。评价系统:取A、B、C、D、F、G、H阳性各为1分,阴性为0分;低中危≤4分、高危>4分。
2.4.2 E-Y评分诊断 诊断界限值:E≤23.74;S≤1.3或者>0.57;T>1.07;W≤0.07或者>-0.40;X>0.9或者≤1.08;Y>0.91或者≤1.08。评价系统:取E、S、W、X、Y阳性各为1分,阴性为0分,T阴性此组总计分为0分;低中危≤3分、高危>3分。
2.4.3 诊断顺序 首先A-H评分,当判断结果为高危后,评分结束;若结果为低中危,则需要进一步E-Y评分。
2.4.4 评分结果 高危组有127例,其中胃癌16例,癌前病变26例,与病理分组对照后,血清诊断胃癌和癌前病变的敏感度、特异度、准确度、阳性预测值和阴性预测值分别为61.77%、73.02%、71.02%、33.07%、89.84%,ROC曲线下面积(AUC):0.67。对于胃癌的敏感度、特异度、准确度、阳性预测值和阴性预测值分别为76.19%、69.34%、69.71%、12.60%、98.05%,AUC:0.73,见表2。

表2 383例比值评分与病理诊断比较 (n)
2.5 比值评分结合蛋白评分对胃癌高危风险的诊断
2.5.1 A-H组评分结合蛋白评分诊断 A-H组评分方法不变;蛋白高危风险取1分、低中危风险取-1分。综合评价:低中危≤4分、高危>4分。
2.5.2 E-Y组评分结合蛋白评分诊断 E-Y组评分方法不变;蛋白高危风险取1分、低中危风险取-1分;T阴性此组总计分为0分。综合评价:低中危≤3分、高危>3分。
2.5.3 特殊情况下评分诊断 ①A-H评分仅G阳性,其余均为阴性,若蛋白高危风险,即可判断为胃癌高危风险。②A、B、E、F、G、H均为阳性,若蛋白评分为低中危风险达到7分以上,即可判断为胃癌高危风险。
2.5.4 诊断顺序 首先A-H评分结合蛋白评分,若结果为低中危,则需要排除是否有特殊情况,若无,则进一步进行E-Y评分结合蛋白评分。当一次判断结果为高危后,评分结束。
2.5.5 评分结果 高危组有132例,其中胃癌20例,癌前病变26例,与病理分组对照后,血清诊断胃癌和癌前病变的敏感度、特异度、准确度、阳性预测值和阴性预测值分别为74.19%、70.45%、71.11%、34.85%、92.76%,AUC:0.72。对于胃癌的敏感度、特异度、准确度、阳性预测值和阴性预测值分别为100.00%、66.37%、68.27%、15.15%、100.00%,AUC:0.83,见表3。

表3 353例比值+蛋白综合评分与病理诊断比较 (n)
2.6 胃癌漏诊率、癌前病变检出率比较
比值评分与比值+蛋白综合评分两者间比较,胃癌漏诊发生率分别为23.81%、0,P=0.047 8;比值+蛋白质综合评分组间比较,癌前病变检出率分别为19.70%、7.24%,P=0.000 6,高危组检出的癌前病变占总数的61.91%。
3 讨论
胃癌是我国最常见的癌症死亡原因、居发病癌谱第二位[6]。其早期大多数无明显症状,由于常用肿瘤标志物的筛査价值有限[7],胃镜筛查未普及以及早癌漏诊率高,导致发现率低,这在我国尤为突出。胃镜病检诊断早癌是金标准,由于胃镜病检普查受限于人们的顺应性、痛苦性、风险、禁忌症及费用高等因素,再加上盲目胃活检,从而影响了胃镜的大规模普查[8]。
根据Correa假说[9],胃癌的发病从正常胃上皮通过慢性炎症发展到癌前病变,再转变为黏膜内癌然后发生浸润成为浸润性癌;国外根据流行病学,遗传学和环境危险因素对患者进行逐例评估,对血清学活检(PG、G-17)进行风险分层,然后,建议高危者进行胃镜与病检。
根据血清PG、G-17各项指标的不同组合,将胃病风险状态分成二类,即胃癌低中危风险及高危风险。由于严重萎缩、重度肠上皮化生和异型增生具有恶变的可能性,因此本研究特定义为胃癌前病变[10],与早癌一起,构成高风险组。在高危风险预警作用下、进一步胃镜病理精查,起到有目的地寻找病变的效果[11]。
作为初筛,血清学活检对胃癌评分的敏感度应尽可能达到100%,以降低漏诊率,同时努力提高特异度来降低误诊率[12],还要兼顾癌前病变,满足“双赢”的要求,只有这样才有益于早癌防治。
研究显示[13],血清学活检指标在各地胃癌筛查的敏感度和特异度差别较大。据新型胃癌筛查评分[14-15]文献报告,以中风险组为界,诊断胃癌的敏感度和特异度分别为64.8%、71.4%,胃癌在低风险组达25%~35.1%;其癌前病变在低风险与高风险组间检出率无统计学差异[14,16]。原因可能与PG与G-17数值容易受到各种因素影响产生波动有关,同时,新型胃癌筛查评分中含有性别、年龄、Hp等自然因素[17],从而影响了高风险组分值的客观判断。
研究认为[1,18-19],PG与G-17之间的比值,比检测的数值稳定,不易受到影响。因此,为了降低初筛中胃癌的漏诊问题,我们另辟研究途径,设计了波动性小、相对稳定的比值进行分组评分,取得了预期的效果。在初期的研究中,比值评分对癌前病变的敏感度和特异度达到100%、96.04%[1],G组比值的敏感度甚至达到100%。目前D组仍然取绝对值算法,在A-H评分的基础上,进一步完善了E及H组的界限值,同时又研究出了E-Y评分方法。AB及CD均为两组值平均数;X及Y组中,n取整数,其分母以接近分子为准,以结果接近1为计算目的。工作中,胃功能比值评分能够初步将严重病变判断出来,但也遇到少数胃癌的判断值处于中高危的临界状态,提示对早癌的诊断效能还不完全[20],还需要研究别的指标、具有与其不同的机制,加以联合判断、预期获得更高敏感度。观察发现,胃癌患者的白蛋白均较低,很少超过45 g/L。因而研究出一套用于判断胃癌及癌前病变的蛋白评分法[5],结果显示,高风险组蛋白评分敏感度96.43%、特异度56.92%。
虽然部分比值的中位数在高危与低中危组间的差异不大,但由于分组多评分合理,综合蛋白评分的因素,最终将胃癌及癌前病变初步筛查出来,结果显示,比值+蛋白综合评分诊断胃癌的敏感度、特异度、准确度、阳性预测值和阴性预测值分别为100.00%、66.37 %、68.27%、15.15%、100.00%,取得了预期的效果。同时还显示癌前病变的检出占总数的61.91%,高危组与低中危组间有显著的统计学差异(P=0.000 6)。
综上所述,建立的胃蛋白酶原及胃泌素比值评分系统,作为胃癌的初筛手段,评分方法客观、有效、经济、简便;结合蛋白评分,对胃癌的敏感度达100%、特异度达66.37%,对胃癌及癌前病变高危人群的总体敏感度、特异度达74.19%及70.45%,若应用到初筛中,对高危人群展开精查,可进一步降低早癌的漏诊率,提高癌前病变的发现率,对于早癌的防治具有重要意义。

