不同红细胞输注量对早产儿贫血的治疗效果*
赵珣, 陈茂琼*, 李君, 陈晓霞
(1.贵州医科大学附属医院 新生儿科, 贵州 贵阳 550004; 2.黄冈市中心医院 新生儿科, 湖北 黄冈 438000)
早产儿由于铁储备少、营养素缺乏、红细胞寿命短、造血系统发育不成熟及医源性失血等多种因素,易导致贫血。红细胞输注(red blood cell transfusion ,RBCT)是治疗早产儿贫血的主要方法,加拿大新生儿网络(canadian neonatal network,CNN)调查显示,超过3/4超低出生体质量儿住院期间至少接受1次输血[1];Bane等[2]研究显示,32周早产儿出生时低血红蛋白(hemoglobin,Hb)已经成为其死亡的一个独立危险因素。虽然输血能纠正贫血、或挽救生命,但有些疾病发生与输血相关,如肝功能损伤、肾功能损伤、红细胞增多症及支气管肺发育不良(bronchopulmonary dysplasia, BPD)、脑室内出血(intraventricular hemorrhage, IVH)、新生儿坏死性小肠结肠炎(necrotizing enterocolitis, NEC)、院内感染(nosocomial infection, NI)及早产儿视网膜病变(retinopathy of prematurity, ROP)等;且由于早产儿体质量轻,每次输血量少,剩余血液只能丢弃,导致血液浪费。对于早产儿输血的最佳剂量,目前仍在进行多中心研究[3],RBCT量波动在10~20 mL/(kg·次),对于体质量<1 500 g的早产儿,有建议每次RBCT量5~15 mL/(kg·次)[4]。该输注剂量较为宽泛,在实际的治疗中,需要根据早产儿的Hb含量、失血量以及胎龄等临床资料进行相应的治疗;本文回顾性分析近3年收治的RBCT早产儿的临床资料,分析不同输血量对早产儿贫血的治疗效果,为规范早产儿输血提供依据。
1 对象与方法
1.1 研究对象
2015年1月—2017年12月入住新生儿重症监护病房(neonatal intensive care unit, NICU),且住院期间接受过RBCT早产儿264例。纳入标准:生后24 h入住NICU,诊断早产儿贫血,≥1次RBCT。排除同族免疫性溶血换血治疗的患儿,排除严重先天性畸形或血液系统疾病导致贫血的患儿。根据每次RBCT量分为SBT组[10~15 mL/(kg·次)]89例,HBT组[15.1~20 mL/(kg·次)]175例;RBCT指征、输血品种及速度 RBCT严格遵循早产儿输血指征[5],输血品种为悬浮红细胞或洗涤红细胞,红细胞压积(hematocrit,Hct) 为0.60~0.70,未辐照;速度3~5 mL/(kg·h)。
1.2 方法
1.2.1临床资料 通过输血登记本查找近3年诊断为早产儿贫血并输注红细胞的患儿,符合纳入标准的早产儿264例。收集相关临床资料:(1)一般情况(性别、胎龄、出生体质量、分娩方式、胎次、Apgar评分);(2)住院情况(住院期间累计机械通气时间、胃肠外营养时间及住院时间;住院期间累计RBCT量、住院期间累计RBCT次数、输血后Hb、Hct升高幅度);(3)住院期间并发症发生率(肝功能损伤、肾功能损伤、红细胞增多症、NEC、NI、BPD、IVH、ROP)。
1.2.2并发症判断标准 (1)肝功能损伤,肾功能损伤,输血相关性NEC、BPD、ROP及IVH均符合《实用新生儿学》第4版诊断标准[5];(2)红细胞增多症为每次RBCT后24~48 h内抽静脉血查血常规,Hb≥220 g/L和(或)Hct≥65%[6];(3)NI参考《医院感染诊断标准》[6]。
1.3 统计学方法

2 结果
2.1 输血效果
264例早产儿RBCT后Hb升高幅度为(58.10±22.76)g/L,Hct升高幅度为(15.88±6.82)%,发生红细胞增多症1例(0.38%)、肾功能损伤9例(3.41%)、NEC 18例(5.68%)、肝功能损伤59例(22.35%);264例早产儿住院期间发生BPD 47例(17.80%)、NI 33例(12.50%)、IVH 11例(4.17%)及ROP 2例(0.76%)。
2.2 一般情况
结果显示,2组患儿的出生体质量、胎龄、性别、分娩方式、胎龄及Apgar评分比较,差异无统计学意义(P>0.05)。见表1。
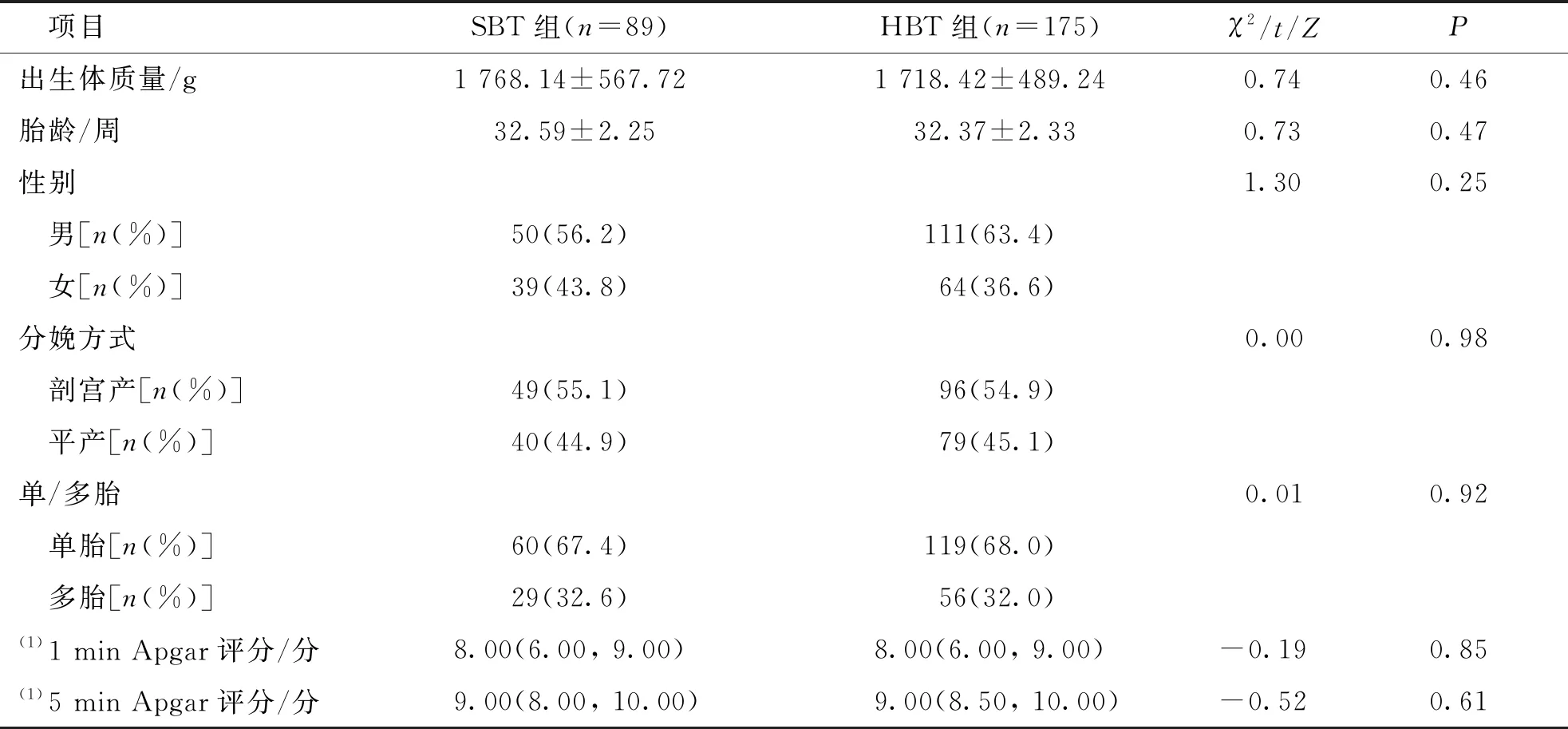
表1 SBT组和HBT组患儿的一般情况比较
2.3 住院情况
SBT组患儿的机械通气时间、胃肠外营养时间、住院时间较时间少于HBT组, SBT组患儿累计RBCT量、Hb及Hct升高幅度低于HBT组(P<0.05);2组患儿的吸氧时间及累计RBCT次数比较差异无统计学意义(P>0.05)。见表2。
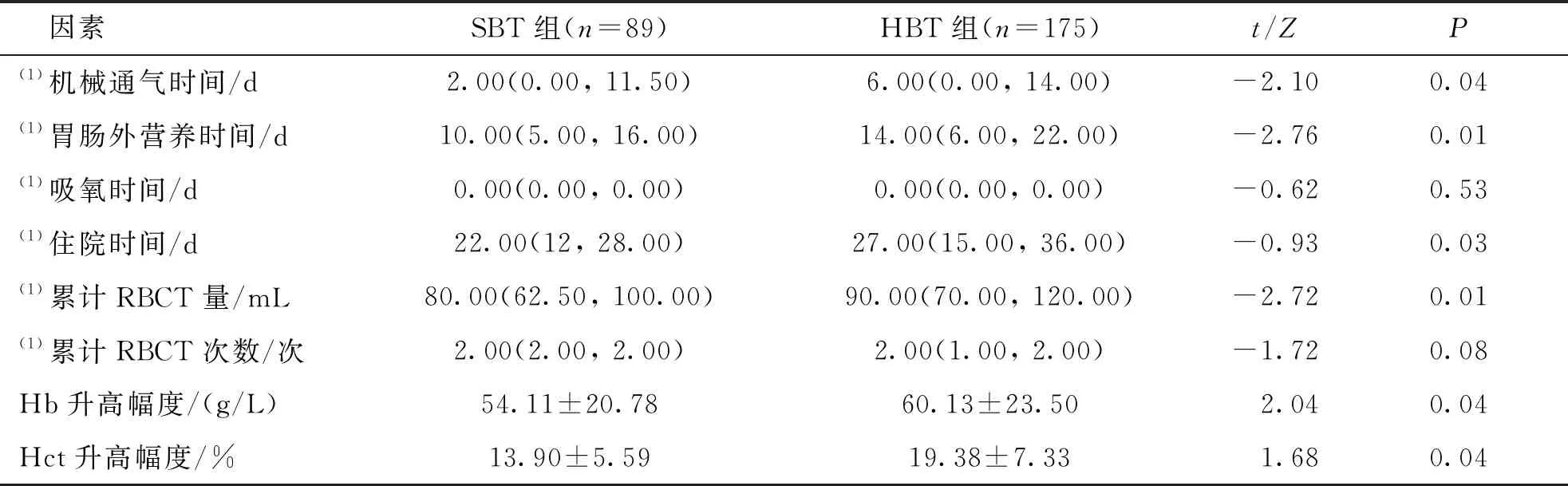
表2 SBT组和HBT组患儿的住院情况比较
2.4 住院期间并发症发生率
结果显示,2组患儿的肝功能损伤、肾功能损伤及红细胞增多症及BPD、IVH、NEC、NI、ROP发生率比较,差异无统计学意义(P>0.05)。见表3。
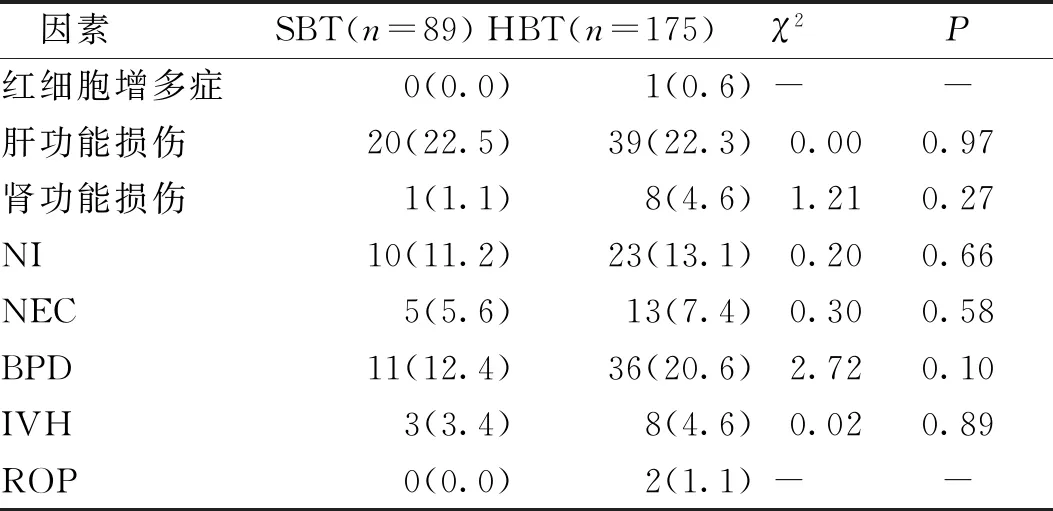
表3 SBT组和HBT组患儿住院期间并发症发生率比较[n(%)]
3 讨论
早产儿出生后因各种因素极易出现贫血,除采用补充人重组促红细胞生成素及补充外源性铁剂、维生素B12、延迟脐带结扎等治疗方式外,RBCT是国内外治疗早产儿贫血最直接和有效方法[7]。输血是把双刃剑,一方面可改善贫血,增加血液中的Hb含量及Hct,提高红细胞的携氧能力,改善组织氧合,尤其是大脑氧合,减少呼吸暂停和周期性呼吸,提高新陈代谢能力,促进体质量增加[8-9]。另一方面,RBCT亦可增加溶血反应、过敏性休克、输血相关的移植物抗宿主反应、感染性疾病的传播、循环超负荷等疾病的发生。有研究报道,输血与 NEC、IVH、ROP、BPD等疾病发生、发展有关[10-14]。
本研究对象264例早产儿,平均胎龄32.29周(26.29~36.86周),平均出生体质量1 735.2 g(890~3 400 g),SBT组89例,HBT组157例,2组患儿出生体质量、胎龄、性别、分娩方式、胎次、Apgar评分比较,差异无统计学意义,具有可比性。2组患儿输血后Hb和Hct提升幅度可用来衡量贫血纠正情况。本研究结果显示,HBT组输血后Hb和Hct提升幅度较SBT组高,贫血得到及时纠正,但机械通气时间、胃肠外营养时间及住院时间较SBT组延长,住院期间累计RBCT量较标准输血量增加(P<0.05);而2组累计RBCT次数、肝功能损伤、肾功能损伤、红细胞增多症及BPD、IVH、NEC、NI、ROP发生率比较,差异无统计学意义。有研究发现,RBCT可致胆红素、肝酶的升高,并且输血量越大,新生儿发生胆红素、肝酶异常的风险越高,当累积输血量达到200 mL时,几乎所有的新生儿都表现肝酶或胆红素的异常[15]。本研究结果显示,输血后早产儿肝功能损伤的发病率22.35%,2组比较无差异。与足月儿相比,早产儿体内铁的储存量较低,铁蛋白浓度降低。由于没有生理性的铁去除机制,接受多次红细胞输血的患者会产生铁超载并有毒性的风险,铁是一种过渡金属,铁蛋白存在于所有生物体内,像Hb一样,铁通常与原卟啉结合,形成血红素。当输血过多时会导致血液中铁含量过高,血液中高浓度的游离铁与过氧化物反应生成自由基,产生氧化应激反应,可破坏脱氧核糖核酸、蛋白质、脂质和其他细胞成分[16]。由于反复输血会引起铁超载,而肝脏是铁沉积的主要部位,加上早产儿消化功能不健全,红细胞寿命较短,加速细胞分解会导致肝脏更大程度的铁沉积,过多的铁与转铁蛋白结合,导致氧化应激反应增加,引起组织器官的损伤。所以引起肝功能损害的原因可能与多次输血导致铁沉积,引起肝脏、心脏和其他器官功能障碍[17-18]。因血清铁蛋白、肝脏MRI为特殊检查,符合纳入标准患儿未常规进行,但本研究中肝功能损害病例经光疗、保肝、利胆治疗后痊愈,无大出血及肝功能衰竭发生。
Strauss[19]对312例早产儿进行研究发现,接受20 mL/(kg·次)RBCT的早产儿比接受10 mL/(kg·次)RBCT的早产儿有效循环血容量提高了将近50%,并且使下一次贫血的时间出现晚,减少了输血次数,同时也降低了疾病传播的风险。一项对13例早产儿进行的30次输血的研究中,比较10 mL/(kg·次)和20 mL/(kg·次)RBCT量的影响,发现使用20 mL/(kg·次)的RBCT量更有助于提高Hb,而不会产生呼吸系统不良反应[20]。本研究中,HBT组累计输血量增加,输血后Hb和Hct明显增加,贫血纠正,但增加机械通气时间、胃肠外营养时间及住院时间,考虑原因为单位体质量输血量增加,导致短时间内血容量增加,心、肺容量负荷增加,损伤胃肠道功能,延长机械通气及胃肠外营养时间,增加住院时间及住院期间输血总量;在肝功能损伤、肾功能损伤、红细胞增多症、院内感染、NEC、BPD、IVH、ROP的发病率比较,差异无统计学意义(P>0.05),由此可见SBT组RBCT量可能是更有益。
综上所述,SBT组能减少机械通气时间、胃肠外营养时间及住院时间,且2组在住院期间并发症发病率比较无差异,因此,经过对输血量高低治疗早产儿贫血的疗效进行对比,SBT组治疗效果优于HBT组。

