腔内治疗锁骨下动脉瘤
赵昱博,化召辉,焦周阳,曹辉,徐鹏,刘仕睿,李震
(郑州大学第一附属医院 腔内血管外科,河南 郑州 450052)
锁骨下动脉瘤(subclavian artery aneurysm,SAA)是指锁骨下动脉直径超过正常值的1.5倍,发病率较低,约占外周动脉瘤的1%[1]。SAA分为真性动脉瘤和假性动脉瘤。真性SAA常见病因是动脉粥样硬化和胸廓出口综合征,少见于纤维肌发育不良、动脉中层囊性坏死、感染和结缔组织病。假性动脉瘤常见的病因是外伤和医源性损伤。锁骨下动脉以前斜角肌为标志分为3段,近段位于前斜角肌内侧,中段位于前斜角肌后方,远段位于前斜角肌外侧缘至第1肋外侧缘。既往多以瘤体位于锁骨下动脉的位置将SAA分为3型:近段型、中段型、远段型。据报道,近段型和中段型锁骨下动脉瘤破裂发生率高,远段型血栓脱落风险高[2]。部分SAA延伸至胸腔内,瘤体游离困难,开放手术创伤较大。腔内技术避免了这些弊端,目前已成为治疗SAA的趋势。本研究探讨腔内治疗17例SAA患者的经验。
1 资料与方法
1.1 资料搜集通过嘉和电子病历(嘉和美康,中国)系统,以“锁骨下动脉瘤”为诊断,回顾性收集郑州大学第一附属医院腔内血管外科2013年1月至2019年12月确诊的17例SAA的患者临床资料。
1.2 影像学检查所有患者均接受颈部计算机断层血管成像(computed tomographic angiography,CTA)了解动脉瘤大小、位置、性质和有无分支动脉供血。怀疑血管炎症病变时,检查红细胞沉降率、C反应蛋白和风湿免疫等指标,阳性者接受抗炎治疗,待指标稳定后再行腔内治疗。
1.3 手术方法对所有患者均行局部麻醉。采用Seldinger技术穿刺右侧股动脉,在导丝导管配合下进入锁骨下动脉,交换适当尺寸长鞘,支架直径一般比载瘤动脉直径大1~2 mm,长度至少覆盖病变两端正常血管1 cm,两枚支架重叠>2 cm,经股动脉途径导丝未能通过锁骨下动脉远端时,尝试采用同侧肱动脉途径建立通路,否则以弹簧圈栓塞瘤腔。
1.4 术后处理及随访术后常规给予患者那屈肝素钙注射液(河北常山生化药业股份有限公司,国药准字H20163096)皮下注射,每次4 100 U,每日1次。院外口服3个月阿司匹林肠溶片(拜耳医药保健有限公司,国药准字J20130078),每次100 mg,每日1次,口服硫酸氢氯吡格雷片[赛诺菲(杭州)制药有限公司,国药准字J20180029],每次75 mg,每日1次,3个月后单服阿司匹林肠溶片。术后3、6、12个月行彩超或CTA查看支架通畅程度及瘤体有无内漏,之后每年定期复查,不能来院复查者行电话随访。
2 结果
2.1 一般资料17例SAA患者中男6例,女11例;年龄23~78岁,中位年龄50岁;真性动脉瘤15例,假性动脉瘤2例;病因不详6例,动脉粥样硬化8例,胸廓出口综合征1例,医源性损伤1例,外伤史1例;无症状4例,颈部搏动性肿块5例,胸闷2例,头晕、肢体无力(后循环缺血)3例,上肢麻木疼痛(肢体缺血)2例,声音嘶哑1例;高危因素中高血压4例,脑梗死2例,心肌梗死1例,吸烟史3例;SAA均为单侧发病,右侧14例,瘤体位于近段12例、中段2例、远段3例;动脉瘤最大直径17.6~62.4 mm,中位最大直径37.8 mm。
2.2 手术结果17例患者均成功接受腔内治疗。1例(5.88%)行覆膜支架Viabahn(Gore公司,美国)植入和右椎动脉-颈总动脉移位;2例(11.76%)行多层裸支架Wallstent(Boston Scientific公司,美国)植入;1例(5.88%)行瘤腔弹簧圈栓塞;1例(5.88%)行Wallstent辅助下瘤腔弹簧圈栓塞;11例(64.70%)行覆膜支架植入,5例(29.41%)植入Viabahn,6例(35.29%)植入Fluency(Bard公司,美国),其中2例(11.76%)联合植入Wallstent;1例(5.88%)行Viabahn植入联合弹簧圈栓塞。
2.3 随访结果随访时间6~87个月,中位随访时间24个月,3例(17.64%)支架闭塞,1例(5.88%)术后1个月因Ⅱ型内漏瘤体增大破入气管死亡(图1),1例(5.88%)术后1 a出现Ⅲ型夹层(图2),2例(11.76%)密网支架植入术后出现Ⅰ型内漏,1例随访1 a内漏仍存在,瘤体未增大,1例随访5 a内漏消失。
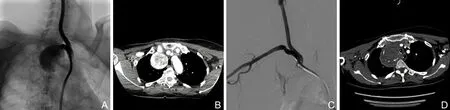
A为DSA造影明确右锁骨下近段动脉瘤;B为术前CTA测量瘤体直径为47.3 mm;C为DSA造影覆膜支架植入后瘤腔未显影;D为术后1个月复查CTA显示瘤体直径增大至67.8 mm。
图11例右锁骨下动脉近段动脉瘤腔内治疗患者的影像学结果

A为DSA造影左椎动脉优势且由瘤体发出;B为行限制性覆膜支架植入并瘤腔栓塞;C为术后13个月复查CTA发现Ⅲ型主动脉夹层。
3 讨论
目前SAA干预指征缺乏共识。1991年Becker等[3]首先采用腔内技术治疗锁骨下动脉损伤,后来此方式被用于SAA的治疗。研究显示,约39% SAA位于锁骨下动脉近段,中段约占25%,远段约占24%[4],该研究中12例(70.5%)SAA位于锁骨下动脉近段。近段型SAA腔内治疗具有挑战性,主要难点在于分支动脉(椎动脉、乳内动脉、甲状颈干)供血和锚定区不足。
部分SAA患者以后循环缺血为主要症状,Lou等[5]报道了1例SAA诱发椎动脉窃血致患者出现阵发性眩晕,表明术中椎动脉的保留有临床意义。一项含142例SAA腔内治疗患者的meta分析显示,21例(14.9%)患者椎动脉被覆盖,均无脑梗死症状[1]。椎动脉代偿机制除了经典的Willis环外,还存在颈外动脉-枕动脉下支-椎动脉肌支动脉-椎动脉途径[6],这可能是椎动脉覆盖后患者无症状的原因。本研究中椎动脉被覆盖者8例,5例为患侧椎动脉弱势,3例为双侧椎动脉均势,未出现症状性脑梗死。因此,应尽量保留椎动脉血供,可在对侧代偿良好的情况下覆盖患侧非优势椎动脉,双侧椎动脉均势时建议进行术前评估,Willis环异常和既往脑梗死建议重建椎动脉血供,患侧优势椎动脉也需重建。
外科手术重建椎动脉较多见,椎动脉移位或锁骨下动脉-颈总动脉搭桥是常见的手术方式[7]。腔内治疗重建或保留椎动脉报道少见。Song等[8]报道了平行支架和瘤腔弹簧圈栓塞技术治疗1例累及优势椎动脉的SAA,保留椎动脉血供,随访6个月无内漏及脑梗死事件发生。陈宇等[9]报道了密网支架植入治疗1例SAA,保留优势椎动脉血供,随访1 a瘤腔未完全形成血栓,瘤体未增大。因无商品化的多层裸支架可用,针对2例累及椎动脉且为均势的患者,本研究采用2~3枚Wallstent重叠放置使瘤腔显影速度大幅减慢,瘤腔血栓化时间长短不一,可能与服用抗血小板药物相关。此外,对1例患侧优势椎动脉行限制性覆膜支架植入和弹簧圈栓塞,虽然保留了椎动脉,但患者术后1 a发生了Ⅲ型主动脉夹层,该患者年龄65岁,有高血压病史,且直系家属存在Ⅲ型夹层病史,患者左锁骨下动脉开口处和椎动脉近段直径约为10 mm和6 mm,限制性植入两枚长度均为10 cm、直径分别为11、7 mm的Viabahn覆膜支架,支架近远段分别进入主动脉和椎动脉约1、5 cm,导致Ⅲ型夹层的病因并不明确。总体而言,采用腔内技术重建椎动脉并不成熟,还需更多研究及长期随访观察,必要时行外科手术重建椎动脉。
分支动脉供血导致Ⅱ型内漏也是术中需要注意的问题,meta分析报道9例患者术后出现内漏,随访4例自行消失,5例再干预,但内漏类型不详[1]。本研究患者未接受分支动脉栓塞,随访1例术后1个月死亡,考虑是椎动脉和乳内动脉来源的Ⅱ型内漏导致瘤体增大破入气管所致,其余患者未发现内漏。预防性栓塞分支动脉的获益目前仍有争议,因为多数Ⅱ型内漏于随访过程中可自行消失,若Ⅱ型内漏持续存在,需要外科手术结扎分支动脉。建议对瘤体较大者进行分支动脉和瘤腔栓塞,降低内漏发生概率。

随访期间,1例术后7 d复查CTA,显示支架闭塞,瘤腔未显影,患者出现上肢活动无力,考虑支架扭折,急性血栓形成,患者拒绝再次手术,口服抗血小板药物治疗,随访1 a症状较前好转。2例随访2 a支架闭塞,患者无症状,未进一步处理。支架术后近期出现急性闭塞首先考虑支架形态是否扭折,本研究2例患者术中造影近端覆膜支架形态欠佳,再次植入Wallstent矫正,随访未见闭塞。Gao等[14]报道了9例接受腔内修复的SAA患者,随访8~40个月,1例支架内形成血栓。Maskanakis等[1]报道支架治疗SAA成功率为80%~100%,并发症发生率为15.5%,再干预率为8.5%,病死率为10.6%,但死亡患者中仅0.7%与手术有关。总体来看,覆膜支架治疗SAA并发症发生率并不高,近中期通畅率尚可,一些患者即使出现支架闭塞,但症状轻微或无症状,再次干预率较低。
目前缺乏SAA腔内修复的长期随访数据和大量病例报道,但对于具有确切适应证的SAA患者,腔内技术治疗是安全可行的,覆膜支架植入是其首选治疗方式。

