双向情感障碍患者肠道菌群分布情况研究
高威
双相情感障碍(bipolar disorder,BD)是一种反复发作的严重慢性精神疾病,全世界终生患病率为2.4%[1]。BD 发作的发病机制极为复杂,研究普遍认为可能与神经免疫和内分泌调节系统激活导致炎性细胞因子过度分泌有关[2]。同时研究也认为针对BD的诊断主要依靠症状学的评估,缺乏可靠的生物标记物,近几年有关脑肠轴的研究显示肠道菌群在精神疾病的发生和发展中起着越来越重要的作用[3]。本次研究旨在分析BD 患者与健康人群之间肠道菌群分布的差异。现报道如下。
1 资料与方法
1.1 一般资料 选择2018 年3月至2020 年3月丽水市第二人民医院首次接受治疗的BD 患者37例为BD组,其中男性19例、女性18例;年龄30~35岁,平均年龄(32.94±2.20)岁;BD 的诊断和情绪状态分析依据美国精神障碍诊断与统计手册第5 版分为典型的BD-Ⅰ型(至少有一次躁狂发作或混合发作)和BD-Ⅱ型(至少一次轻躁狂发作和重性抑郁发作,并且从未有过躁狂发作的经历)[4]。纳入标准包括:①结合临床表现病史及结构性访谈诊断为BD的患者;②有完整的精神病学检查和实验室资料;③纳入研究前至少1个月内未服用药物。排除标准包括:①患有其他类型的精神疾病;②合并严重急性躯体疾病如感染或慢性炎症疾病;③近1个月内有服用抗生素或抗真菌药物史;④有酒精和毒性或其他精神类药物滥用史;⑤妊娠或哺乳期妇女;⑥合并有炎症性肠病或肠易激综合征,既往有胃肠道手术史。所有患者家属均签署了临床研究治疗知情同意书。并通过本院医学伦理委员会审查。选择本院同期35例健康体检人群作为对照组,其中男性17例、女性18例;年龄30~35岁,平均年龄(32.16±2.36)岁。两组在性别、年龄上比较,差异均无统计学意义(P均>0.05)。
1.2 方法 BD 患者入院后均给予药物治疗,其中29例给予非典型抗精神病药物治疗,4例给予锂治疗,11例给予抗惊厥药物治疗,15例给予抗抑郁药治疗。两组在入院第1天收集0.5 g 粪便标本,DNA 缓冲液稀释后,800 r/min 离心5 min,离心半径6 cm,使用PowerLyzer PowerSoil DNA 分离试剂盒(由德国Qiagen 公司生产)提取粪便标本细菌总DNA,测定浓度后稀释为40 ng/μl,放入-80°C 中保存。随后采用Illumina Miseq 高通量测序平台在16 SrRNA V1~V2 区进行PCR 扩增,鉴定细菌的聚类或操作分类单元(operational taxonomic units,OTU),使用Mothur 软件计算多样性指数测序深度指数(%)和菌群多样性指数,寻找丰度>50%的序列进行物种分类,评估各肠道菌群的结构丰度,以及各组肠道菌群的分布情况。
两组在入院时完成杨氏躁狂评定量表(Young mania rating scale,YMRS)和汉密尔顿抑郁量表(Hamilton depression scale,HAMD)评分。
1.3 统计学方法 采用SPSS 23.0 统计学软件进行数据分析。计量资料以均数±标准差()表示。计量资料比较采用t检验;计数资料比较采用χ2检验。采用Pearson相关性检验分析变量之间的相关性。设P<0.05为差异有统计学意义。
2 结果
2.1 BD组不同分型之间一般临床资料比较见表1
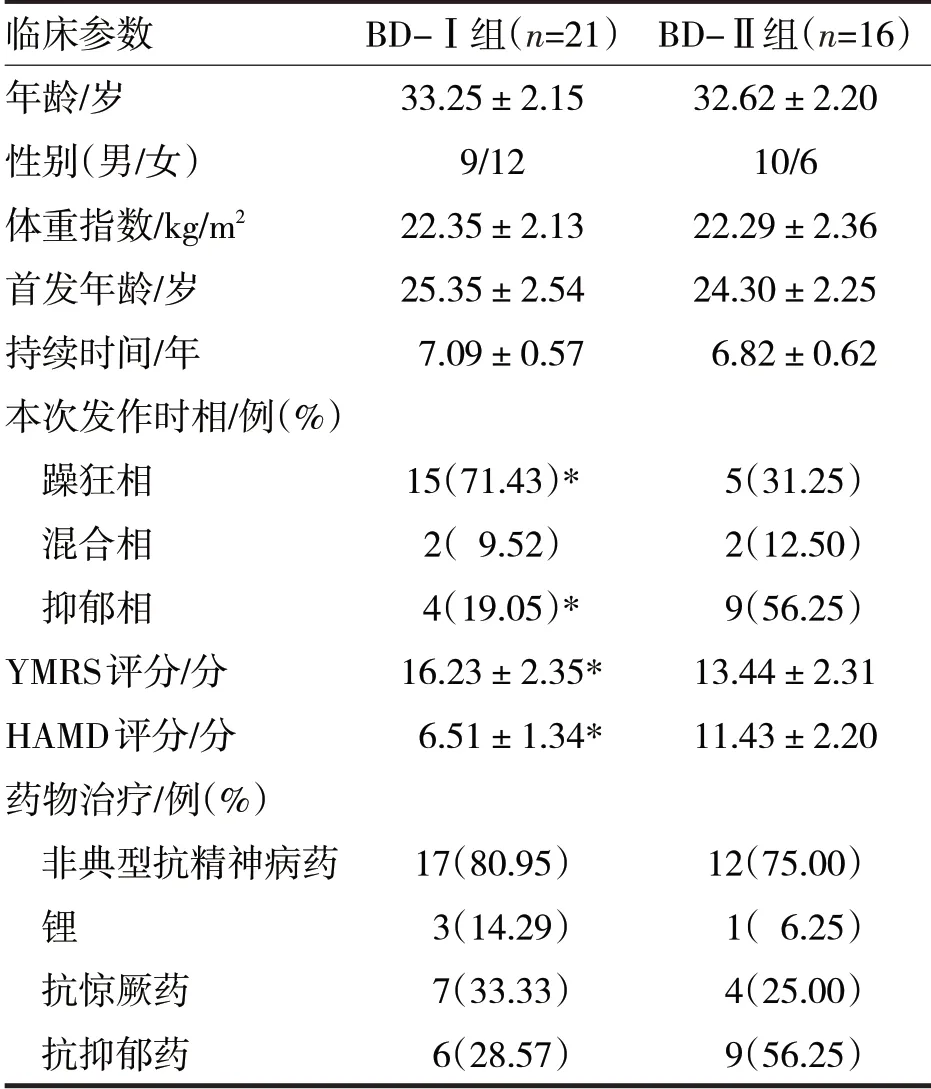
表1 BD组患者不同分型之间临床参数比较
由表1 可见,BD-Ⅰ组的躁狂相占比明显高于BD-Ⅱ组,抑郁相占比明显低于BD-Ⅱ组(χ2分别=5.90、5.52,P均<0.05),BD-Ⅰ组的YMRS 得分明显高于BD-Ⅱ组,HAMD 得分明显低于BD-Ⅱ组(t分别=3.60、8.42,P均<0.05)。两组在年龄、体重指数、首发年龄、持续时间比较,差异均无统计学意义(t分别=0.87、0.08、1.31、1.93,P均>0.05),在性别、非典型抗精神病药、锂、抗惊厥药、抗抑郁药等药物治疗上比较,差异均无统计学意义(χ2分别=1.40、0.19、0.61、0.30、2.89,P均>0.05)。
2.2 两组粪便16SrRNA 基因测序分析结果见表2
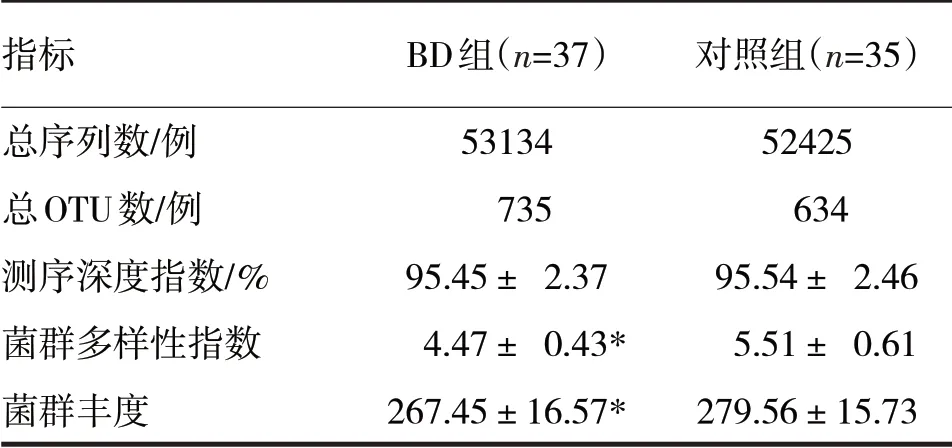
表2 两组粪便16SrRNA 基因测序分析结果
由表2 可见,BD 组的菌群多样性指数和菌群丰度均低于对照组(t分别=8.41、3.18,P均<0.05)。两组测序深度指数比较,差异无统计学意义(t=0.16,P>0.05)。
2.3 BD 组菌群多样性指数与疾病持续时间的相关性Pearson相关性显示,BD 组的菌群多样性指数与疾病持续时间呈反比(r=-0.43,P<0.05)。
2.4 肠道菌群分布情况比较见表3
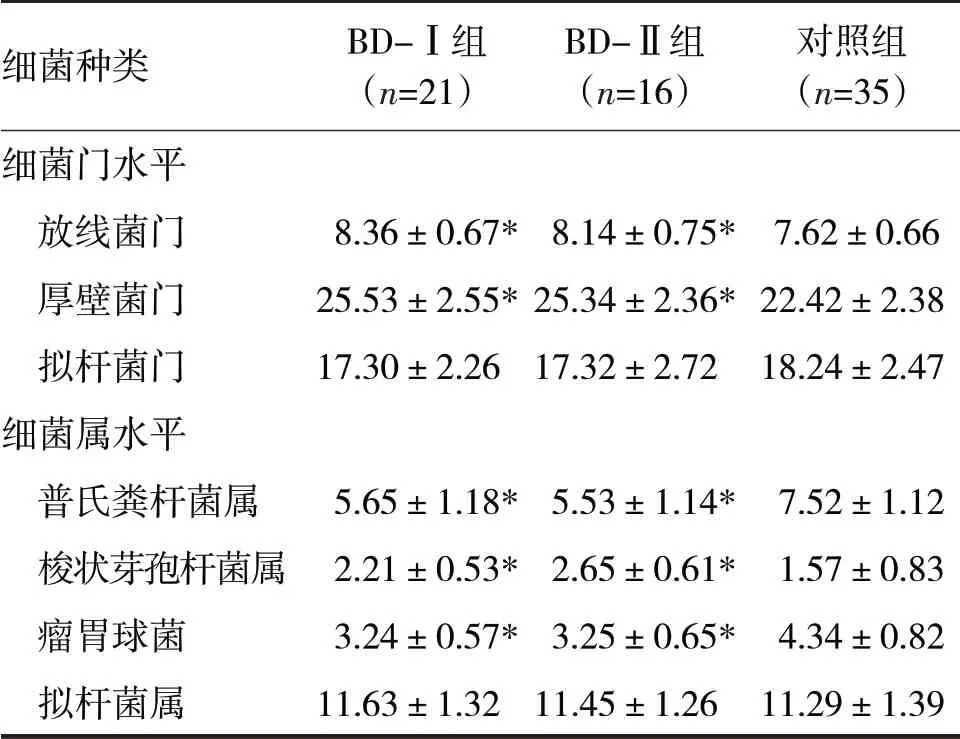
表3 不同分组的肠道细菌分布情况比较
由表3 可见,BD-Ⅰ组和BD-Ⅱ组的放线菌门、厚壁菌门、梭状芽孢杆菌属的所占百分比明显高于对照组,差异均有统计学意义(t分别=4.04、2.50、4.61、4.08、3.16、4.65,P均<0.05),而普氏粪杆菌属和瘤胃球菌的所占百分比明显低于对照组,差异均有统计学意义(t分别=5.93、5.85、5.41、4.68,P均<0.05)。
3 讨论
BD是一种复杂的精神疾病,当出现混合状态时会对疾病的诊断和治疗造成一定的影响[2],由于诊断基于临床症状常被误诊为重度抑郁症,导致预后不良。既往研究认为肠道菌群通过脑肠轴触发BD是BD 发病的潜在机制之一[5]。因此,本次研究旨在比较BD 患者与健康人群肠道菌群分布的差异,评估其在预测BD发作中的价值。
本次研究通过16SrRNA 基因测序方法检测了BD 患者和健康人群的肠道菌群,结果显示,BD 组在细菌门水平上,主要由放线菌门、拟杆菌门、厚壁菌门组成。在菌属水平上,以普氏粪杆菌属、梭状芽孢杆菌属、瘤胃球菌、拟杆菌属为主。与健康人群相比,BD-Ⅰ组和BD-Ⅱ组的放线菌门、厚壁菌门、梭状芽孢杆菌属的所占百分比明显升高,普氏粪杆菌属和瘤胃球菌的所占百分比明显降低(P均<0.05),这与既往多项研究[6,7]结果相似,这些研究均证明BD患者的肠道菌群与健康人群具有一定的差异,并且BD 中普氏粪杆菌属和瘤胃球菌等有益细菌的减少与患者健康状况较差有关。但是在不同研究中,肠道菌群的变化并非完全一致。这可能是因为不同研究中受试者的生活环境和遗传基因不同有关。Painold 等[6]研究显示BD 患者的放线菌门水平明显升高,普氏粪杆菌属的含量降低。Rong 等[7]研究显示BD 抑郁发作期患者的厚壁菌门、放线菌门相对丰度增加,但拟杆菌门相对丰度减少。Evans 等[8]研究不仅显示BD 组的普氏粪杆菌属和瘤胃球菌表达比例明显降低外,还发现BD 组中普氏粪杆菌的丰度与患者的抑郁严重程度呈负相关。这些研究中的BD 患者均常规给予了抗精神药物治疗。在一项针对未经治疗的BD 患者的研究中,结果显示未经治疗的BD 患者的拟杆菌门的丰度明显高于健康人群,而厚壁菌门、普氏粪杆菌属、瘤胃球菌属的丰度明显低于健康人群[9],微生物菌群的这种差异可能是因为肠道菌群容易受抗精神药物的影响。研究显示抗精神类药物可能通过影响代谢因子降低了菌群的多样性[10]。
研究发现普氏粪杆菌属、瘤胃球菌和梭状芽孢杆菌属作为有益菌,均可以产生丁酸[5,9],而丁酸作为肠细胞上定居微生物群的重要产物之一,可以增加上皮粘蛋白的产生,提高肠黏膜上皮紧密连接的完整性[8,11]。在免疫调节、肠道屏障调节、肠道代谢和能量调节中起着重要作用[12]。动物实验研究认为中枢神经系统中的丁酸可能具有影响海马的功能并促进脑源性神经营养因子的表达,调节抗氧化酶的活性,保护大脑免受氧化损伤,具有抗抑郁作用[13]。因此,当产生丁酸的细菌发生紊乱时可能会导致BD的发生[7,11]。
本次研究结果还显示,BD患者的微生物丰度和菌群多样性指数均明显低于健康人群(P均<0.05),并且菌群多样性指数与疾病持续时间呈负相关。这与既往多项研究结果相似,研究认为一方面由于BD 患者的炎症反应导致神经生物学和功能障碍随着疾病持续时间的延长而增加[6,14];另一方面可能与BD 患者长病程引起的营养不良有关,研究认为饮食质量差与BD 发病率增加有关[14]。结合既往有关脑肠轴的研究表明,肠道微生物通过脑肠轴与神经系统的互相作用,通过包括免疫系统激活、炎症反应、分泌神经递质、迷走神经通路、下丘脑-垂体-肾上腺轴激活、色氨酸代谢在内的多种途径影响患者的行为和情绪[15]。因此,丰富的肠道菌群可以为代谢性疾病和自身免疫学疾病提供保护性作用,当多样性降低时会导致多种慢性疾病的发生[11]。
本次研究局限性在于,首先样本量较小,仍需进一步多中心大样本量研究证实该结论。其次,由于BD 患者肠道菌群容易受药物、饮食、生活方式等多种因素的影响,有关BD 患者肠道菌群的特异性仍需进一步研究进行明确。最后,本次研究仅初步分析BD 患者肠道菌群的分布情况,未能对肠道菌群之间的相互作用做进一步研究,由于微生物-肠-脑轴的作用机制非常复杂,不仅要考虑疾病本身的影响,还需要考虑不同微生物物种之间以及微生物与宿主之间的相互作用。
综上所述,BD 患者的菌群多样性指数降低,并且与疾病持续时间呈负相关,放线菌门、厚壁菌门、梭状芽孢杆菌属比例明显高于健康人群,普氏粪杆菌属和瘤胃球菌明显低于健康人群。

