Glut-1 shRNA及诱导自噬对HEp-2细胞的增殖、凋亡和迁移的影响
王文栋 吴晓红 周水洪 范骏
喉癌是头颈部常见的恶性肿瘤,流行病学调查发现近40 年尽管喉癌的诊断治疗手段不断发展,但5 年生存率没有得到很大改善[1]。喉癌疗效受放化疗抵抗、转移、复发等多方面因素[2~7]影响,其真正的机制尚不清楚。因此,有必要继续探索喉癌复发、转移、生长的机制。
恶性肿瘤细胞能量的供应与葡萄糖转运蛋白-1(glucose transporter,Glut-1)高表达[4~9]及自噬[10,11]有关。众多研究已发现抑制Glut-1 表达及调节自噬能抑制一些癌细胞生长、增殖、迁移[11~14]。本次研究通过用短发夹RNA(short hairpin RNA,shRNA)抑制Glut-1 及自噬诱导剂及过表达Beclin-1 观察对喉癌HEp-2 细胞生长及迁移的影响,以观察研究Glut-1是否可能通过自噬影响喉癌HEp-2 细胞生长及迁移。现报道如下。
1 材料与方法
1.1 细胞培养 HEp-2 细胞采用含10%胎牛血清的RPMI 1640 培养基,于37 ℃、5%CO2条件下常规培养,贴壁生长,每2 天传代1 次,取处于对数生长期的细胞用于后续研究。
1.2 Glut-1 shRNA 慢病毒构建和感染 构建慢病毒载体并感染喉癌HEp-2 细胞,参考GenBank 数据库人Glut-1 cDNA序列,然后设计针对Glut-1基因的特异性干扰片段与四质粒的HIV-1慢病毒载体(该载体自带绿色荧光蛋白报告基因)连接,将慢病毒载体转染293T细胞后获得病毒上清,检验病毒滴度后用于感染目的细胞。将HEp-2 细胞置于6 孔板中,调整细胞数量为1.5×105/孔,每孔加入RPMI 1640培养基2 ml,待细胞长到50%~70%时加入200 μl 病毒原液进行转染,转染72 h 和96 h 后在荧光显微镜下观察转染效率。干扰片段序列信息如下:5’-CGCGTCCCCGCAAGAGGCAAGAGGTAGCTTCAAGAGA GCTACCTCTTGCCTCTTGCTTTTTGGAAAT-3’;5’-CGATTTCCAAAAAGCAAGAGGCAAGAGGTAGCTC TCTTGAAGCTACCTCTTGCCTCTTGCGGGGA-3’。
1.3 Beclin1 过表达载体构建和转染 本次应用RT-PCR 方法扩增Beclin1 的cDNA,设计引物,应用RT-PCR 扩增出目的片段,经EcoRⅠ和Hind Ⅲ双酶切后,再将插入片段定向插入真核表达载体pcDNA3.1(+)的相应位点(无荧光标签)。连接产物转化DH5α 感受态细胞,挑选单菌落,重组克隆提取质粒,用EcoRⅠ和Hind Ⅲ双酶切鉴定。然后参照Lipofectamine 2000 操作说明书进行转染。转染24 h 后,以浓度为500 μg/ml 的G418 筛选,3 周后挑选阳性克隆细胞株扩大培养。
1.4 实验分组 Control 组:HEp-2 细胞;NC 组:稳定感染对照shRNA 慢病毒的HEp-2 细胞;Glut-1 shRNA 组:稳定感染Glut-1 shRNA 慢病毒的HEp-2细胞;NC+雷帕霉素(Rapamycin,RAP)组:稳定感染对照shRNA慢病毒的HEp-2细胞;Glut-1 shRNA+RAP 组:稳定感染Glut-1 shRNA 慢病毒的HEp-2细胞;NC+过表达(Lenti)-Beclin1 组:稳定感染对照shRNA 慢病毒的HEp-2 细胞,转染Beclin1 过表达质粒;Glut-1 shRNA+Lenti-Beclin1 组:稳定感染Glut-1 shRNA 慢病毒的HEp-2 细胞,再转染Beclin1过表达质粒。
1.5 CCK-8 实验 分别收集各组培养24 h、48 h、72 h 的细胞,每孔加入10 μl 的CCK-8,孵育2 h,在荧光分光光度计读取光密度(optical density,OD)450 nm数值。
1.6 AnnexinV/PI 检测细胞凋亡 取各组HEp-2 细胞,加入不含EDTA 的胰酶消化,离心收集细胞,微量离心机转速2 000 r/min,离心时间5 min,弃培养基;用冷磷酸盐缓冲液洗涤细胞2 次(2 000 r/min,离心5 min收集细胞);用400 μl 1×Binding Buffer 悬浮细胞,浓度大约为1×106cells/ml;在细胞悬浮液中加入10 μl Annexin V-FITC,轻轻混匀后于2 ℃~8 ℃避光条件下孵育15 min;加入5 μl 碘化丙啶后轻轻混匀于2 ℃~8 ℃避光条件下孵育5 min;在1 h内用流式细胞仪检测。
1.7 Transwell 实验 将各组悬浮于500 μl 无血清培养基的5×104个细胞接种于Transwell上室,下层加入750 μl 含10%磷酸盐缓冲液的细胞培养液,培养8 h。取出Transwell 小室,用棉签拭去上层为穿孔细胞,苏木精-伊红染色后封片,于镜下观察穿孔细胞数目。
2 结果
2.1 细胞增殖情况见图1

图1 不同处理方式处理细胞后细胞增殖情况
由图1 可见,24 h、48 h、72 h 后,Control 组和NC 组的细胞量无明显变化(t分别=0.44、0.90、1.43,P均<0.05)。72 h 后,与NC 组比较,Glut-1 shRNA 组、NC+RAP 组 和NC+Lenti-Beclin1 组 的细胞均明显减少,差异均有统计学意义(t分别=26.00、24.74,27.57,P均<0.05)。72 h 后,与Glut-1 shRNA 组 比 较,Glut-1 shRNA+RAP 组、Glut-1 shRNA+Lenti-Beclin1 组的细胞均明显减少(t分别=12.60、14.99,P均<0.05)。72 h 后,与NC+RAP 组比较,Glut-1 shRNA+RAP 组的细胞明显减少(t=9.85,P<0.05)。与NC+Lenti-Beclin1 组比较,Glut-1 shRNA+Lenti-Beclin1 组的细胞明显减少(t=12.80,P<0.05)。
2.2 细胞凋亡情况见图2
由图2 可见,Control 组和NC 组细胞凋亡均较少,无明显差异(t=0.85,P>0.05)。与NC组比较,Glut-1 shRNA 组、NC+RAP 组和NC+Lenti-Beclin1 组 细胞凋亡率明显增多(t分别=10.12、8.89、8.51,P均<0.05)。与Glut-1 shRNA 组比较,Glut-1 shRNA+RAP组、Glut-1 shRNA+Lenti-Beclin1 组细胞凋亡率明显增多(t分别=21.01、28.13,P均<0.05)。与NC+RAP组比较,Glut-1 shRNA+RAP组的细胞凋亡率明显增多(t=15.67,P<0.05)。与NC+Lenti-Beclin1 组比较,Glut-1 shRNA+Lenti-Beclin1 组的细胞凋亡率明显增多(t=18.78,P<0.05)。
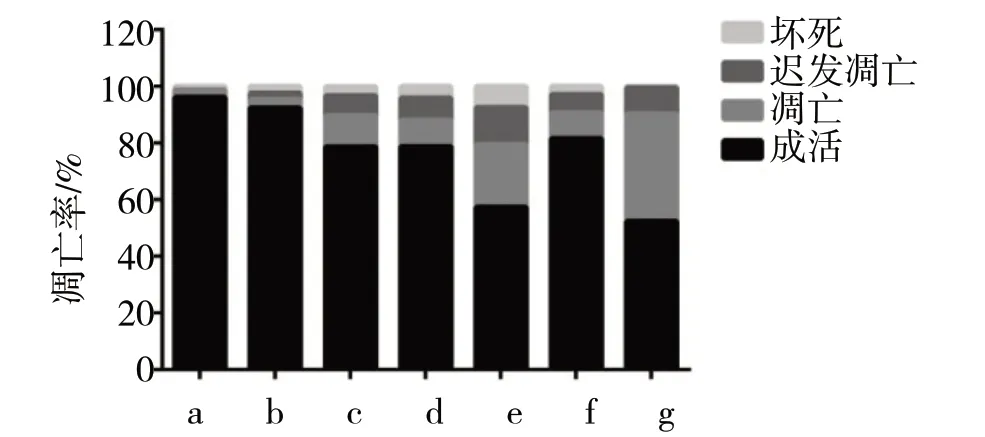
图2 各组细胞凋亡情况
2.3 Transwell实验见图5~11
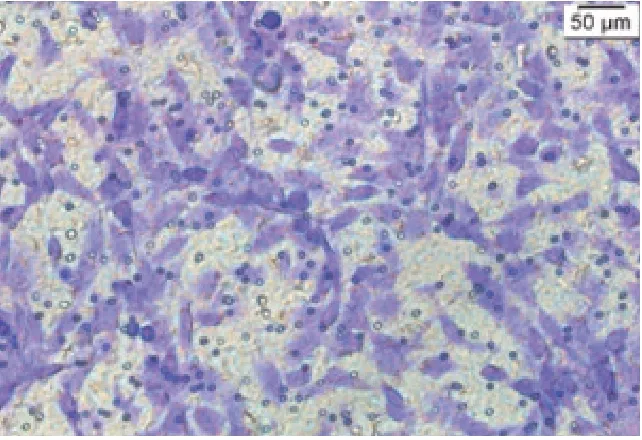
图5 Control组细胞Transwell一次结果
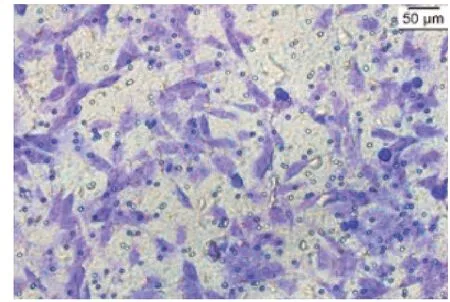
图6 NC组细胞Transwell一次结果
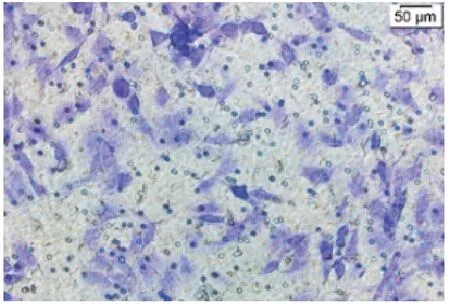
图7 Glut-1 shRNA组细胞Transwell一次结果
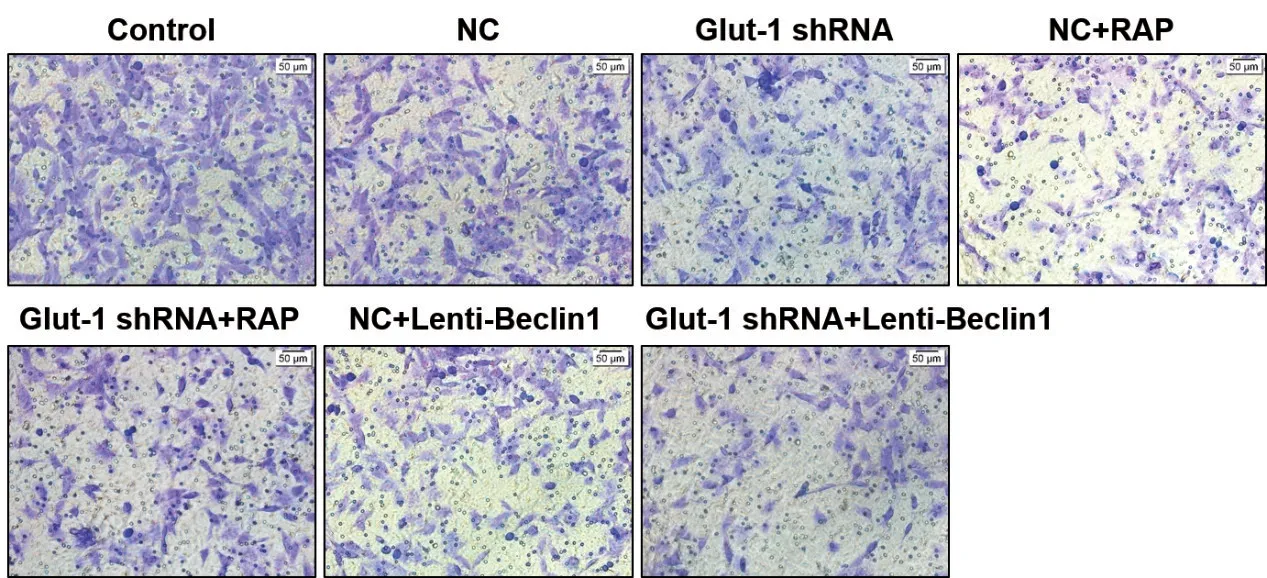
图8 NC+RAP组细胞Transwell一次结果

图9 Glut-1 shRNA+RAP组细胞Transwell一次结果

图10 NC+Lenti-Beclin1组细胞Transwell一次结果

图11 Glut-1 shRNA+Lenti-Beclin1组细胞Transwell一次结果
由图5~11 可见,Control 组和NC 组的细胞数无明显差异。与NC 组比较,Glut-1 shRNA 组、NC+RAP 组和NC+Lenti-Beclin1 组的细胞数明显减少(t分别=9.80、7.31、8.01,P均<0.05)。与Glut-1 shRNA 组 比 较,Glut-1 shRNA+RAP 组、Glut-1 shRNA+Lenti-Beclin1 组细胞数明显减少(t分别=10.71、9.53,P均<0.05)。与NC+RAP 组 比 较,Glut-1 shRNA+RAP 组的细胞数减少(t=11.31,P<0.05)。与NC+Lenti-Beclin1 组比较,Glut-1 shRNA+Lenti-Beclin1 组的细胞数明显减少(t=11.73,P<0.05)。
3 讨论
应激条件下,自噬的发生对细胞生存及死亡具有双重调节作用,一方面自噬过程可以通过其对受损器官及大分子物质的降解作用及再循环利用为细胞的重建、修复和再生提供必须的能量和原料,从而发挥其对细胞应激的调控和防御作用[10~15]。另一方面,过度的自噬水平是一种在形态学上区别于凋亡的细胞程序性死亡[15]。自噬的诱发对肿瘤的发生同样具有双刃剑作用,自噬的激活在肿瘤形成和发展的不同时期均具有不可替代的作用,一方面是阻碍肿瘤发生的屏障,抑制肿瘤的生长,另一方面是肿瘤相对恶劣的环境的适应性应答,促进肿瘤进展[15],基础水平的自噬可维持肿瘤细胞的生存,但是过度持续激活的自噬可激活肿瘤细胞自我降解导致死亡[15]。
肿瘤的发生、增殖、分化、转移都需要大量能量的支持,而葡萄糖是肿瘤的主要能量来源,是维持细胞能量代谢和生命活动的重要原料[16]。恶性肿瘤生长迅速,随着实体瘤的增大,细胞的增殖超过了肿瘤的能量供应,肿瘤内部得不到足够的血液供应,肿瘤细胞对氧和营养的过度消耗导致肿瘤微环境呈现低氧低糖和缺血状态[17,18]。肿瘤细胞通过提高葡萄糖转运加快糖酵解及形成肿瘤新生血管体系作为对缺血缺氧的代偿,其中通过葡萄糖摄入增加能量摄取是一条重要的途径。细胞对葡萄糖的摄取以主动转运和易化扩散的方式通过细胞膜,其中主要通过易化扩散的Glut 来完成[7~10]。Glut 是一类分布于细胞膜上的跨膜糖蛋白,主要介导葡萄糖在细胞膜两侧的跨膜转运。至今已发现14 种Glut蛋白,其中Glut-1 是细胞摄取葡萄糖的主要载体[4~10,16,17]。与正常细胞相比,肿瘤细胞即使在有氧环境中也利用糖酵解途径产生能量,这一特征称Warburg 效 应[19]。由于Warburg 效应,恶性肿瘤Glut-1过度表达以满足恶性肿瘤细胞能量需要。肿瘤生物能量学研究提示,即使在氧充分的条件下,肿瘤细胞仍然采用糖酵解的方式获取能量,这是肿瘤细胞在进化过程中巨大增殖优势和恶性侵袭的关键因素[7,19]。
前期研究以及其它研究显示Glut-1 高表达与一些恶性肿瘤的生物学行为有关,包括喉癌[8,20]、口腔鳞状细胞癌[21]、舌癌[22]等,是预后愈差标志物之一。进一步的研究发现,恶性肿瘤细胞对葡萄糖的代谢率增高与Glut 及基因的异常表达有关[8,20~22]。肿瘤细胞内Glut-1 的表达受多种因素的调节。其中缺氧和营养缺乏是Glut-1 表达增强的主要诱因[9,17,20],众多肿瘤组织处于缺血缺氧的微环境中,就更加依赖葡萄糖[9,17,20]。细胞对缺氧进行适应性反应的主要调控因子是缺氧诱导因子(hypoxia-inducible factor-1,HIF-1),HIF-1α是唯一决定HIF-1活性的氧调节亚单位,HIF-1 活化后与Glut-1 增强子HIF-1α 的DNA 结合位点相结合,导致Glut-1 基因大量表达进而增加葡萄糖摄取[9,17,20]。
随着对肿瘤细胞低氧微环境放射抵抗机制研究的不断深入,发现葡萄糖摄入通路的也可影响细胞自噬[10]。在众多调控自噬的信号通路中,mTOR信号通路被认为是最重要的调控方式之一[23]。mTOR 通过磷酸化自噬相关基因1(autophagy-related gene 1,ATG1)抑制其活性,而雷帕霉素可以通过抑制mTOR 的活性解除对ATG1 的抑制并起始细胞的自噬反应[23]。
在本次研究中,首先通过敲低Glut-1 的表达以观察对喉癌HEp-2 细胞的增殖、凋亡及迁移的影响,然后应用RAP 和过表达Beclin1 两种方法诱导细胞自噬,研究对喉癌HEp-2 细胞的增殖、凋亡及迁移的影响。用shRNA 敲低Glut-1 的表达,发现Glut-1 shRNA 组细胞增殖受到抑制,提示Glut-1 的表达可调控HEp-2 细胞增殖。另外,为了明确过度自噬对于HEp-2 的增殖的影响,本次研究在HEp-2细胞中分别用自噬激动剂RAP 和过表达Beclin1 两种方法诱导细胞自噬,结果发现处理72 h 的时间内,NC+RAP 组和NC+Lenti-Beclin1 组细胞增殖速度明显降低,提示在HEp-2 细胞中,自噬活性增强对HEp-2 细胞增殖起抑制作用。同时发现Glut-1 shRNA 组细胞凋亡明显增加,提示抑制Glut-1 的表达可以促进HEp-2 细胞凋亡。为了研究HEp-2 细胞的自噬作用是否能促进细胞的凋亡,同样用RAP和过表达Beclin1 两种方法诱导HEp-2 细胞自噬,和NC 组相比,NC+RAP 组和NC+Lenti-Beclin1 组细胞凋亡明显增加,说明诱导细胞过度自噬会促进HEp-2 细胞凋亡。用shRNA 敲低Glut-1 后,Transwell 实验检测细胞迁移能力发现,和NC 相比,Glut-1 shRNA 组细胞迁移明显降低,提示抑制Glut-1 的表达可抑制HEp-2 细胞迁移。用RAP 和过表达Beclin1两种方法诱导自噬后,用Transwell 实验检测迁移细胞数目,发现和NC 组相比,NC+RAP组和NC+Lenti-Beclin1 组细胞迁移数目明显减少,提示诱导细胞自噬会降低HEp-2细胞的迁移能力。
综上所述,Glut-1 表达可调控HEp-2 细胞增殖、凋亡与迁移,相对于对照组,Glut-1 shRNA 组细胞增殖减少、凋亡增加、迁移减弱;应用RAP 和过表达Beclin1 两种方法人为诱导HEp-2 细胞自噬后发现,相对于对照组,HEp-2 细胞增殖减少、凋亡增加、迁移减少,提示shRNA 敲低Glut-1 可能通过自噬途径调控HEp-2细胞的生长与迁移。

