严重急性呼吸系统综合症冠状病毒-2与横纹肌溶解症
韦湛海,吕海芹
(东南大学 医学院,江苏 南京 210009)
2019新型冠状病毒(2019 novel coronavirus,2019-nCoV),又被称为严重急性呼吸系统综合症冠状病毒-2(severe acute respiratory syndrome coronavirus,SARS-CoV-2),是一种具有高传染性的新型冠状病毒,由SARS-CoV-2感染引发的新型冠状病毒病(corona virus disease 2019,COVID-19)全球大流行给人类健康造成巨大威胁。根据霍普金斯大学的统计数据,截至北京时间2020年11月19日12点,全球已经有56 187 563人被确诊感染SARS-CoV-2,1 348 600人死于COVID-19[1]。SARS-CoV-2感染患者出现病理损伤的部位主要是肺部,胸部电子计算机X射线断层扫描(computed tomography,CT)检查显示散在分布于全肺的磨玻璃样密度影、网格状影和(或)纤维化影等,病情发展后期逐渐进展为实心白色样的“肺实变”,最常见的临床症状包括发热、咳嗽、呼吸困难、肌痛和全身不适,少数患者出现腹痛腹泻[2-4]。但是随着患病人数的增加,越来越多的文献报道提示COVID-19是一种多器官系统疾病,除了呼吸系统以外,还可以侵犯消化系统、神经系统、泌尿系统及骨骼肌系统等,有的患者甚至以其它系统损害为主要临床表现,这些非典型表现增加了COVID-19临床诊治的难度和挑战,影响疾病的预后,需要引起特别重视[ 5-11]。
横纹肌溶解症(rhabdomyolysis)是一种急性、潜在的致命性综合征,是由于物理、化学、生物等因素导致横纹肌细胞坏死、崩解,细胞内容物大量释放入血液而引起的一组临床综合征。由于引发横纹肌溶解的因素不同,其临床表现也不全相同,一般当血清肌酸激酶(creatine kinase,CK)水平为正常值的5倍以上或血/尿肌红蛋白升高时,即可确诊[12]。Guan等[4]统计了1 099例发生在中国大陆的COVID-19患者的临床资料,发现有13.7%的患者出现CK升高,2例患者出现了横纹肌溶解。横纹肌溶解症是COVID-19的一种罕见并发症,但是如果不能及时诊治,容易引起代谢紊乱、电解质异常及急性肾功损伤(acute kidney injury,AKI),甚至成为患者的直接致死因素[8]。作者综述了目前已经报道的SARS-CoV-2感染相关的横纹肌溶解症案例,并分析了其临床特点及可能的发病机制,从而为进一步防治COVID-19及其并发症提供理论依据。
1 SARS-CoV-2感染相关横纹肌溶解症的临床特征
作者以“COVID-19 and Rhabdomyolysis”和“SARS-CoV-2 and Rhabdomyolysis”为关键词,从Pubmed和SciFinder数据库检索到24篇SARS-CoV-2感染相关的横纹肌溶解症案例报道[7-11,13-31]。这些文献一共报道了28个临床案例,从这些案例的临床资料中可以发现SARS-CoV-2感染相关的横纹肌溶解症的发生无地域分布特征,3例发生于中国,15例发生于美国,墨西哥和瑞典各2例,其余6例分别来自西班牙、土耳其、法国、葡萄牙、比利时和秘鲁。不同性别患者的疾病发生率和预后有明显差异,28例患者中男性为24例(占患者总数86%),其中19例伴有AKI,死亡7例,2例治疗后病情继续恶化;4例女性患者中只有1例伴有AKI,经治疗后全部好转。AKI是横纹肌溶解症的严重并发症,这类患者除了需要大量补液治疗以外,常常需要肾功能替代治疗,为了了解不同性别对横纹肌溶解症病情的影响,作者对不同性别患者AKI发生率进行了统计学分析,结果发现男、女性患者中发生AKI的差异具有统计学意义,提示男性COVID-19患者更易发生AKI且预后较差(表1)。各个年龄段的COVID-19患者均可发生横纹肌溶解,患者年龄最大者为88岁,最小者为15岁。50岁以上患者共12例(占43%),其中有 9例伴有AKI;50岁以下患者16例(占57%),其中11例伴有AKI,不同年龄AKI发生率差异无统计学意义(表1 ),提示年龄与病情严重程度、是否会引起AKI及预后无直接相关性。有20例患者(占71%)在感染SARS-CoV-2前患有其它疾病或曾接受过其它治疗,其中16例出现AKI;8例无基础性疾病或未接受过其它治疗的患者中有4例出现AKI,但是两组之间AKI发生率的差异无统计学意义(表1)。在临床表现方面,所有患者都出现局部或全身肌肉疼痛和无力,肌肉疼痛以四肢更为显著,伴有肌肉压痛,部分患者出现尿的颜色变深甚至呈浓茶水或可乐样颜色,这些症状出现的时间无明显规律性,有的出现在发病初期[18,21,23],有的出现在病程后期[13,20];23例患者(占82%)同时有呼吸系统感染的临床症状,包括发热、咳嗽、气短、呼吸困难及乏力等,多数患者胸部X线或CT显示双肺多发磨玻璃影、浸润影,个别患者仅出现胸膜腔少许积液[7,11],23例患者中有17例出现AKI;5例无呼吸系统感染表现的患者中有3例出现AKI,有无呼吸系统感染表现的患者AKI发生率差异无统计学意义(表1)。部分患者除了呼吸系统和骨骼肌受到侵犯以外,还出现心血管系统病变,2例患者有心肌炎或心肌炎合并心包炎[10-11],1例患者出现严重的下肢静脉血栓形成及闭塞性动脉粥样硬化样病变[9],1例患者出现严重的体循环毛细血管渗漏综合征(systemic capillary leak syndrome,SCLS)[24],周围血管病变加重了病情,增加了诊断和治疗的困难,提示预后较差。所有发生横纹肌溶解症的COVID-19患者都出现血液CK或肌球蛋白(myoglobin)显著升高,CK峰值出现的时间不固定,有的是入院时即为峰值,有的是在治疗过程中出现峰值,经过治疗峰值一般持续2 d左右开始下降;另外,除了反映肾功能的血液肌酐、尿素氮、电解质及淋巴细胞等常规指标变化以外,绝大部分患者的血液中丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、乳酸脱氢酶(lactate dehydrogenase,LDH)、C反应蛋白(c-reactive protein,CRP)、D-二聚体(D-dimer)等炎症因子明显升高,提示炎症反应在横纹肌溶解的发生发展中扮演了重要的角色。
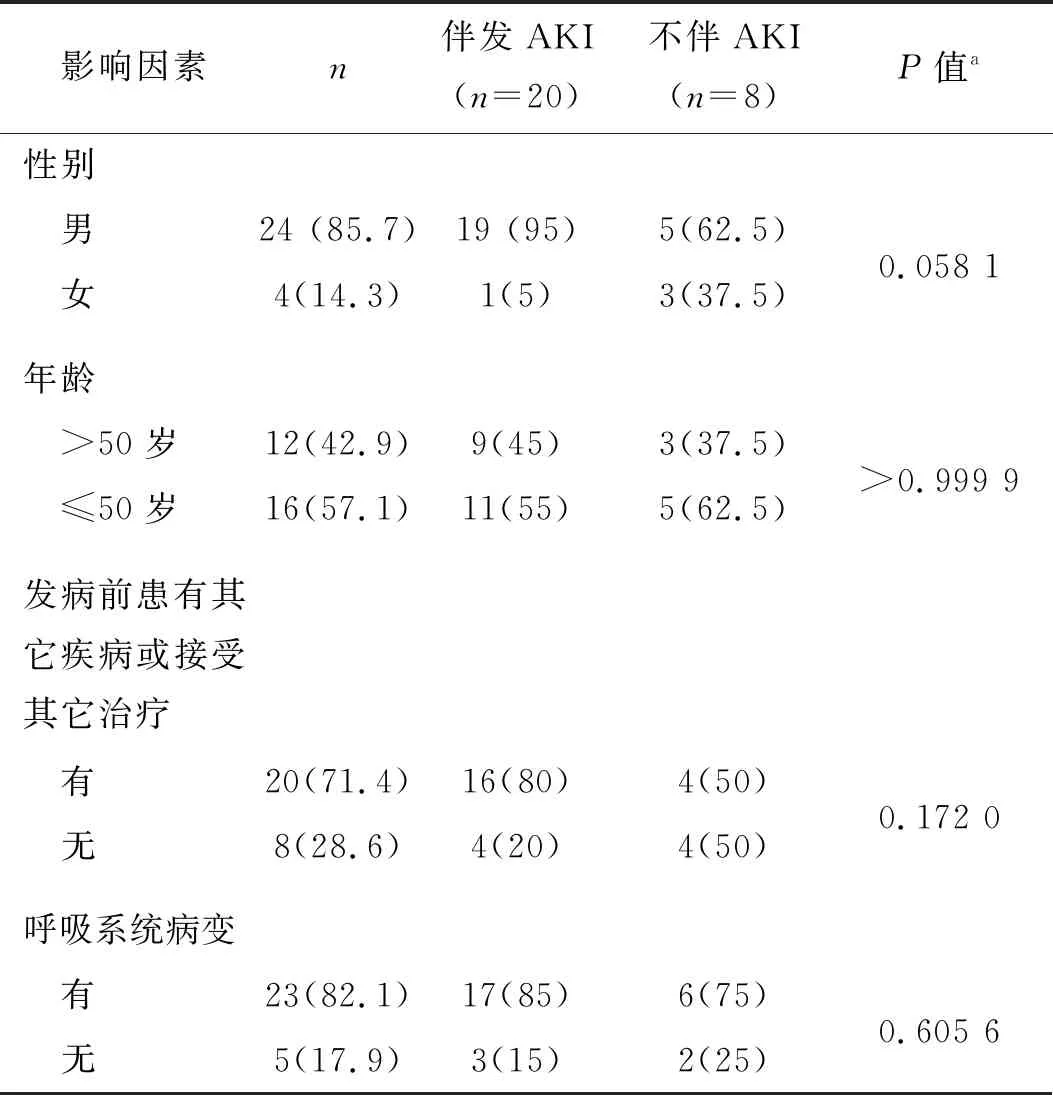
表1 SARS-CoV-2感染相关横纹肌溶解症患者伴发AKI的影响因素 例
2 SARS-CoV-2感染相关横纹肌溶解症的发病机制
目前对于COVID-19相关的横纹肌溶解症的发病机制还不清楚,根据已有的文献报道及患者的临床诊治资料推断,可能的发病机制:(1) 病毒侵犯横纹肌细胞导致横纹肌溶解;(2) 病毒引起机体的过强免疫反应导致大量细胞因子释放和过度炎症反应,破坏肌肉组织;(3) 肌肉组织缺氧性损伤。
2.1 SARS-CoV-2感染直接引起横纹肌溶解
既往的研究表明,流感病毒、腺病毒、呼吸道合胞病毒、严重急性呼吸系统综合症(severe acute respiratory syndrome,SARS)病毒感染均可以引起横纹肌溶解症,其中以流感病毒相关性横纹肌溶解最常见[32-36]。SARS-CoV-2是属于β属的冠状病毒,为单链正股RNA病毒,病毒基因组被包裹在由核衣壳蛋白形成的螺旋衣壳内,并进一步被包膜包裹。病毒颗粒呈球形或椭圆形外观,至少有3种蛋白与病毒的包膜相关,其中膜蛋白(membrane protein,M蛋白)和衣壳蛋白(envelope protein,E蛋白)与病毒的包装相关,刺突蛋白(spike protein,S蛋白)介导病毒侵入宿主细胞[3,37-39]。S蛋白是一种糖蛋白,位于病毒表面,呈钉状向外突起,它除了介导病毒入侵以外,也是诱导宿主免疫反应的关键因子。S蛋白由S1和S2两个亚单位组成,S1用于与宿主细胞受体结合,能够与人血管紧张素转换酶2受体(angiotensin-converting enzyme 2 receptor,ACE2)高度亲和性结合;S2用于膜融合,当病毒颗粒通过S1与受体结合附着在宿主细胞表面后,S2使细胞膜与病毒颗粒的膜融合,然后通过内吞作用进入细胞[38-40]。Wrapp等[39]研究发现,SARS-CoV-2的S蛋白与ACE2的亲和力远高于SARS病毒的S蛋白,提示其传染性更强。Desdouits等[41]研究发现,分化成熟的骨骼肌细胞是甲型流感病毒H1N1的易感细胞,病毒可以直接感染骨骼肌细胞并在细胞中增殖,增殖的子代病毒具有较强的传染性,能够感染周围的肌细胞,被感染的细胞发生病变、溶解并持续释放炎症细胞因子,为病毒直接侵犯骨骼肌细胞引起横纹肌溶解提供了直接的证据。ACE2是肾素-血管紧张素系统(renin angiotensin system,RAS)中一种重要的金属钛酶,广泛表达于各种器官和组织,在调节血压、体液平衡和细胞增殖等生命活动中发挥重要作用[42-43]。目前虽然未见到有关ACE2在骨骼肌细胞中表达的研究报道,但是不能就此排除ACE2在骨骼肌细胞上的表达,SARS-CoV-2有可能通过结合ACE2直接进入骨骼肌细胞并在细胞中大量增殖,引起横纹肌溶解。
2.2 过度炎症反应导致横纹肌溶解
SARS-CoV-2的S蛋白具有较强的免疫原性,可以刺激机体的免疫系统产生特异性和非特异性免疫反应[38,40]。据Guan等[4]统计,中国1 099例COVID-19患者中有914例(83.2%)出现低淋巴细胞血症。COVID-19患者血浆中多种炎症因子如白细胞介素(interleukin,IL)、粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)、肿瘤坏死因子α(tumor necrotic factor alpha,TNF-α)和血管内皮生长因子(vascularendothelial growth factor,VEGF)等水平明显升高,而COVID-19危重症患者体内的炎症因子水平显著高于普通COVID-19患者,更容易发生多器官功能损害且预后更差[44-45]。血清IL-18的水平与肌酸酐、转氨酶、肌钙蛋白等炎症指标及患者疾病的严重程度呈正相关。COVID-19患者血清IL-18水平越高,病情越严重,预后也越差[46]。另外,Takahashi等[47]研究发现,男性和女性患者对SARS-CoV-2感染产生的免疫反应不同,男性血浆炎症因子IL-18、IL-8、趋化因子5(chemokine ligand 5,CCL5)及血液中非典型单核细胞水平均显著高于女性患者,女性患者的CD8+T细胞活性高于男性患者。较弱的T细胞反应与男性患者的年龄呈负相关,与较差的预后相关,而在女性患者中则没有这种相关性。相比之下,在女性患者中非特异性免疫细胞因子水平较高与病情恶化有关,水平越高预后越差,而在男性患者中则没有这种相关性。男性和女性均容易感染SARS-CoV-2,在中国1 099例COVID-19患者中,女性患者占41.9%[4],但是男性患者的病死率和重症率明显高于女性[48-49]。作者统计的28例SARS-CoV-2感染相关横纹肌溶解症患者中,男性患者24例,占85.7%,其中19例出现AKI,AKI发生率显著高于女性,提示男性患者对SARS-CoV-2的免疫应答反应更强烈,炎症损伤更重。另外,CRP是血浆中一种急性时相反应蛋白,正常人血清中含量极微,但是在各种急性炎症发作后迅速增加,能够激活补体和加强吞噬细胞的吞噬而起调理作用,在宿主对感染的防御反应、对炎症反应的吞噬作用和调节作用中发挥重要作用,常作为急性炎症反应的重要指标。作者统计的大部分SARS-CoV-2感染相关横纹肌溶解症患者血清CRP水平明显升高,部分患者对糖皮质激素治疗很敏感,经甲基泼尼松龙和羟氯喹治疗后,肺部炎性浸润迅速减轻,血CK水平很快回落至正常水平[27]。这些结果表明SARS-CoV-2感染后可以引起机体产生过度免疫反应,大量的炎症因子持续释放,免疫失调和细胞因子风暴(cytokine storm)引起的过度炎症反应可能是导致组织损伤的主要原因,可能是导致横纹肌溶解的重要因素。
2.3 肌肉长时间缺氧导致横纹肌溶解
ACE2在血管内皮细胞和平滑肌细胞中高表达,心血管系统很容易被SARS-CoV-2攻击。当冠状病毒的S蛋白与血管内皮细胞的ACE2结合后,病毒进入细胞大量复制,可能导致大量内皮细胞死亡和毛细血管渗漏,触发大量促炎症细胞因子和趋化因子的产生[40]。同时SARS-CoV-2引起ACE2脱落和表达下调,导致RAS功能失调,进一步加重炎症反应及增加血管渗透性,导致血液浓缩、血管内微血栓形成,引起供血部位组织水肿、骨筋膜室综合征及横纹肌溶解[9,24]。血浆D-二聚体是在血栓分解过程中由纤溶酶裂解纤维蛋白而产生的片段,D-二聚体水平升高提示有血栓形成倾向,需要进行抗凝治疗。作者统计的28例SARS-CoV-2感染相关患者中有17例出现血浆D-二聚体水平升高;重型、危重型COVID-19患者可见D-二聚体升高、外周血淋巴细胞进行性减少、炎症因子水平升高;全身主要部位小血管可见内皮细胞脱落、内膜或全层炎症;血管内有混合血栓形成、血栓栓塞及相应部位的梗死及微血管内透明血栓形成[50]。这些结果提示,血液循环中病毒粒子侵犯血管内皮细胞导致的血管壁炎症反应和血管内血栓形成可能会引起骨骼肌长时间缺血缺氧,进而发生细胞坏死和凋亡,这可能是导致横纹肌溶解的机制之一。
3 SARS-CoV-2感染相关横纹肌溶解患者AKI的发生机制
AKI是横纹肌溶解症的严重并发症,28例SARS-CoV-2感染相关横纹肌溶解患者中有20例出现了AKI,发生率高达71.4%。目前对SARS-CoV-2导致AKI的机制还不十分清楚,根据已有的文献资料可以推测:COVID-19横纹肌溶解症患者AKI的发生是多个因素综合作用的结果。Su等[51]对26例死于COVID-19的患者的肾组织进行了病理检查,结果发现所有患者都出现不同程度的弥漫性急性肾小管损伤(acute tubular injury,ATI),表现为近端小管上皮细胞变性,刷状边界消失或空泡变性,管腔内可见到细胞碎片或坏死、脱落的上皮细胞。电镜下可以观察到近端肾小管上皮细胞和肾小球足突细胞中有簇状的球形冠状病毒样颗粒和棘突状的刺蛋白,部分足突细胞呈空泡样变性,从肾小球毛细血管基底膜脱落。肾小管上皮细胞中的球形颗粒经免疫荧光染色证实为冠状病毒颗粒。这一发现有力地证明,SARS-CoV-2可以直接侵犯肾小管上皮细胞和肾小球足细胞导致AKI或蛋白尿的发生。另外,肾间质充血、肾小管周围毛细血管及肾小球毛细血管腔内有红细胞聚集甚至堵塞管腔及血管内皮损伤的病理现象较常见,部分患者肾小球毛细血管袢中有少量节段性纤维蛋白血栓形成,近端肾小管细胞内ACE2表达上调,免疫荧光染色可以检测到肾组织内非特异性IgM和补体C3蛋白,部分患者肾小球系膜区和毛细血管壁上检测到IgA,电镜下可以观察到毛细血管壁上散在分布的呈驼峰状的补体C3蛋白,有1例患者肾组织活检检测到毛细管内节段性颗粒状IgG,这些结果提示免疫炎症反应引起的肾血管内皮细胞损伤和血栓形成可能导致患者肾血流量减少及肾小球滤过功能下降,从而损伤肾功能[51]。横纹肌细胞溶解后细胞内大量内容物释放入血液循环,血液中的钾离子、肌球蛋白、CK及乳酸等水平显著升高,导致电解质紊乱、乳酸血症及高肌球蛋白血症。当肌球蛋白水平超过血浆结合能力时会通过肾小球滤过经尿液排出,形成浓茶样尿液。大量的肌球蛋白会沉积在肾小球中,堵塞肾小管,从而产生肾毒性和AKI[12]。Su等[51]发现,4例临床上出现血尿的COVID-19患者的肾小管上皮细胞中可以检测到含铁血黄素颗粒,其中3例肾小管内可以见到含铁血黄素铸型同时伴有磷酸肌酸激酶水平的显著升高,提示患者发生横纹肌溶解,肌球蛋白沉积堵塞肾小管,导致AKI。
4 SARS-CoV-2感染相关横纹肌溶解症的预防和治疗
横纹肌溶解症是COVID-19的罕见并发症,但是如果不能及时发现和治疗,很容易引起AKI,使病情恶化,增加救治成本和死亡风险。横纹肌溶解症的临床症状与疾病的严重程度相关,轻者可以只是血清CK和血浆肌球蛋白显著升高,重者可以有典型的肌痛、尿色深和肌无力表现,但是只有不到10%患者出现上述三联症状[12]。乏力和疲劳是COVID-19的常见症状,容易掩盖横纹肌溶解症的症状,所以临床诊疗过程中建议将血清CK作为住院COVID-19患者常规检测指标之一进行动态监测。对于无呼吸系统典型症状或胸部X线检查无典型病变、但有与COVID-19患者密切接触史或疫区旅行史的轻症患者或普通COVID-19患者,如果出现全身虚弱无力,腹部或上、下肢等部位疼痛时,要高度警惕横纹肌溶解症的发生,及时检测血清CK和肌红蛋白的水平,以便于早期发现和治疗。
COVID-19合并横纹肌溶解症的治疗措施除了针对呼吸道症状和病毒感染等对症支持治疗外,主要是积极的液体复苏,纠正酸碱失衡,必要时给予利尿剂治疗以保持足够的尿量和肾清除率,阻止肌球蛋白等细胞内容物的持续释放,防止AKI和严重的代谢紊乱及电解质失调的发生[12]。虽然早期给予大量静脉补液是恢复肾灌注和防止AKI的常规治疗方法,但并非所有患者都适合大量静脉输液,激进的补液可能会导致患者体内水负荷过多及发生急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的风险。Suwanwongse 等[7]建议对患者进行小剂量静脉输液(即250 ml),并进行密切的临床观察,连续监测血氧饱和度以及血清肌酐和CK水平。如果患者的血清肌酐水平升高,应重复小剂量补充液体。Alrubaye等[15]推荐采用下列方案对有轻度呼吸道症状COVID-19合并横纹肌溶解症的患者进行治疗:(1) 在血压为100/60至120/80 mmHg的情况下,开始使用大剂量的生理盐水;(2) 以150 ml·h-1的速率给予乳酸林格液维持治疗,同时密切监测血氧饱和度、尿量、血清电解质以及CK、肌酐和转氨酶的水平;(3) 如果患者的CK、肌酐水平和低血压状况继续恶化但没有出现急性心力衰竭的症状,则除乳酸林格液维持治疗外还应补充少量生理盐水。如果患者出现AKI、高钾血症、严重酸中毒或利尿剂治疗无效的肺水肿或水负荷过多时,则要尽早给予血液净化和连续性肾替代治疗(continuous renal replacement therapy,CRRT)[50]。
5 结 语
SARS-CoV-2感染所导致的COVID-19是以呼吸道受累为主要表现的呼吸道传播性疾病,越来越多的临床资料表明COVID-19是一种多器官系统性疾病,其发病机制尚不清楚。根据已有的研究结果推测病毒通过识别和结合ACE2进入宿主细胞并在细胞内大量复制,引起细胞损伤变性、甚至坏死,释放出细胞内容物,产生炎症反应;同时通过刺激机体产生特异性和非特异性免疫反应,导致免疫失调和细胞因子风暴形成,进一步加重炎症反应和组织损伤。COVID-19呼吸道以外的并发症有神经系统损伤、心血管系统损伤、消化系统损伤、泌尿系统损伤及骨骼肌系统损伤等等。横纹肌溶解症是COVID-19的一种罕见并发症,由于其临床表现不典型容易被漏诊,但是治疗不及时容易导致AKI和病情恶化,给临床诊治带来极大挑战,因此在临床诊治过程中需要引起重视,有必要将血液CK作为常规的检测指标之一进行动态检测以便于早发现和及时治疗。SARS-CoV-2感染相关的横纹肌溶解机制仍不明确,治疗上主要是补液、纠正酸碱失衡和电解质紊乱及对症支持治疗。有效的隔离措施和积极开发疫苗进行主动免疫是预防COVID-19流行和横纹肌溶解症并发症发生的最重要措施。下一步亟待解决的问题是明确COVID-19的发病机制和治疗靶点,以便尽早研发出高效价的特异性疫苗和治疗药物,减少并发症的发生和病死率。

