猪源肺炎克雷伯氏菌耐药性及毒力基因分析
欧冠标,周雨晴,彭 昊,陆泽宁,廖玉英,马东鑫,袁敬知,葛 强,李 珣,王晓晔
(1.广西大学动物科学技术学院,广西南宁 530004;2.广西壮族自治区兽医研究所,广西南宁 530000;3.南宁市武鸣区双桥镇水产畜牧兽医站,广西南宁 530104)
肺炎克雷伯氏菌(Klebsiella pneumoniae,Kp)是一种重要的条件性致病菌,常寄生于人和动物的肠道和呼吸道内,可引起肺炎、脑膜炎、腹膜炎、泌尿系统感染、子宫炎、乳房炎及其他化脓性炎症,甚至败血症[1-2]。目前已从马、牛、猪、鸡、鹧鸪、鸭和鱼等多种动物体内分离到Kp[3-7]。各年龄阶段的人均可被Kp感染,免疫缺陷者不但易感且易发败血症。Kp广泛存在于自然界的土、水、谷类中。患者和患病动物是其主要传染源,主要通过呼吸道传播。畜禽养殖环境中,家禽及其产品如蛋、肉用鸡及它们所处的环境,可能是人感染Kp的传染源。普通公众感染主要是自身带菌所致的内源性感染,少部分是外源性感染,如医疗器械、静脉注射等的侵入性诊疗措施和医务人员带菌传播。人食物中毒主要通过被Kp污染的食物。
目前,我国对Kp的研究大多在人医方面,而对猪源Kp的研究相对较少。本试验对从广东省佛山市一家屠宰场采集的125份肛拭子和50份猪肉样品,通过细菌分离鉴定、药敏试验、耐药基因及毒力基因检测,探究屠宰前后猪源Kp的分布及相关菌株的生物学特性和耐药性,以期为防控该菌引起的养殖场生猪感染、抗生素耐药性及保障猪肉品质,强化屠宰加工过程中的公共卫生管理提供技术支撑。
1 材料与方法
1.1 材料
1.1.1肛棉拭子 分3批采集自佛山市某屠宰场存栏待宰生猪。采用消毒棉拭子插入生猪肛门采取粪便,置入装有少量灭菌生理盐水的试管内,并对每管标记编号,4 ℃保存,共125份。样品对应生猪分别来自9个省份,其中福建12份、广东38份、湖南25份、江西28份、吉林8份、辽宁4份、陕西6份、山西2份、黑龙江2份。
1.1.2猪肉样品 采集自该屠宰场屠宰后流水线上的生猪胴体。用灭菌剪子剪取约1 cm×1 cm的肉粒一块,每份肉样装入灭菌离心管内,-20 ℃存储,共50份。样品对应生猪来自6个省份,其中福建8份、江西8份、黑龙江5份、广东12份、辽宁6份、湖南11份。上述肛棉拭子和猪肉采样后做好记录,包括日期、编号、产地等,然后将样品冷冻保存送往广西大学动物医院实验室进行检测分析。
1.1.3主要试剂 麦康凯(MAC)培养基、Luria-Bertani(LB)液体培养基,均购自Oxoid公司;药敏试验抗菌素药粉,购自北京索莱宝科技有限公司;DL 2 000 DNA Marker、2×RapidTaqMaster Mix聚合酶,购自南京诺唯赞生物科技有限公司;细菌DNA提取试剂盒,购自天根生化科技有限公司;革兰氏染色液,购自北京索莱宝科技有限公司;试验所用引物,由北京六合华大基因科技有限公司合成。
1.2 方法
1.2.1细菌分离培养 将采集的样品解冻后,于无菌环境下用接种环蘸取管内液体,划线接种于MAC培养基,37 ℃培养12~16 h;挑取大小一致、粉红色黏液性的单个疑似菌落接种于MAC培养基进行纯化,37 ℃培养12 h;挑取单个菌落进行革兰氏染色,镜检观察;最后接种单个菌落于3 mL LB培养基中,37 ℃过夜培养。
1.2.216S rRNA及体外溶血酵素基因(khe)扩增鉴定
1.2.2.116S rRNA细菌分离纯化后提取基因组DNA,以基因组DNA为模板,用16S rRNA基因序列通用引物(上游引物:5'-CCGTCTTCAGTTCCAGTGTG-3';下游引物:5'-GTTGGCGGACGGGTGAGTAA-3')进 行PCR扩增。预期扩增片段长度约1 500 bp,引物由北京六合华大基因科技有限公司合成。PCR反应体系25.0 μL:上、下游引物各1.0 μL,2×TaqMaster Mix 12.5 μL,DNA模板2.0 μL,最后ddH2O补足至25.0 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,共30个 循环;72 ℃延伸10 min。PCR产物经1.2%琼脂糖凝胶电泳,验证扩增条带。将目的条带切胶回收后送至生工生物工程(上海)股份有限公司测序,将分离株16S rRNA基因序列与GenBank数据库收录基因序列进行比对分析。
1.2.2.2khe基因khe基因仅存在于Kp,可作为鉴定的特异性靶标[8]。根据GenBank中khe基因序列(登录号:CP035202.1)设计特异性引物(khe-F:5'-ATGAAACGACCTGATTGCATTCGC-3';khe-R:5'-TTACTTTTTCCGCGGCTTACCGTC-3')进行PCR扩增,预期扩增片段长度为489 bp,引物由北京六合华大基因科技有限公司合成。PCR反应体系与16S rRNA扩增体系相同。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共32个循环;72 ℃延伸10 min。反应结束后PCR产物进行1.2%琼脂糖凝胶电泳检测。
1.2.3毒力基因扩增 以细菌基因组DNA为模板,对fimH、kfu、aereobactin、wabG、uge等5种毒力基因进行PCR扩增(引物信息见表1)和凝胶电泳分析,比较不同来源菌株毒力基因分布。

表1 毒力基因引物序列信息
1.2.4耐药基因扩增 以细菌基因组DNA为模板,对氨基糖苷类耐药基因aadA1、aadB,β-内酰胺类耐药基因blaTEM、blaCTX-M-1、blaCTX-M-2、blaOXA,喹诺酮类耐药基因qnrA、qnrB、qnrS、aac(6')-Ib-cr,四环素类耐药基因tet(A),酰胺醇类耐药基因floR以及硫酸粘杆菌素耐药基因mcr-1等进行PCR扩增(引物详情见表2)和凝胶电泳分析,比较不同来源菌株耐药基因分布。
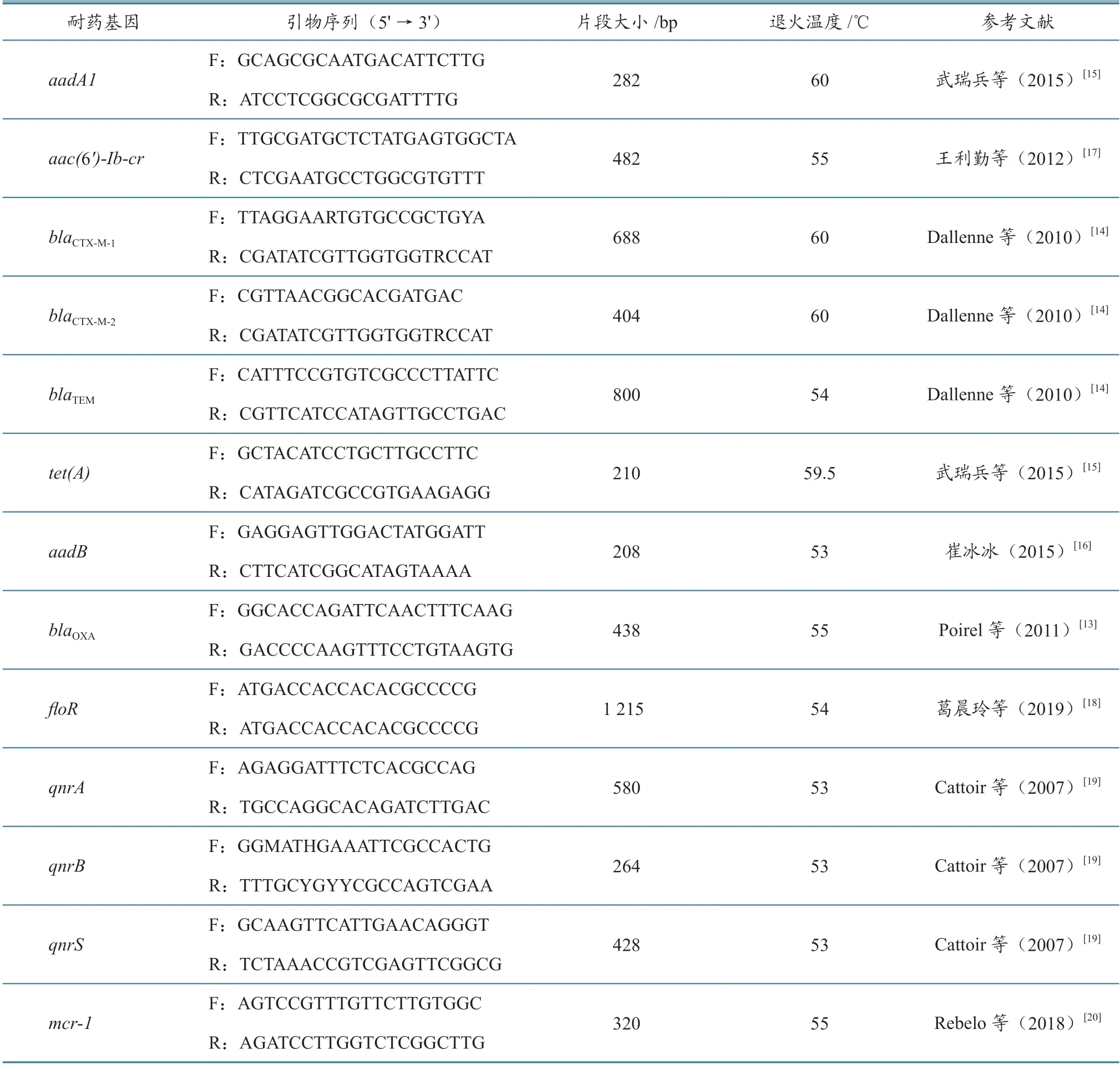
表2 耐药基因引物序列信息
1.2.5药敏试验 按照美国临床和实验室标准协会(CLSI)文件(M100-S21)推荐的微量肉汤稀释法,对分离得到的Kp采用9类12种抗菌药物进行药敏试验,药物均购自Oxoid公司。12种药物分别是,庆大霉素(GEN)、阿米卡星(AMK)、美罗培南(MEM)、阿莫西林/克拉维酸钾(AMC)、头孢噻肟(CTX)、头孢吡肟(FEP)、头孢西丁(FOX)、环丙沙星(CIP)、氯霉素(CHL)、硫酸粘杆菌素(COL)、四环素(TET)、磷霉素(FOS)。根据CLSI标准判断其耐药性。同时,比较分析不同地区Kp耐药情况。
2 结果与分析
2.1 细菌形态观察
分离纯化后,在MAC琼脂平板上呈现粉红色、中央凸起、表面光滑、大小一致的黏液状菌落(图1-A);用接种环蘸取菌落,随后向上提起,部分菌落拉动成丝;挑取单个菌落进行革兰氏染色,镜检观察可见单个、成双或链状排列的短粗状革兰氏阴性菌(图1-B)。

图1 MAC琼脂平板上的红色菌落及革兰氏染色镜检结果(100×)
2.2 16S rRNA扩增
PCR产物经1.2%琼脂糖凝胶电泳,部分产物扩增出大小约1 540 bp的片段(图2),与预期目的片段大小相同。取16S rRNA PCR产物测序分析,将此基因序列与NCBI GenBank中已有序列进行BLAST比对,发现同源性在99%以上。
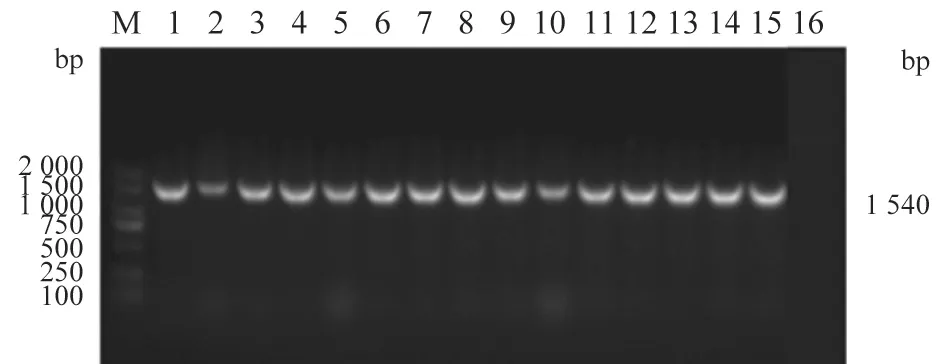
图2 分离菌株16S rRNA PCR扩增电泳图
2.3 khe 基因扩增
部分菌株khe基因扩增结果见图3。由图3可知,扩增条带约489 bp,与预期目的条带大小一致。

图3 khe 基因扩增电泳结果
2.4 各地区样品检测情况
经16S rRNA、khe基因扩增,从125份肛棉拭子样品、50份宰后生猪肉类样品中各分离得到32、4株Kp。按采样日期顺序命名为GDKP-1~36(GDKP-1~32分离自肛棉拭子样品,GDKP-33~36分离自猪肉样品)。
由表3可知,在肛棉拭子样品中,共检测出32株Kp,涵盖7个省份,分别为福建(4株,GDKP-6/GDKP-7/GDKP-30/GDKP-31)、广东(8株,GDKP-4/GDKP-5/GDKP-8/GDKP-9/GDKP-14/GDKP-21/GDKP-2 2/G D K P-2 3)、湖南(6株,GDKP-2/GDKP-3/GDKP-11/GDKP-12/GDKP-13/GDKP-20)、江 西(9株,GDKP-1/GDKP-10/GDKP-15/GDKP-18/GDKP-19/GDKP-24/GDKP-25/GDKP-26/GDKP-32)、吉 林(2株,GDKP-16/GDKP-17)、辽宁(1株,GDKP-29)、陕西(2株,GDKP27/GDKP-28);猪肉样品中,有3个省份检出4株Kp,分别为江西2株(GDKP-33/GDKP-34)、黑龙江1株(GDKP-35)、福建1株(GDKP-36)。
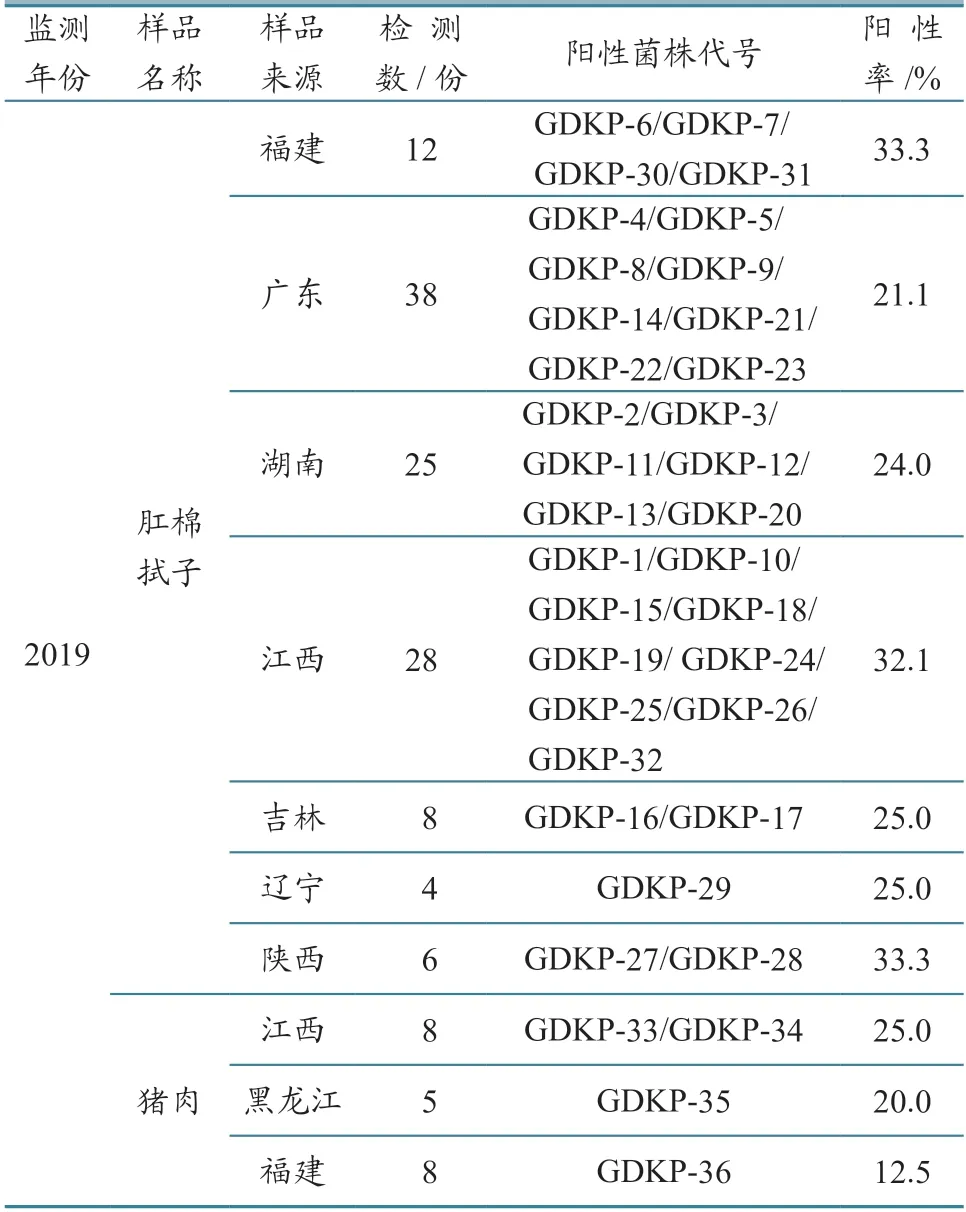
表3 各地区样品检测情况统计结果
2.5 耐药基因以及毒力基因扩增与分析
从耐药基因扩增结果(表4)来看,36株Kp含耐药基因比例从大到小依次为tet(A)(83.3%)、floR(63.9%)、mcr-1(27.8%)、aadA1(11.1%)、blaTEM、blaOXA和qnrB(均为8.3%)、aac(6')-Ib-cr(5.6%)、blaCTX-M-1(2.8%),其他耐药基因无检出;从毒力基因检测结果(表4)来看,比例从大到小依次为wabG(72.2%)、fimH和uge(均为69.4%)、kfu(63.9%)、aereobactin(19.4%)。耐药基因中,同时携带floR+tet(A)的菌株最多,达23株(占63.9%);毒力基因中,同时携带kfu+fimH+uge+wabG的菌株最多,达20株(占55.6%)。详细基因型分布见表4和图4。

表4 不同地区肺炎克雷伯氏菌株耐药基因和毒力基因分布

图4 36株肺炎克雷伯氏菌耐药基因和毒力基因分布
2.6 药敏试验
2.6.1耐药性分析 对分离到的36株Kp进行药敏试验,结果见表5。由表5可知,36株Kp对各种抗生素的耐药率介于0~83.3%。其中对TET耐药率最高,为83.3%;对其他抗菌药物的耐药率依次是CHL(63.9%)>COL(27.8%)>GEN(11.1%)>FOX/CIP(8.3%)>AMC(5.6%)>CTX(2.8%)。分离株对AMK、MEM、FEP、FOS的耐药率均为0,敏感性相当高。从抗生素大类来看,耐药率依次是四环素类(83.3%)>酰胺醇类(63.9%)>多肽类(27.8%)>喹诺酮类(8.3%)>氨基糖苷类(0~11.1%)>β-内酰胺类(0~8.3%)>碳青霉烯类和其他(0)。

表5 分离株耐药数据分析结果
2.6.2耐药性区域分布 不同地区Kp耐药性结果(表6)显 示:36株Kp中有6株耐受4种抗生素,耐药谱和菌株来源分别为GDKP-6/GDKP-7(FOX+CHL+COL+TET)来源于福建,GDKP-9(AMC+CIP+CHL+TET)和GDKP-23(AMC+FOX+CHL+TET)来源于广东,GDKP-11(GEN+CIP+CHL+TET)和GDKP-13(CTX+CIP+CHL+TET)来源于湖南;有6株耐受3种抗生素,耐药谱和菌株来源分别为GDKP-8(GEN+CHL+TET)来 源于广东,GDKP-24(GEN+CHL+TET)和GDKP-18/GDKP-19/GDKP-26(CHL+COL+TET)来源于江西,GDKP-29(CHL+COL+TET)来源于辽宁;有13株耐受2种抗生素,耐药谱和菌株来源分别为CHL+TET(江西5株:GDKP-1/GDKP-10/GDKP-15/GDKP-25/GDKP-33;湖南2株:GDKP-2/GDKP-3;广东2株:GDKP-4/GDKP-22;福建1株:GDKP-31;黑龙江1株:GDKP-35)、GEN+TET(陕西1株:GDKP-28)、COL+TET(江西1株:GDKP-32);有8株耐受1种抗生素,耐药谱和来源分别为TET(广东2株:GDKP-5/GDKP-21;陕西1株:GDKP-27;福建1株:GDKP-30;江西1株:GDKP-34)、COL(广东1株:GDKP-14;湖南1株:GDKP-20;福建1株:GDKP-36);有3株不耐受药物,分别为湖南1株(GDKP-12)、吉林2株(GDKP-16/GDKP-17)。

表6 不同地区Kp耐药情况分布 单位:株
3 讨论
Kp是医院获得性感染及社区获得性感染中常见的条件致病菌,在由革兰氏阴性菌引起的血流感染中,其分离率仅次于大肠埃希菌[21]。近年来,Kp已成为最重要的条件致病菌之一,并且耐药性逐渐增强[22]。长期以来,人医临床领域对该菌高度重视,但是动物源Kp并未受到广泛关注,关于猪源Kp的报道较少。本试验从某屠宰场待宰生猪125份肛拭子样品和50份宰后猪肉样品中共分离得到36株Kp,检出率为20.57%(36/175),检出率较高。杜琳等[23]对我国部分地区奶牛乳房炎进行分离鉴定,从497份样本中分离得到46株Kp,分离率为9.26%;张聪等[24]对南宁市伴侣动物源Kp检测结果显示,犬、猫的分离率分别为5.26%(3/57)、2.44%(1/41)。杨帆等[25]对医源与动物源Kp耐药性分析发现:医源菌株耐药率显著高于动物源菌株;在动物源菌株中,鸡源和猪源菌株耐药率高于兔源和犬源菌株;除犬源菌株外均表现多重耐药。综上,不同动物源Kp检出率以猪较高,这可能与我国生猪养殖规模大、数量多,生产过程常使用抗生素来促进生长和预防疾病有关,而牛和犬接触抗生素的概率相对较少,所以牛源、犬源菌株耐药率较低。
药敏试验结果显示,36株Kp对AMK、MEM、FEP和FOS耐药率均为0,表明分离菌株对这4种药物非常敏感。分离菌株对TET、CHL耐药率(分别为83.3%和63.9%)较高,对头孢菌素类、青霉素类、氨基糖苷类和喹诺酮类等受试药物耐药性并不严重,导致这一结果的原因可能与养殖期间生猪用药状态有关。在使用抗生素时,一些新合成的、价格昂贵的药物,很少在动物中使用,故对其产生的耐药性较低,如MEM、FEP、FOS等药物在动物中使用可能较少。
多黏菌素被认为是治疗耐碳青霉烯Kp感染联合抗菌疗法的主要抗生素。一些菌株通过脂多糖修饰多黏菌素耐药性,并且这些耐多黏菌素分离株的分离频率逐渐增加[26]。耐药基因检测结果显示,硫酸粘杆菌素耐药基因mcr-1检出率为27.8%(10/36),与张聪等[24]报道的mcr-1检出率呈上升趋势结论一致。超广谱β-内酰胺酶(extendedspectrum β-lactamase,ESBL)是目前已知的细菌对β-内酰胺类抗菌药物耐药的主要机制[26],本试验中β-内酰胺类耐药基因blaTEM、blaCTX-M-1、blaOXA检出率分别为8.3%、2.8%、8.3%,与细菌耐药表型一致。
毒力基因检测结果发现,参与脂多糖合成的毒力因子wabG携带率(72.2%)最高,其次另一个与脂多糖合成相关的毒力基因uge携带率(69.4%)也超过60%,表明分离菌株携带脂多糖相关毒力因子概率较高。脂多糖通过补体介导所形成的连锁反应,在菌体表面聚集成复合物,从而介导细菌逃避或抵抗宿主天然免疫的杀伤[9]。黏附素是细菌传播定殖的关键因素,检测结果显示黏附素相关毒力因子fimH和kfu携带率(分别为69.4%和63.9%)均超过60%,并且4株来源于宰后猪肉的分离株均携带fimH和kfu,表明携带黏附素毒力因子更易造成细菌传播。
有研究[27]显示,不合理使用抗生素会促进耐药基因传播。虽然屠宰场能有效降低出场猪肉细菌携带率,但不能完全阻断耐药基因传播。因此,科学选择抗生素,交替使用不同类型抗菌药物,避免耐药性产生对于阻止细菌耐药性扩散极为重要。此外,屠宰场应加强屠宰加工环节管理,严格执行加工过程中各项规章制度并规范操作,提高工作人员自身素质和安全卫生意识,降低细菌交叉污染的可能性,确保猪肉品质安全以降低细菌病发生,从而减少经济损失。
本研究共分离到36株Kp,分离菌株对头孢菌素类、碳青霉烯类、氨基糖苷类和喹诺酮类等受试药物表现敏感,而对四环素类、酰氨醇类和多肽类等药物耐药性较高,尤其以TET和CHL较为严重。共检测出9种耐药基因:tet(A)、floR、mcr-1、aadA1、blaTEM、blaCTX-M-1、blaOXA、qnrB和aac(6')-Ib-cr;检测出5种毒力基因:wabG、fimH、uge、kfu和aereobactin。本研究表明,应交替使用不同类型抗菌药物,最大程度避免细菌耐药性产生。同时,屠宰场应加强管理,提高安全卫生意识,降低细菌交叉污染,保障猪肉品质卫生。

