加味当归贝母苦参丸对CNP大鼠前列腺组织形态学的影响
★ 郑军状 董静波 陈湛 张尧 裘磊 陈伟伟(慈溪市中医医院 浙江 慈溪 315300)
慢性非细菌性前列腺炎(chronic nonbacterial prostatitis,CNP)是泌尿男科的常见病、多发病,好发于青壮年男性,临床上具有病程长、迁延反复、症状繁多等特点,容易引起一系列复杂的症候群,主要包括下尿路症状和盆腔区域疼痛症状,甚至出现精神抑郁及性功能障碍等症状,给患者造成极大的身心损害,约有50 %以上合并有不同程度的失眠、焦虑、紧张等精神神经症状,甚至有1 %~3 %的患者出现自杀倾向[1]。尤其是对久治不愈者,疼痛并伴随精神神经症状往往大大超过前列腺炎本身的影响,两者互为因果,形成恶性循环,致使临床治疗难以获效。随着现代医学模式从生物医学模式向社会-心理-生物医学模式的转变,社会心理因素成为重要的致病因素已被人们所认识。CNP并非单纯由前列腺本身炎症所造成,而是与精神因素和盆底肌肉痉挛有关。情绪紧张、抑郁是CNP发生、发展及迁延不愈的一个潜在重要因素[2]。随着生活节奏的加快,社会竞争的加剧,慢性前列腺炎的发病率将呈上升趋势,尤其是在沿海经济较发达的地区如浙江,广东等省。在目前对CNP尚缺乏理想的临床药物治疗时,充分发挥中药资源丰富、作用靶点多等特点,努力探索中医药治疗慢性前列腺炎显得十分迫切和可行。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级雄性SD大鼠60只,2月龄,体重(240±20)g,委托浙江中医大学实验动物中心采购并饲养,动物许可证号:SCXK(沪)2018-0008。室温控制在21 ℃~25 ℃,相对湿度为40 %~70 %,12 h光暗循环,啮齿类动物标准颗粒饲料(由动物中心提供),自由饮水、饮食,定期清洁和消毒。
1.1.2 实验药物 加味当归贝母苦参丸:当归10 g,苦参10 g,浙贝母20 g,虎杖20 g,败酱草10 g,台乌药15 g,三七粉3 g等中药组成,均购自浙江中医药大学滨江门诊部,先将生药经蒸馏水浸泡2 h,按常法煎煮2次,每次60 min,取汁,过滤,两次滤液合并混匀,用4层纱布过滤3遍后浓缩药液,将以上诸药浓缩至含生药量3.2 g/mL药液(相当于临床用药剂量的6倍),灭菌后置4 ℃冰箱保存备用,低、中、高剂量分别含生药为0.8 g/mL、1.6 g/mL、3.2 g/mL配制。B:前列倍喜胶囊,前列倍喜胶囊(由猪鬃草、王不留行、皂角刺、刺猬皮、蝼蛄等组成)。前列倍喜胶囊由贵州太和制药有限公司提供,规格:0.4 g/粒,国药准字:Z20025028,生产批号:20060203。药物按人大鼠等效剂量换算:前列倍喜胶囊组剂量为:1.13 g生药/mL。批号:161153。
1.1.3 实验试剂 0.9 %生理盐水(山东齐都药业有限公司,批号:2A16010901);百白破疫苗(碧云天生物技术有限公司);弗氏完全佐剂(sigma公司);其他试剂均为国产分析纯。
1.1.4 实验仪器 光学显微镜(日本Olympus optical Ltd);超薄切片机(瑞典Reichert-Jung公司);酶标仪(奥地利TECAN公司);台式高速冷冻离心机(ST16R,Thermo Fisher);Leica HI120型摊片机(德国Leica公司)。
1.2 方法
1.2.1 动物分组 将60只雄性SD大鼠随机分为6组(随机数字表法),每组10只,即空白对照组、模型组(CNP模型组)、加味当归贝母苦参丸组(低剂量组、中剂量组、高剂量组)及前列倍喜胶囊组(对照组)。
1.2.2 动物模型建立 大鼠适应性饲养一周,观察无异常后造模。按相关文献[3]及课题前期基础建立CNP大鼠模型。采取腹腔注射10 %水合氯醛麻醉大鼠后,用1 ‰新洁尔灭消毒下腹部皮毛,对照组除外,其他各组均采用下述方法造模:大鼠乙醚麻醉,腹腔注射百白破疫苗0.5 mL,多点皮内注射大鼠前列腺蛋白提纯液和FCA乳剂(比例为1∶1的混悬液)1.0 mL。前列腺蛋白浓度为15 g/L。正常对照组分别行腹腔注射0 9 %生理盐水0.5 mL,多点皮内注射0 9 %生理盐水注射液1.0 mL,以上各组均分别于0 d、30 d分两次注射。30 d后即可形成CNP模型。病理变化为腺体内炎症细胞浸润,分泌物减少,腺腔梗阻、缩小,间质纤维化。
1.2.3 给药方法及样本处理 造模后普通饲养,30 d后给药。术后观察一周,伤口愈合后开始灌胃给药。正常空白组和模型组均予生理盐水,按1 mL/100 g体重,给药方法均采用灌胃法,加味当归贝母苦参丸各组给予水煎剂,按1 mL/100 g(8 g/kg、16 g/kg、32 g/kg)灌胃,阳性对照组给予前列倍喜胶囊混悬液,按1 mL/100 g(11.3 g/kg)灌胃,均1次/d,给药时间为4周。给药结束后,禁食不禁水12 h,麻醉后快速取出前列腺组织待测,脱颈处死各组大鼠。
1.2.4 大鼠前列腺组织形态学观察 前列腺组织形态学观察,前列腺湿重测定:用电子天平称前列腺湿重,前列腺炎症等级,前列腺指数;前列腺组织HE染色:前列腺腺体管腔、腺体分泌物、前列腺间质炎细胞浸润和纤维组织增生等。病理组织病变分级标准参照《药理实验方法学》制定[4],按半定量方法进行判定病变程度。0级基本正常;1级小部分病变;2级部分病变;3级大部分病变;4级全部病变。
1.2.5 大鼠前列腺组织超微结构观察 前列腺组织超微结构观察,取1 mm×1 mm大小的前列腺组织于戊二醛溶液中4 ℃固定过夜,用1 %的锇酸溶液固定样品1~2 h,用梯度浓度进行脱水处理,最后过渡到纯丙酮处理20 min,包埋,超薄切片机中切片,用柠檬酸铅溶液和醋酸双氧铀染色,透射电镜下观察。
1.3 统计学分析
采用软件SPSS 20.0 进行统计分析,数据以表示,计量资料,组间比较采用单因素方差分析(One-WayANOVA)。多重比较采用LSD 检验,等级资料,采用Mann-Whitney U秩和检验,以P≤0.05为差异有统计学意义。
2 结果
2.1 实验动物数量、体重及前列腺湿重的分析在实验过程中,空白组及造模后大鼠均全部存活,无死亡情况。对照组、高中低三组大鼠体重和正常大鼠的体重与模型组比较,差异无显著性(P>0.05),治疗各组大鼠前列腺炎湿重和湿重/体重比均小于空白对照组大鼠(P<0.05)。中、高剂量组前列腺湿重和湿重/体重与模型组比较,差异有显著性(P<0.05)。前列贝喜组前列腺湿重和湿重/体重与模型组比较,差异无显著性(P>0.05)。

表1 加味当归贝母苦参丸对各组大鼠体重及前列腺湿重的影响( ,n=10)
2.2 加味当归贝母苦参丸对CNP模型大鼠前列腺组织形态的影响肉眼观察:空白组:前列腺组织与周围未见明显粘连,色泽淡红、表面光滑、质地软;模型组及其他各组前列腺组织均出现腺体肿胀、质地变化及色泽变暗,一定程度与相邻组织粘连。模型组与周围组织粘连较重,粘连不易分开,腺体肿胀明显,质硬,色泽灰白或暗红,可见一些结节样改变;低剂量组大鼠前列腺周围可见轻度粘连,前列腺肿胀,质偏硬,色无光泽暗红;中剂量组大鼠前列腺组织与周围未见明显粘连,前列腺稍肿胀,质稍偏硬,可显暗红色;高剂量组大鼠前列腺组织与周围无粘连,前列腺无肿胀,质软,色泽略显暗红;前列倍喜组前列腺周围未见明显粘连,前列腺稍肿胀,质稍偏硬,色泽稍显暗红。HE染色病理改变:空白对照组大鼠前列腺组织结构均匀,腺体排列及分布正常,腺上皮为单层立方上皮,腺腔内有较丰富的粉染蛋白性液体,间质内未见明显炎症细胞浸润及水肿,腺泡间纤维及平滑肌分布正常;模型组大鼠前列腺腺体减少,腺泡变小,腺泡上皮萎缩呈低立方或扁平状,部分基底膜被破坏,间质水肿和纤维组织增生明显,大量炎性细胞浸润,多为淋巴细胞及单核细胞;炎症显著。治疗组大鼠前列腺大部分腺泡正常,可见皱襞形成,腺泡腔内有不同程度的分泌物,少数腺泡轻度扩张,未见明显炎性细胞浸润及炎性增生;前列贝喜组大鼠前列腺上皮呈立方或柱状,腺泡有不同程度的扩张,间质可见轻度水肿,纤维组织增生较为明显,有新生小血管,个别切片可见到较多淋巴细胞浸润,见表1和图1。

图1 加味当归贝母苦参丸对大鼠前列腺组织炎症的影响(HE×100)
2.3 加味当归贝母苦参丸对CNP模型大鼠前列腺超微结构影响空白对照组大鼠前列腺上皮细胞核形规则,细胞核仁明显,胞质丰富,细胞器完整,线粒体形态小,数量少,内质网丰富,细胞表面微绒毛覆被,细胞之间连接完好;模型组大鼠前列腺上皮细胞细胞核明显增大,形态欠规则,有切迹较多,核仁欠明显,线粒体肿胀,线粒体嵴变短,排列较为紊乱,部分出现空泡变性,粗面内质网重度扩张,溶酶体明显增多,腺腔内有金属样分泌颗粒,胶原纤维明显增生,这些病理表现与正常对照组间存在着明显差异;治疗各组大鼠前列腺上皮细胞核形规则,核内染色质排列均匀,线粒体数目正常,粗面内质网轻度扩张,核糖体完好,胞表面微绒毛较多,细胞间连接复合体正常,炎性细胞浸润及纤维结缔组织增生较模型组轻,高剂量组改善更明显;前列倍喜组大鼠前列腺上皮细胞核形较规则,部分核仁较小,核内染色质均匀,但核间隙略增宽,部分核与核膜分离,线粒体轻度肿胀,部分形成髓鞘样小体,粗面内质网中度扩张,胞膜表面微绒毛有断裂及脱落,间质中纤维组织较多,有淋巴细胞浸润,可见肥大细胞。(见图2)。
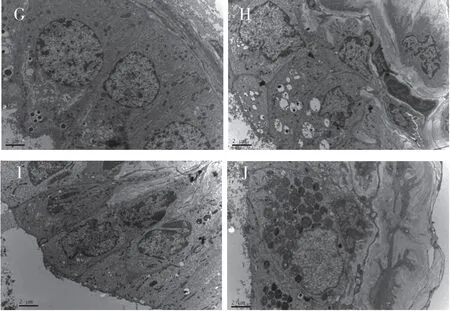
G正常组 H模型组 I治疗组 J前列贝喜组
3 讨论
慢性非细菌性前列腺炎(chronic nonbacterial prostatitis,CNP)是以慢性盆腔疼痛及排尿异常为主,伴有或不伴有性功能障碍、精神神经症状的一类综合征。约有50%的男性在其一生的某个阶段会受其影响,并已经成为50岁以下男性就诊于泌尿(男)科的首要原因[5]。对患者生活质量的影响近似于近期心肌梗死、不稳定性心绞痛、活动性克隆病对患者的影响[6]。关于CNP的病因和发病机制,既往多认为是由未知的病原微生物所引起的感染性炎症,然而Lee等[7]2003年的一项研究并不支持感染致病的观点,国内也有研究认为前列腺组织中病原体的检出与CNP症状无病因学相关[8]。因此,近年来普遍认为,本病可能是不涉及病原微生物的非感染性炎症,包括物理因素造成的前列腺慢性长期充血、尿液返流引起的化学性炎症、氧化应激作用增强、自身免疫异常和细胞因子失调等因素,导致了前列腺组织瘀血、缺氧、水肿、变性、纤维化等慢性炎症改变。其中,包括细胞因子在内的多种炎性因子失调导致CNP发病的学说,越来越被研究者重视,是近年研究的热点。
当归贝母苦参丸即是慢性前列腺炎中医药古方挖掘研究中较为有前景的方剂之一,当归贝母苦参丸方出自《金匾要略》,经方原文为:“妊娠,小便难,饮食如故,当归贝母苦参丸主之。当归贝母苦参丸方:当归、贝母、苦参各四两,男子加滑石半两。上三味,末之,炼蜜丸如小豆大,饮服三丸,加至十丸”。其中,当归活血润燥;浙贝母清热散结,且能开宣肺气,寓提壶揭盖之意;苦参利湿热,除热结,与浙贝母合用,又能清肺而散膀胱瘀热。加味当归贝母苦参丸,在此基础上加虎杖、败酱草清下焦湿热、台乌药行气止痛,三七粉活血化瘀,通络止痛。合而用之,契合CNP气机不畅,湿热瘀阻的特点,使湿热去、血脉通、瘀结散。
当归贝母苦参丸为临床广泛应用,在CBP大鼠实验研究发现,当归贝母苦参煎剂能显著降低CBP大鼠全血粘度;对于CBP模型大鼠的前列腺组织,当归贝母苦参煎剂可以显著升高其中的SOD含量和降低MDA含量;能显著下调其中ICAM-1的表达;能显著升高其中的IL-2含量和降低IL-8含量;能显著减少其中的炎症细胞因子TNF- a、IL-1β的产生,从而发会抗炎效应[9]。结合长期的临床观察,项目组发现加味当归贝母苦参丸在缩短患者病程、改善患者疼痛症状方面明显优于原方当归贝母苦参丸。基于中药整合药理计算机平台预测其机制,包括核心成分65个(当归29个、浙贝母11个、苦参26个,于转录因子结合、凋亡负性调控等关键靶标,通过激素、凋亡、趋化因子等信号通路,发挥细胞周期、细胞凋亡与增殖失衡调控等作用,这可能是其治疗前列腺疾病的相关分子机制[10]。
本研究模型大鼠前列腺组织从肉眼及HE病理改变明显,腺体结构破坏,炎症、水肿、炎细胞浸润等改变明显,超微结构亦发现上皮细胞细胞核明显增大,形状欠规则,核仁不明显,线粒体肿胀,排列无序,空泡化等改变。治疗组与对照组病理改变的程度较模型组轻。提示加味当归贝母苦参丸能改善模型大鼠前列腺炎症改变,保护其腺体超微结构。从现代药理分析其组方:当归含挥发油有和水溶成分如多糖、氨基酸、维生素、微量元素等,具有较好的改善造血、抗炎、抗氧化等作用[11-12]。三七具有人参皂苷Rg1和三七皂苷R1,具有抗氧化损伤、调节免疫因子与抗炎活性、改善微循环等作用。在各系统疾病治疗中广泛应用[13-14]。苦参含有生物碱、黄酮类、氨基酸类等,具有抗氧化、抗炎镇痛作用[15]。
败酱草主要成分包括黄酮类、三萜皂苷类、环烯醚萜类及挥发油等,具有抗菌、抗炎、抗病毒、抗氧化、镇痛等作用[16-18]。浙贝母:可明显减轻前列腺炎模型大鼠前列腺组织的病理表现,降低NO水平,通过调节免疫平衡,抑制异常免疫反应而达到治疗作用[19]。虎杖主要含蒽醌类,包括大黄素、大黄素甲醚,二苯乙烯类,如白藜芦醇、白藜芦醇苷等。具有抗病毒、抗菌、改善微循环、抗血栓、抗氧化、抗炎镇痛等作用,被应用于前列腺炎的临床治疗[20]。
上述实验结果表明,CNP模型大鼠前列腺组织炎症明显,加味当归贝母苦参丸能不同程度减轻CNP大鼠前列腺组织炎症程度,其治疗CNP的相关作用分子机制有待进一步深入研究。

