监测ICU患者利奈唑胺血药浓度指导临床用药
★ 唐祯 刘燕华 徐兰 陈集志(.中国人民解放军联勤保障部队第九〇八医院 南昌33000;.江西中医药大学 南昌 330004)
利奈唑胺是一种新型人工合成的噻唑烷酮类抗生素,其抗菌作用机理是抑制细菌蛋白质的合成,主要用于治疗革兰阳性球菌引起的感染,已批准用于治疗万古霉素耐药的屎肠球菌引起的感染、由MRSA引起的疑似或确诊院内获得性肺炎、社区获得性肺炎、复杂性或非复杂性皮肤和皮肤软组织感染[1]。一般情况下正常使用常规剂量利奈唑胺无需监测血药浓度,但有些ICU重症感染患者因其病理生理条件下水肿、胸腔积液、腹水、烧伤等多种因素可影响药物在体内的分布和排泄,可能造成药物分布容积增大或肾脏清除改变等[2],而且随着利奈唑胺在临床上的大量使用,其耐药问题也逐渐出现。因此,对于以上重症感染患者应当进行利奈唑胺药物浓度监测,以减少耐药菌株和不良反应的产生,从而提高临床药物治疗成功率。本研究参考相关文献[1-5],通过调整优化血样处理方法和色谱条件,建立了一种快速、简便、准确度高、重现性好的HPLC法测定利奈唑胺血药浓度,为临床合理安全用药提供一定的参考。
1 仪器与试药
1.1 仪器LC-20AHT型高效液相色谱仪(日本岛津公司);Milli-Advantage A10超纯水装置(美国密理博公司);SB-5200D型超声波清洗机 (宁波新艺超声设备有限公司);TGL-16C型高速离心机(上海安亭科学仪器厂);AEU-220型电子分析天平 (日本岛津);XW-80型旋涡混合器(上海楚定分析仪器有限公司)。
1.2 试剂利奈唑胺注射液标准品(美国辉瑞公司,批号:17E31U49,规格:600 mg/300 mL);奥卡西平对照品(中国食品药品检定研究院,批号:100657-201702,含量99.8 %);灭菌注射用水(安徽双鹤药业有限公司,批号:18081707A,规格:500ml);乙腈、甲醇均为色谱纯,水为纯化水,其他试剂均为分析纯。
2 方法与结果
2.1 色谱条件色谱柱为VP-ODS C18(250 mm×4.6 mm,5 μm);流动相为乙腈∶水(20∶80);流速:1.0 mL·min-1;检测波长:254 nm;柱温:30 ℃;进样量:20 μL。
2.2 对照品溶液的配制利奈唑胺对照品储备液的配制:精密量取利奈唑胺注射液1 mL,置25 mL量瓶中,加注射用水溶解并定容至刻度,摇匀,配得利奈唑胺浓度的储备液(浓度为80 μg·mL-1),置4 ℃冰箱备用。
奥卡西平对照品储备液的配制:精密称取0.021 9 g奥卡西平对照品,置于25 mL量瓶中,加适量甲醇溶解并定容至刻度,摇匀,配得奥卡西平储备液(浓度:0.876 mg·mL-1)。精密量取2 mL,置25 mL量瓶中,加甲醇稀释至刻度,摇匀,即得奥卡西平对照品溶液(浓度:70.08 μg·mL-1),置4 ℃冰箱备用。
2.3 样品处理精密量取空白血浆200 μL,加入奥卡西平内标溶液20 μL,加入乙腈溶液200 μL,涡旋振荡2 min,转速15 000 r·min-1,离心10 min,取上清液,经微孔滤膜滤过后,待检测分析。
2.4 专属性试验在上述下色谱条件下测定,利奈唑胺和奥卡西平色谱峰形较好。利奈唑胺的洗脱时间:8.5 min,奥卡西平的洗脱时间:22.5 min。空白血清、空白血浆+利奈唑胺+奥卡西平、患者血样+奥卡西平中利奈唑胺和奥卡西平的色谱图见图1,可见血清中内源性杂质不会干扰利奈唑胺和奥卡西平,分离度大于1.5,且基线平稳。

图1 HPLC色谱图
2.5 标准曲线的绘制精密量取空白血清180 μL,加入利奈唑胺系列对照品溶液及内标溶液各20 μL,使利奈唑胺浓度分别是0.50、2.50、5.00、10.00、15.38、20.00、30.77、40.00 μg·mL-1,按“样品处理”项下方法进样分析,记录色谱图。以利奈唑胺浓度(X,μg·mL-1)为横坐标,利奈唑胺与内标峰面积比值(Y)为纵坐标,建立标准曲线,得回归方程:Y=0.323X+0.108(相关系数r=0.999 8),利奈唑胺血药浓度的线性范围:0.50~40.00 μg·mL-1。
2.6 精密度试验精密量取空白血清180 μL若干份,配制得到低、中、高3个浓度(2.50、10.00、30.77 μg·mL-1)的利奈唑胺对照品血清样品,每个浓度样品各平行5份,按“样品处理”项下方法操作,于同日内测定5次及连续3日每日测定1次,计算日内及日间精密度,结果见表1。
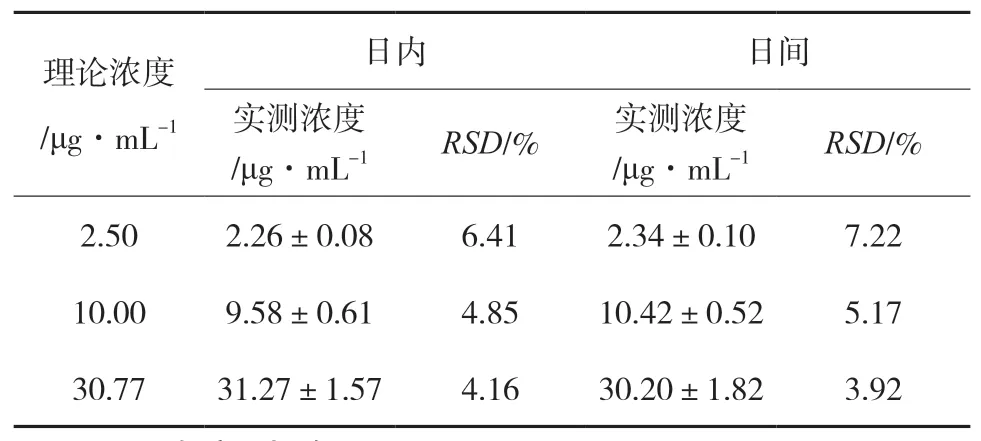
表1 精密度试验结果( ,n=5)
2.7 回收率试验
2.7.1 方法回收率 精密量取空白血清180 μL,分别配制低、中、高3个浓度(2.50、10.00、30.77 μg·mL-1)的利奈唑胺对照品血清样品,每个浓度平行5份,按“样品处理”项下方法进样检测,以利奈唑胺与内标峰面积比值代入标准曲线方程计算利奈唑胺的血药浓度,以实测值与加入量比较计算方法回收率,结果见表2。
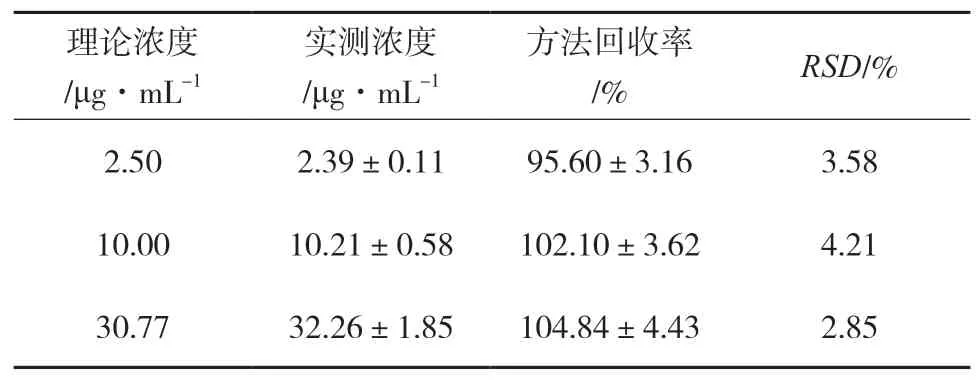
表2 方法回收率试验结果( ,n=5)
2.7.2 绝对回收率 精密量取空白血清180 μL若干份,分别配制得到低、中、高3个浓度(2.50、10.00、30.77 μg·mL-1)的利奈唑胺对照品血清样品及水溶液,以及分别配制得到低、中、高3个浓度(7.01、17.52、35.04 μg·mL-1)的奥卡西平对照品血清样品及水溶液,每个浓度样品各平行5份,按“样品处理”项下方法操作,检测并记录峰面积分别为A1、A2。绝对回收率=(血清样品峰面积/水溶液样品峰面积)×100 %=(A1/A2)×100 %,高、中、低浓度下利奈唑胺的提取回收率分别为68.21 %、70.92 %、72.87 %,RSD分别为3.41 %、4.25 %、3.08 %;奥卡西平的提取回收率分别为90.24 %、88.67 %、91.34 %,RSD分别为3.82 %、3.56 %、4.28 %。
2.8 稳定性试验精密量取空白血清180 μL若干份,制得到低、中、高3个浓度(2.50、10.00、30.77 μg·mL-1)的利奈唑胺对照品血清样品,每个浓度样品平行3份,按“样品处理”项下方法操作,在室温放置0,2,4,8,12,24 h测定,高、中、低浓度利奈唑胺的RSD分别为1.88 %、3.54 %、6.59 %;同法配制高、中、低浓度为30.77、10.00、2.50 μg·mL-1的利奈唑胺对照品血清样品各5份,置于-20 ℃冰箱中,反复冻融3次,分别测定,高、中、低浓度利奈唑胺的RSD分别为1.88 %、2.55 %、4.23 %。结果表明,样品可耐受3次冻融,提取后的血清样品在室温下24 h稳定。
3 临床应用
3.1 血样采集对2019年上半年本院16例临床诊断为革兰阳性菌感染或疑似革兰阳性菌感染或经药敏试验及细菌培养提示革兰阳性菌感染的ICU重症患者的49例血样采用本文方法进行利奈唑胺血药浓度监测,给药方案:成人每12 h 600 mg静脉滴注。其中女性7例,男性13例,年龄34~89岁(平均56岁),在用药48~72 h血药浓度达稳态后,经外周静脉于利奈唑胺静滴前30 min采血。采用建立的HPLC法检测ICU重症感染患者的利奈唑胺谷浓度。
3.2 血药浓度监测利奈唑胺为时间依赖性抗生素,与临床治疗疗效相关的药动学参数包括血药浓度高于最低抑菌浓度(MIC)的时间百分比,如果利奈唑胺血药浓度在整个给药间期均维持在MIC之上,则可提高临床治疗成功率;利奈唑胺对金黄色葡萄球菌和肠球菌的MIC50为2 μg·mL-1[3]。临床治疗结果评定标准为治疗有效:感染症状有改进或缓解;临床治疗无效:感染症状持续存在和/或新症状出现。
16例患者谷浓度,有2例患者血清谷浓度低于MIC,其他14例均高于MIC,但有1例患者谷浓度平均值为37.54 μg·mL-1,远远高于其他患者,有2例患者临床结果评定为临床无效。结果见表3。根据监测结果,临床医师根据患者感染控制情况及临床症状,对利奈唑胺血药浓度低于MIC的患者给予利奈唑胺剂量进行了适当调整。通过利奈唑胺血药浓度监测而制定个体化给药方案,16例ICU重症患者最终临床治疗结果均显示为治疗有效。

表3 重症感染患者血清中利奈唑胺浓度监测结果

(续表)
4 讨论
4.1 流动相的选择参考相关文献[1-5],本试验比较了甲醇-水和乙腈-水这类简单的流动相系统,两者色谱峰形均较好,无拖尾现象,但采用后者,其色谱图峰型对称性更佳,柱效更高。因此采用乙腈-水作为流动相,不加入缓冲盐,可缩短色谱平衡时间。血样经处理后可以达到分离效果满意,内标物奥卡西平和利奈唑胺不受血浆中内源性杂质的干扰,峰分离完全。乙腈比例对万古霉素和内标出峰时间和峰型影响较大,将乙腈与水的比例调整为20∶80时,内源性杂质不干扰利奈唑胺和内标,保留时间和峰宽均适宜,理论塔板数大于3 000,样品可在25 min内快速测定,提高效率。
4.2 样品处理方法的选择在选择乙腈作为蛋白沉淀剂的基础上,本试验还比较了甲醇、10 %高氯酸等几种蛋白沉淀剂对于血浆样品分离效果的影响,发现经甲醇和乙腈处理的样品,利奈唑胺和内标峰形较好,杂峰较少,分离度高,但经乙腈处理后的样品,利奈唑胺和内标提取回收率高于甲醇。高氯酸呈强酸性,虽然用量较少,但会减少色谱柱使用寿命,使利奈唑胺的紫外吸收发生改变,且峰型较乙腈差。因此,考虑到流动相系统为乙腈-水,最终选择采用蛋白沉淀较为彻底且回收率较高的乙腈作为蛋白沉淀剂。
4.3 临床应用本研究分析了49例次的血药浓度分布情况,结果显示最小血药浓度为1.12 μg·mL-1,最大为52.77 μg·mL-1,利奈唑胺的体内过程存在较大的个体差异。有文献报道,利奈唑胺有效血药浓度范围为2~10 μg·mL-1,>10 μg·mL-1时易发生中毒[6]。3例次(6.12 %)小于MIC;8例次(20.51 %)超过10 μg·mL-1。有研究报道指出,利奈唑胺血药浓度升高与血小板减少存在密切的联系,若第3 d利奈唑胺谷浓度达到7.5 μg·mL-1则可提示发生血小板减少的风险增加。因此,从第3 d开始监测利奈唑胺的谷浓度具有重要的临床意义,尤其针对肾功能不全患者[7]。
第4例患者第一次监测利奈唑胺谷浓度值为0.5 μg·mL-1,第二次监测值为1.48 μg·mL-1,血培养提示金黄色葡萄球菌,利奈唑胺敏感,MIC 4 μg·mL-1,考虑患者出现反复发热可能与感染未控制有关,且该患者在进行连续性静脉-静脉血液滤过(CVVH),利奈唑胺会发生明显的清除,可降低约50 %。笔者参照利奈唑胺PK/PD模型,建议临床医师将给药方案调整为900 mg,每12 h持续静脉滴注,第三、四次监测谷浓度值为2.52 μg·mL-1、4.50 μg·mL-1,患者无发热,血象接近正常,血小板正常,血培养提示阴性,给予抗生素降阶梯治疗,患者最终临床治疗有效。第9例患者年龄85岁,该患者为85岁高龄,且存在肝、肾功能损伤。血培养检出表皮葡萄球菌,对万古霉素敏感,给予注射用万古霉素静脉滴注给药后,患者仍反复发热,感染未得到完全控制,笔者及主任医师会诊后建议使用利奈唑胺注射液600 mg,q12 h,静滴。监测利奈唑胺谷浓度值为1.12 μg·mL-1,低于MIC2 μg·mL-1,患者仍发热,最高体温39.3℃。笔者和主任医师商量后建议增加利奈唑胺注射液剂量为900 mg,q12 h,再次监测利奈唑胺谷浓度为5.69 μg·mL-1,患者未再发热,感染控制有效,且未对肝肾功能造成进一步损害。第15例患者第一、二次监测值为45.33 μg·mL-1、52.77 μg·mL-1,远高于其他患者,出现血小板明显下降,给予及时对症处理如口服利可君片,将之前的静脉滴注调整为口服利奈唑胺片,300 mg,1/12 h,再次连续两次监测利奈唑胺谷浓度值为9.74、8.55 μg·mL-1,患者感染症状得到控制,且血小板计数正常。
有文献报道29 %患者利奈唑胺谷浓度低于MIC,利奈唑胺对分离病原菌MIC为2 μg·mL-1的患者临床治愈率为57.6 %,MIC为4 μg·mL-1时为27 %[3]。一般认为利奈唑胺的细菌耐药的发生与使用时间成正比,且血药浓度略低于MIC更容易诱导靶位突变,动物实验证明用药后2~5 d即可发现耐药菌株[8]。因此,有学者提出利奈唑胺若增加给药频次或延长给药时间或提高剂量可能会更有优势[9]。一些研究者建议先给予300 mg负荷剂量后,继以1 200 mg/d持续滴注的给药方案可以获得较好的临床效果[7]。有研究表明,利奈唑胺总清除率由透析造成的透析清除率为(3.7±0.8)L/h以及药物清除量为211~266 mg,药物谷浓度明显低于健康志愿者及其他未进行血透患者,对这类特殊患者需紧密结合血药浓度监测结果,及时调整给药剂量以达到满意的治疗效果[10]。
5 结论
利奈唑胺具有非线性药代动力学特征,属时间依赖性抗菌药物,虽然药品说明书上推荐每12 h一次,每次600 mg的给药方案,但因机体外特殊治疗手段所增加的药物体外清除途径,加上由于机体内的病理生理特征改变,使药物在体内的吸收、分布、代谢、排泄过程变得更加复杂,存在着较大的个体差异;进而影响抗菌药物治疗的药效学达标情况,往往导致危重症患者抗菌药物治疗效果不佳或不良反应加重[11],所以并非所有的患者使用该方案均能达到理想的疗效。因此,需要以准确、快速的血药浓度监测为基础,结合抗菌药物的药动学和药效学,评估治疗方案的效果,同时密切监测药物可能发生的不良反应,通过监测危重症感染患者利奈唑胺血药浓度,制定个体化给药方案可最大限度地降低耐药菌株的出现,达到最佳的抗菌治疗效果,同时确保药物治疗的适当、安全、有效。本研究建立的HPLC法快速、样品稳定性良好、准确度高,可用于危重症患者治疗药物监测和个体化给药方案的制定。

