地龙蛋白胶囊对大鼠动静脉血栓生成的抑制作用
齐明明,孙建博
(中国药科大学中药学院,江苏南京 210009)
近年来,由血栓引起的栓塞性疾病严重影响着人们的生活,与其密切相关的心血管疾病已成为全世界范围内造成中老年人发病甚至死亡的主要原因[1,2]。在药物治疗手段中,u-PA和t-PA等抗栓药物具有较好的疗效并被广泛使用,但是有引起系统性出血的副作用[3,4],因此,从中药中寻找一种安全、有效、疗效稳定的抗栓药物对于治疗此类疾病具有重要的意义。
地龙性寒味咸,具有通经活络、活血化瘀、预防治疗心脑血管疾病作用[5]。活性地龙蛋白胶囊以从中药地龙中提取的活性蛋白为主要原料,壳聚糖及玉米淀粉为辅料。活性地龙蛋白(EWAP)含有纤溶酶、蚓激酶、胶原酶、核酸和微量元素在内等多种活性成分,是一种大分子复合酶[6,7]。EWAP能够抑制血小板聚集,促进组织型纤溶酶原激活物的分泌,以及水解凝血酶[8,9],具有改善微循环[10]、溶栓[11-13]、降压[14-15]及改善动脉粥样硬化[10,16]等多种药理作用。研究发现,EWAP在体外对兔静脉血栓有溶解作用,对已凝固的纤维蛋白胶板也有一定纤溶活性。其纤溶作用有直接纤维蛋白溶解和激活纤溶酶原的间接作用,但以直接纤溶为主[6]。地龙蛋白的药用价值及保健价值被逐渐开发,早在2009年被国家卫生部认定为 “ 新资源食品 ” (见中华人民共和国卫生部2009年第18号公告),其作为新资源食品可起到保健预防的作用。为探索活性地龙蛋白作为一种抗血栓食品的抑制血栓生成效应,本实验通过对小鼠的凝血、出血时间的测定,大鼠动、静脉血栓造模,以及对凝血四项的检测,验证了地龙胶囊在实验动物体内抗凝及抑制血栓生成的药理活性,为活性地龙蛋白的开发提供试验依据。
1 材料与方法
1.1 试药
活性地龙蛋白胶囊(批号:20190304),南京龙福新科技实业有限公司;阿司匹林肠溶片(批号:181003),沈阳奥吉娜药业有限公司;鞣花酸活化部分凝血活酶测定试剂盒、凝血酶原测定试剂盒、凝血酶测定试剂盒、纤维蛋白原测定试剂盒,山西亚森医疗器械有限公司;羧甲基纤维素钠,国药集团化学试剂有限公司;水合三氯乙醛,上海阿拉丁生化科技股份有限公司;通用型组织固定液,武汉塞维尔生物科技有限公司。
1.2 仪器与设备
分析天平,奥豪斯仪器有限公司;Steellex半自动血凝仪,北京中勤世帝生物技术有限公司;超低温冰箱,Thermo Fisher Scientific;高速冷冻离心机,Kubota Corporation;电冰箱,合肥美菱股份有限公司;电热鼓风干燥箱,上海博讯医疗器械厂;Leica DM2500正置荧光显微镜,徕卡显微系统有限公司。
1.3 实验动物
18~22 g ICR小鼠和180~220 g SD大鼠,SPF级,雌雄各半,大鼠购于斯贝福(北京)生物技术有限公司,实验动物合格证号:SCXK(京)2019-0010;小鼠购于浙江省医学科学院,实验动物合格证号:SCXK(浙)2019-0002。饲养于23±2 ℃,自由进食和饮水,分笼饲养,适应一周后开始试验。
1.4 分组及给药
活性地龙蛋白胶囊的剂量及配置:按照成人每天服用7粒,每粒含50 mg活性地龙蛋白,即人服用的剂量为5 mg/kgb·wt,将此剂量设为中等剂量,换算为大鼠的低、中、高剂量分别为:15.63 mg/kg、31.26 mg/kg和62.52 mg/kg(相邻剂量比为1:2);小鼠的低、中、高剂量分别为:22.50 mg/kg、45.00 mg/kg和90.00 mg/kg。空白对照组、假手术组、模型组均使用等剂量的0.5% CMC-Na溶液。阳性药物阿司匹林的剂量及配制:人服用的剂量为每天100 mg,即1.43 mg/kgb·wt,换算为大鼠的剂量为:9.00 mg/kg;小鼠的剂量为13.00 mg/kg。将各个浓度的活性地龙蛋白胶囊、阿司匹林分别溶于0.5%的CMC-Na溶液中,灌胃使用,现用现配。
1.5 对小鼠尾出血时间影响
采用断尾法研究活性地龙蛋白胶囊对小鼠尾出血时间的影响。将40只适应性喂养后的ICR小鼠随机分为5组,即空白对照组,阿司匹林阳性药组,地龙低剂量组,地龙中剂量组,地龙高剂量组,每组各8只。分组后,按照2.1的剂量每天给予小鼠灌胃给药(1 mL/100 g),连续7 d。末次给药后1 h,取小鼠于固定器中,使尾部与地面保持垂直,用锋利剪刀距离尾尖1.5 mm处剪断,并开始计时,用滤纸每隔一段时间轻触断口处,观察滤纸是否沾有血迹,直至滤纸无血迹出现,并记录时间,此时间即为尾出血时间。
1.6 对小鼠凝血时间的影响
采用毛细管法研究活性地龙蛋白胶囊对小鼠尾出血时间的影响。按照2.2方式分组后,每天给予灌胃给药(1 mL/100 g),连续7 d。末次给药后1h,用内径为1 mm长10 cm的玻璃毛细管(用前用砂轮在毛细管表面每5 mm做出划痕,方便折断)插入小鼠内眦球后静脉丛取血,血液快速流出为佳,自血液流入管内开始计时,每隔10 s折断毛细管,每次折断约5 mm,并缓慢向左右拉开,直至出现血凝丝停止计时,所得时间即为凝血时间。
1.7 对大鼠三氯化铁致颈动脉血栓形成的影响
将66只适应性喂养后的SD大鼠随机分为6组,即假手术组、模型组、阿司匹林阳性药组、地龙低剂量组、地龙中剂量组、地龙高剂量组,每组11只。分组后,按照2.1的剂量每天给予灌胃给药(1 mL/100 g),连续7 d。末次给药1 h后,每组取8只,使用10%水合氯醛麻醉,分离大鼠两侧颈总动脉,血管下置小片塑料薄膜(4 cm×1.8 cm)用于保护血管周围组织,将吸有20 μL 35% FeCl3的滤纸片(1 cm×1 cm)敷在颈总动脉上30 min,假手术组用生理盐水代替35%FeCl3,观察血液流通情况,去纸片20 min后,迅速剪下颈总动脉血栓部位血管1 cm,放于滤纸片上吸干余血精密称湿重。放入70 ℃的烘箱2 h后称干重。计算血栓形成抑制率。
血栓形成抑制率(%)=(模型组血栓重量-给药组血栓重量)/模型组血栓重量×100
将每组剩余3只大鼠,分离左颈动脉,用浸满35% FeCl3的滤纸敷于动脉上,假手术组用生理盐水代替35% FeCl3,固定30 min,取颈动脉于4%多聚甲醛中固定,HE染色,切片,观察血栓形成情况。
1.8 对大鼠下腔静脉血栓形成的影响
将2.4实验动物末次给药后,大鼠腹腔注射10%水合氯醛麻醉,固定。沿腹中线切开腹壁,玻璃分针分离出下腔静脉,于下腔静脉和左肾静脉交叉下方手术线结扎,结扎后缝合腹壁。6 h后重新打开腹腔,在结扎下方2 cm处夹闭血管,剖开管腔,取出栓子,用滤纸吸干残血后,精密称湿重。置70 ℃烘箱中,烘2 h后精密称干重,计算血栓形成抑制率。
1.9 对大鼠凝血参数的影响
将2.4实验动物末次给药1 h后10%水合氯醛麻醉,眼底静脉丛取血,采用枸橼酸钠1:9抗凝采血,将抗凝血用离心机2500 r/min,离心15 min,取血浆用半自动血凝仪测定凝血酶原时间(PT)、鞣花酸活化部分凝血活酶时间(APTT)、凝血酶时间(TT)。
1.10 数据统计学处理
采用prim 8软件进行统计学处理,所有数据结果均以Mean±SEM表示,使用单因素方差分析的方法进行检验,若p<0.05则表示存在显著性差异,若p<0.01则表示存在极显著性差异。
2 结果与讨论
2.1 活性地龙蛋白胶囊对小鼠尾出血时间的影响
实验采用断尾法研究活性地龙蛋白胶囊对小鼠尾出血时间的影响,将断尾开始截至滤纸上无血迹出现的时间记作出血时间作为观察指标。小鼠进行断尾后,受损部位的血管内皮下胶原和皮下基质暴露,血小板黏附于胶原上,随后发生血小板聚集、释放等,出现血小板血栓,使受损血管出现堵塞,血流停止。实验结果(表1)显示,随着活性地龙蛋白胶囊给药剂量的升高,尾出血时间也随之延长(p<0.01),低、中、高剂量的活性地龙蛋白胶囊,均能显著延长小鼠的止血时间(13.75~18.88 min)。与空白组对照(3.13 min),表明活性地龙蛋白胶囊可以延长小鼠尾出血时间,且具有剂量依赖性。

表1 活性地龙蛋白胶囊对小鼠尾出血时间的影响Table 1 Activity of Dilong capsules on the influence of tail bleeding time in mice (Mean±SEM, n=8)
2.2 对小鼠凝血时间的影响

表2 活性地龙蛋白胶囊对小鼠凝血时间的影响Table 2 Activity of Dilong capsules on the influence of the clotting time in mice (Mean±SEM, n=8)
实验采用毛细玻管法研究地龙对小鼠全血凝血时间的影响,将取血开始至首次出现凝血丝的时间记作凝血时间作为观察指标。实验结果(表2)显示,随着活性地龙蛋白胶囊给药剂量的升高,凝血时间也随之延长(72.63~82.63 s),其中地龙低、中、高剂量组均出现极显著性差异(p<0.01),与空白组对照(41.88 s),表明活性地龙蛋白胶囊可以延长小鼠全血凝血时间,且具有剂量依赖性。
2.3 对大鼠FeCl3致颈动脉血栓形成的影响

表3 活性地龙蛋白胶囊对大鼠三氯化铁致颈动脉血栓形成湿重的影响Table 3 Ferric trichloride to Activity of Dilong capsules on rats carotid arterial thrombosis wet weight (Mean±SEM, n=8)
实验采用三氯化铁法诱导颈动脉血栓形成,将取出的血栓称重为血栓湿重,将血栓烘干,称重为干重,并计算得到血栓形成抑制率。实验结果(表3、表4显示),模型组与假手术组相比,具有显著性差异,证明三氯化铁可以诱导血栓形成。各剂量组与模型组相比,可以得出随着活性地龙蛋白胶囊剂量升高,抑制血栓效果逐渐增强(湿重抑制率25.29%~38.37%;干重抑制率41.17%~51.76%)。其中,地龙胶囊低剂量与模型组出现显著性差异(p<0.05),中、高剂量组出现极显著性差异(p<0.01)。
将三氯化铁诱导形成血栓的血管进行HE染色,得到结果如图1所示。结果显示,模型组与假手术组相比,血栓生成明显;地龙低、中、高剂量组与模型组相比,血栓生成较模型组减少。

表4 活性地龙蛋白胶囊对大鼠三氯化铁致颈动脉血栓形成的干重影响Table 4 Ferric trichloride to activity of Dilong capsules on rats carotid thrombosis of dry weight (Mean±SEM, n=8)
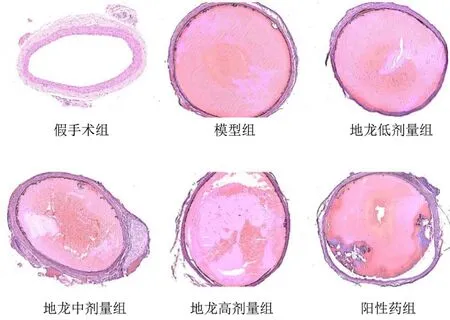
图1 FeCl3致颈动脉血栓生成HE染色Fig.1 FeCl3 carotid thrombosis generation HE staining
2.4 对大鼠下腔静脉血栓形成的影响
实验采用结扎法致使下腔静脉血栓形成,将取出的血栓称重为血栓湿重,将血栓烘干,称重为干重,并计算得到血栓形成抑制率。结果(表5、表6)显示,模型组与假手术组相比,具有显著性差异,证明结扎下腔静脉可以诱导血栓形成(湿重抑制率68.32%~76.53%;干重抑制率61.25%~72.49%)。活性地龙蛋白胶囊低、中、高剂量组与模型组相比均出现显著性差异(p<0.01)。可以得出,活性地龙蛋白胶囊可以抑制大鼠下腔静脉结扎诱导的血栓生成,且随着地龙剂量升高,抑制血栓效果逐渐增强。

表5 活性地龙蛋白胶囊对大鼠下腔静脉血栓形成湿重的影响Table 5 Activity of Dilong capsules on the influence of the inferior vena cava thrombosis wet weight of rats (Mean±SEM,n=8)

表6 活性地龙蛋白胶囊对大鼠三氯化铁致颈动脉血栓形成的干重影响Table 6 Activity of Dilong capsules on rats caused by FeCl3of the dry weight of influence (Mean±SEM, n=8)
2.5 对大鼠凝血参数的影响

表7 活性地龙蛋白胶囊对大鼠凝血参数的影响Table 7 The influence of activity of Dilong capsules on rat blood coagulation parameters (Mean±SEM, n=8)
采用眼底静脉丛取血,用半自动血凝仪测定凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)作为观察指标。结果如表7显示,与空白组相比(PT/s 20.43,APPT/s 39.65,TT/s 30.05),地龙低、中、高剂量组PT(23.68~24.94)、APTT(44.03~46.60)、TT(35.31~41.15)时间均可显著延长(p<0.05,p<0.01)。
3 讨论
食品类抗凝血、抑血栓活性物质主要以天然产物为主,其中以地龙和纳豆为典型代表。纳豆的有效成分为纳豆激酶,其作为一种丝氨酸蛋白,可特异性作用于交联纤维蛋白血栓,水解其成为蛋白质和氨基酸,进而使血栓溶解[17]。地龙应用于心血管领域的治疗具有悠久的历史,其中以由黄芪、赤芍、当归尾佐以地龙组成的 “ 补阳还五汤 ” 为典型代表,用于治疗脑梗死、脑出血及脑出血后遗症[16]。现代研究认为,地龙主要活性蛋白质为纤溶酶、蚓激酶和蚓胶原酶[6,7]。
纤溶酶[18]首次由Jeon OH从地龙中得到的抗凝、纤溶活性的丝氨酸蛋白酶类糖蛋白,因其具有胰酶激活位点,可以水解纤维蛋白原α/β链和凝血酶,具有纤溶酶的活性。Mihara H等[19]首次从地龙中提取出蚓激酶,可溶解纤维蛋白及纤维蛋白原、溶解血栓并抑制血小板聚集[20]。钟良伟等[21]从地龙中分离出的三种胶原酶,对陈旧性血栓的外壳蛋白有溶解效果。
4 结论
本试验通过手术造模方式分别研究活性地龙蛋白胶囊对小鼠止血时间的影响、对小鼠全血凝血时间的影响、对大鼠三氯化铁诱导颈动脉血栓的影响、对大鼠下腔静脉血栓的影响和对大鼠凝血参数的影响。与正常组比较,活性地龙蛋白胶囊可以延长小鼠尾出血及凝血时间(p<0.01),且具有剂量依赖性,高剂量组(90.00 mg/kg)延长尾出血活性(18.88 min)及凝血效果(82.63 s)最好。另外,与模型组相比,地龙胶囊随剂量升高抑栓效果逐渐增强,高剂量组(62.52 mg/kg)活性最好(湿重抑制率76.53%;干重抑制率72.49%)。该实验为活性地龙蛋白胶囊在溶栓方面的应用提供了实验基础和理论依据。

