火龙果皮发酵物对脂多糖诱导RAW264.7细胞炎症的缓解作用
李丹倩,梁嘉怡,钟晓晴,王润东,彭元怀
(岭南师范学院食品科学与工程学院,广东湛江 524048)
炎症是机体受细菌感染或氧化应激后免疫系统产生的防御反应,其发生机制与炎性信号通路和促炎因子相关。当致炎介质与免疫细胞膜上游信号响应元件先天免疫受体4(toll-like reporter4,TLR4)结合,经中游信号传递元件髓样分化因子88(myeloid differentiation factor 88,MyD88)和下游信号释放元件核因子-κB(nuclear factor-kaapa B,NF-κB)的转导,可激活NF-κB通路,驱动肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-1β(interleukin-1β,IL-1β)、白介素-6(IL-6)基因表达,形成炎症反应[1,2]。适度的炎症有利于宿主抵御病原体感染,然而,不受控制的炎症会诱发代谢综合征和肝肾损伤[3]。目前,化学合成的抗炎药物已广泛用于治疗炎症,但长期使用引发脏器功能衰退和胃肠溃疡[4]。因此,寻找低毒性的天然物质,来避免合成药物的毒副作用尤为迫切。
火龙果(Hylocereus undulatus)富含黄酮、多糖和多酚等物质,具有较好的保健功能[5]。火龙果皮是果实加工的副产物,约占整果总重量33%,它通常被转化为动物饲料或作为废弃物丢弃[6]。有研究指出果皮中也含有大量的膳食功能因子,具有抗菌、抑炎和抗氧化作用[7],但是由于果皮细胞壁的构成,采用传统的有机溶剂萃取和超声辅助提取无法使得果皮中活性物质充分溶出,造成提取率低和生物相容性差等问题[8,9]。目前,利用酵母、真菌和乳酸菌对食品原料进行发酵的研究正在兴起,微生物发酵是提高食品工业副产物再利用的一种综合、环保的新方法[10,11]。
微生物发酵的本质是利用菌体生长繁殖中释放的多种胞外酶,促进食品的营养功能成分降解,使得原本没有生物活性或活性较弱的前体物质转变为有效成分,从而增加提取物中有效物质的含量[11]。据报道,乳酸菌发酵大麦[12]、铁皮石斛[13]、石榴皮[14]可促进原料中大分子蛋白质和结合态物质的分解,获得新型小肽和游离态物质。Cheng等[15]发现干酪乳杆菌发酵的蓝莓渣对肥胖诱导炎症的缓解作用显著高于未发酵果渣,且具有更高的生物利用率。李倩[16]通过植物乳杆菌发酵辣木叶制备富含γ-氨基丁酸,大幅提高辣木叶水提物的抗炎和抗氧化活性。由此可见,果蔬及其下脚料的乳酸菌发酵具有广阔的应用前景。然而,发酵火龙果皮侧重于果醋和酿酒工艺的研究,未见关于火龙果皮发酵物中功能组分及抗氧化/抗炎作用的报道。
本文以干酪乳杆菌CICC20280发酵火龙果皮,检测发酵前后提取物中总酚和黄酮的变化、抗氧化活性的差异,基于脂多糖(LPS)诱导的RAW264.7细胞炎症模型,探究火龙果皮发酵物(FermentedHylocereus undulatuspeel,FHP)对炎症的缓解作用和机制,旨在为火龙果皮资源的综合利用和抗炎功能产品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜火龙果,购于广东省湛江市火龙果产区。整果洗净和晾干后,分离果肉与果皮,把果皮切成3~5 cm小块,经冷冻干燥后粉碎过100目筛,1 ℃下贮藏备用。乳酸菌菌株:干酪乳杆菌CICC20280由广东省微生物研究所丁郁教授馈赠。
脂多糖(LPS,Escherichia coliO55:B5)、噻唑蓝(MTT),美国Sigma公司;二甲基亚砜(DMSO)、地塞米松(DEX),青岛海博有限公司;RAW264.7细胞株,中国科学院(上海)细胞库;RPMI-1640基础培养基、青链霉素混液、胎牛血清(FBS)和磷酸盐缓冲液,美国Gibco公司;一氧化氮(nitric oxide,NO)检测试剂盒,美国 Promega公司;TNF-α/IL-1β/IL-6酶联免疫吸附试剂盒、ABTS试剂盒、FRAP试剂盒、2’,7’-二氯荧光素二乙酸酯(DCFH-DA)荧光试剂、Trizol RNA提取剂、HiScriptⅡ Q-RT SuperMix for RT-PCR、AceQ Universal SYBR RT-PCR Master Mix,广州齐云生物科技有限公司。
1.2 仪器与设备
SW-CJ-2D超净工作台,苏州净化设备工程有限公司;SCIENTZ-12N真空冷冻干燥机,北京博医仪器公司;Microfuge 20R低温高速离心机,美国Beckman公司;Thermo311 CO2细胞培养箱、MK3型全自动多功能酶标仪,美国Thermo公司;CFX96型荧光定量PCR仪,美国Bio-Rad公司。
1.3 试验方法
1.3.1 FHP制备及活性组分测定
干酪乳杆菌CICC20280的活化,将菌株冻干粉接入MRS液体培养基,37 ℃厌氧培养24 h后,12000 r/min离心10 min,收集沉淀,用无菌生理盐水调整菌液浓度至107CFU/mL作为发酵剂。按照质量:体积=1:1.5,将火龙果皮粉末与蒸馏水混合,采用80 ℃,15 min巴氏杀菌法除去火龙果皮培养基中原始杂菌,冷却至室温备用。将上述发酵剂以体积分数5%添加到无菌的火龙果皮培养基,37 ℃厌氧静置培养42 h后,4000 r/min,4 ℃,离心5 min,收集上清液。以蒸馏水为流动相,应用聚酰胺柱层析法对上清液初分离纯化,于真空冷冻干燥,制成FHP[17]。对照组样品的制备除不接种发酵剂外,其余操作同上。试样中总酚和黄酮的测定参照Sun等[18]建立的方法。
1.3.2 FHP抗氧化活性测定
通过DPPH自由基清除能力、ABTS自由基清除能力和铁离子还原能力[18],对FHP的抗氧化活性进行评估。
1.3.3 FHP抗炎活性测定
1.3.3.1 RAW264.7细胞培养
取冻存RAW264.7细胞,37 ℃水浴1 min,在无菌操作台内将其移入含10%胎牛血清、1%双抗(100 U/mL青霉素和100 U/mL链霉素)的RPMI-1640完全培养基,37 ℃、5% CO2培养箱中孵育,每隔24 h更换培养基,当细胞融合率达到80%~90%对细胞进行传代,细胞传至3代,用于后续试验。
1.3.3.2 FHP对RAW264.7细胞活力的影响
利用RPMI-1640完全培养液将RAW264.7细胞浓度调整至106个/mL,按照每孔100 μL接种于96孔细胞培养板,37 ℃、5% CO2培养箱中孵育18 h。待细胞贴壁后,弃掉孔内培养液,随后每孔加入100 μL液体,依据添加液体的种类,将细胞分为:对照组、阳性组和不同质量浓度FHP处理组,分别添加:完全培养液、0.5 μg/mL DEX溶液和50 μg/mL、100 μg/mL、200 μg/mL、400 μg/mL和800 μg/mL FHP溶液,每组设5个复孔。培养24 h后,向各孔内加入100 μL MTT工作液(5 mg/mL),作用4 h后弃上清液,每孔加100 μL MTT终止液(0.1% DMSO),避光振荡混匀,于490 nm处测定OD值,计算细胞存活率,确定FHP安全浓度。细胞存活率计算公式,如下:

1.3.3.3 FHP对LPS诱导RAW264.7细胞活力的影响
按照1.3.3.2操作进行细胞接种,根据FHP安全浓度范围,设置7个试验组:对照组、阳性组、LPS模型组和低中高浓度FHP组,分别添加100 μL:完全培养液、0.5 μg/mL DEX、1 μg/mL LPS、100 μg/mL、200 μg/mL和400 μg/mL FHP。阳性组和FHP组在添加对应溶液处理细胞1 h后,加入100 μL 1 μg/mL LPS。各组培养24 h后,按照1.3.3.2操作检测FHP对LPS刺激的RAW264.7细胞保护效应。
1.3.3.4 FHP对LPS诱导RAW264.7细胞分泌NO、ROS、细胞因子及NF-κB通路关键基因的影响
细胞接种、试验分组和受试物添加同1.3.3.3操作。
①格里斯(Griess)法检测RAW264.7细胞上清中NO含量
干预细胞24 h后,4000 r/min,4 ℃离心5 min,收集各组上清50 μL。向上清中添加等体积Griess A和Griess B溶液,37 ℃孵育10 min。在540 nm处测定各孔OD值,用NaNO2建立标准曲线,计算样品中亚硝酸钠浓度,推算细胞培养液中NO释放量。
②DCFH-DA荧光法检测RAW264.7细胞上清液中ROS含量
同上述操作收集上清后,在黑暗条件下加入终浓度100 μmol/L DCFH-DA荧光试剂,避光孵育30 min后,以激发波长488 nm、发射波长525 nm,测定上清荧光强度。
③ELISA检测RAW264.7细胞上清中TNF-α、IL-1β、IL-6和IL-10含量
同上述操作收集上清。按照ELISA试剂盒说明书测定各组上清中细胞因子的浓度。
④RT-PCR检测RAW264.7细胞NF-κB通路TLR4/MyD88/NF-κB及炎症因子基因的表达

表1 引物序列Table 1 Primer sequences used for RT-PCR
干预细胞4 h后,4000 r/min,4 ℃离心10 min,弃上清,收集细胞。使用Trizol RNA提取细胞总RNA,RNA经纯度和质量浓度检测后,保留高品质RNA样本。应用反转录试剂盒将RNA逆转录为cDNA,采用10 μL反转录体系,反转录条件为:37 ℃、10 min;95 ℃、8 s。利用特异性引物进行RT-PCR扩增,以小鼠β-actin为内参基因,构建20 μL反应体系,反应条件为:95 ℃、25 s;95 ℃、10 s,60 ℃、15 s,循环40次;融解曲线分析:95 ℃、15 s;60 ℃、30 s,循环1次。引物序列如下表1。通过2-ΔΔCt法计算待测基因的相对表达量。
1.4 数据统计分析
试验数据采用SPSS 19.0统计软件进行处理,以平均值±标准差表示,满足正态分布和方差齐性的多组之间均数比较运用单因素方差分析,进一步两两比较用LSD法,方差不齐者采用Dunnett"s T3检验。p<0.05存在显著差异,p<0.01为极显著差异。
2 结果与讨论
2.1 FHP总酚、黄酮和抗氧化活性
火龙果皮发酵物中总酚含量达169.26 mg CAE/(g DW)、黄酮为81.74 mg CAE/(g DW),不仅显著高于(p<0.05)未发酵火龙果皮中的含量,还远超已报道的榴莲壳[19]、葡萄皮[20]和芒果皮[21]等下脚料中的提取量,有研究指出乳酸菌通过脱羧和还原反应将食品原料中结合态酚和黄酮转化为游离态[22]。因此,乳酸菌发酵果蔬渣的工艺更适合天然产物的工业化生产。火龙果皮发酵物具有更高的DPPH/ABTS自由基清除能力和Fe3+金属离子螯合能力,本研究中干酪乳杆菌CICC20280菌株在生长稳定的后期也能产生具有抗氧化活性的物质,但火龙果皮发酵时长为42 h,此时菌体生长刚达到稳定期,因此,菌体代谢产生的抗氧化物质量远远低于火龙果皮发酵后的释放量,可以忽略其影响。此外,有研究指出炎症反应释放的促炎因子可以活化巨噬细胞和白细胞等分泌大量的过氧化物自由基,加重炎症程度,因此,天然活性物质通过清除自由基发挥抗氧化作用具有潜在的缓解炎症的功能[23,24],据此推断具有抗氧化活性的FHP可通过淬灭氧自由基发挥抗炎功效。
2.2 FHP对RAW264.7细胞活力的影响
细胞增殖试验是评估外源化合物细胞毒性的重要依据。由表3可知,以DEX组细胞存活率为100%,FHP浓度在100~400 μg/mL时,RAW264.7细胞存活率随浓度增加而上升,细胞最高存活率达到99.01%。然而,FHP浓度低于100 μg/mL或高于400 μg/mL时细胞活力会明显下降,这表明高浓度FHP能导致细胞损伤,具有细胞毒性。最新研究也证实,摄入过量的儿茶素(多酚类)会对肝脏细胞造成不可逆损伤[25],因此,质量浓度100~400 μg/mL是研究FHP抗炎功效的安全剂量范围。
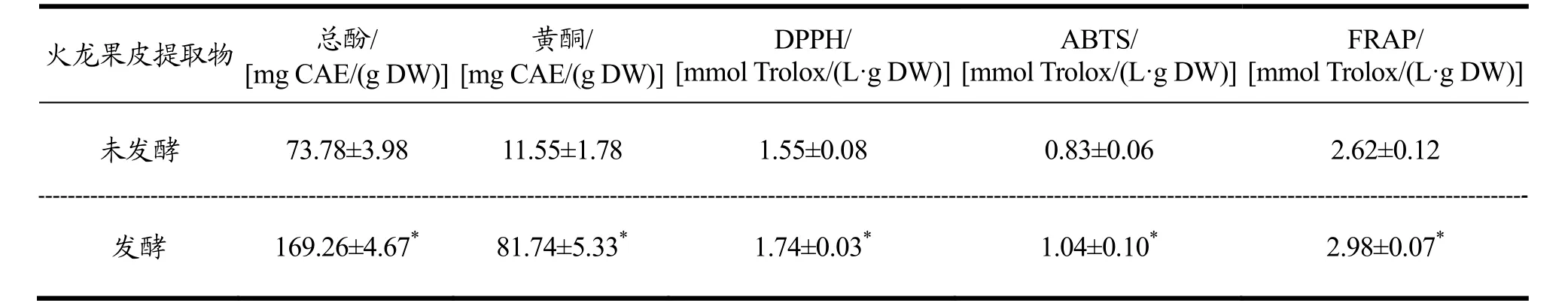
表2 火龙果皮提取物的总酚、黄酮和抗氧化活性Table 2 Main antioxidant components and antioxidant activities in Hylocereus undulatus peel extract
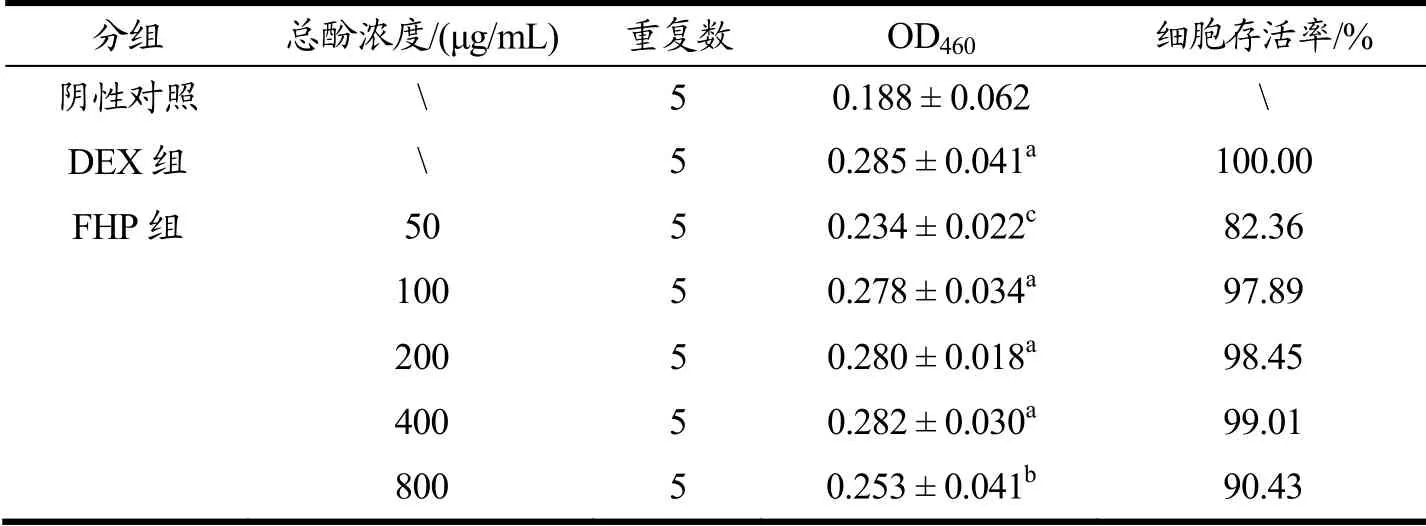
表3 火龙果皮发酵物对RAW264.7细胞活力的影响Table 3 Effects of fermented Hylocereus undulatus peel on the proliferation of RAW264.7 cells
2.3 FHP对LPS诱导的RAW264.7细胞分泌NO和ROS影响
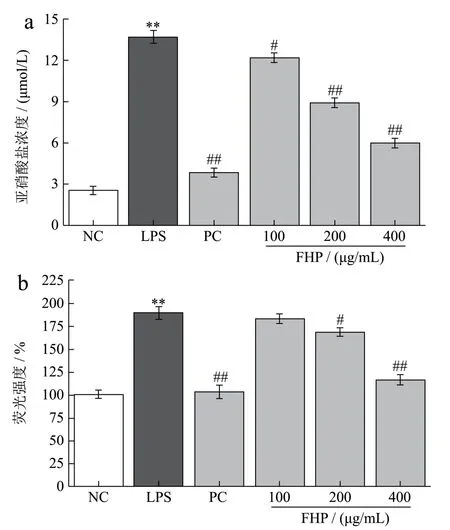
图1 火龙果皮发酵物对LPS诱导RAW264.7细胞分泌NO和ROS的影响Fig.1 Effects of fermented Hylocereus undulatus peel on NO and ROS in LPS-induced RAW264.7 cells
NO作为重要的促炎介质,其释放量是评价炎症的首要指标[26]。ROS伴随炎症反应而产生,其诱导的细胞氧化损伤会加速炎症进程[27]。如图1所示,与阴性对照NC组相比,炎症模型LPS组RAW264.7细胞NO和ROS的释放量极显著升高(p<0.01)。与LPS组相比,经不同质量浓度FHP(100~400 μg/mL)预处理的细胞NO释放量均显著减少(p<0.05或p<0.01),且呈剂量依赖性;FHP浓度高于200 μg/mL才能显著抑制(p<0.05)ROS生成。此外,FHP浓度为400 μg/mL,其抑制NO和ROS释放的效果分别达到阳性对照PC组85.63%和88.90%。有研究指出,NO可与炎性因子相互作用,其分泌量决定细胞内炎性因子的生物合成能力[28]。因此,推测FHP先抑制细胞中NO生成,减少NO与炎性因子的互作,进而降低炎性因子活性。
2.4 FHP对LPS诱导RAW264.7细胞分泌TNF-α、IL-1β、IL-6和IL-10的影响

图2 火龙果皮发酵物对LPS诱导的RAW264.7细胞因子生成的影响Fig.2 Effects of fermented Hylocereus undulatus peel on cytokines in LPS-induced RAW264.7 cells
图2a~d显示,与NC组相比,LPS组RAW264.7细胞分泌炎性因子TNF-α、IL-1β和IL-6极显著(p<0.01)升高,而抗炎因子IL-10浓度极显著降低(p<0.01),表明炎症造模成功。与LPS组相比,添加不同浓度FHP均极显著抑制(p<0.01)TNF-α和IL-6的释放,最大抑制率为68.92%和62.15%。当FHP浓度高于200 μg/mL时,可显著抑制细胞分泌IL-1β,并提升IL-10的释放,最大提高率为173.72%。与PC组相比,随着FHP浓度的增加,组间的抗炎功效的差异逐渐减少。此结果与前面促炎介质NO和ROS对FHP的响应规律一致。这也进一步验证了FHP是通过抑制NO释放、降低ROS氧化损伤和提升抗炎因子的多重作用,缓解细胞炎症反应。
2.5 FHP对LPS诱导的RAW264.7细胞NF-κB通路及炎性因子合成基因表达的影响
NF-κB通路是由关键元件TLR4/MyD88/NF-κB介导的细胞感知、转导和表达致炎信号的经典通路,能够引发TNF-α、IL-1β和IL-6炎症物质的 “ 瀑布样 ” 释放,造成机体炎性损伤,所以长期以来NF-κB通路相关的功能元件被认为是抗炎物质的主要靶点[29]。为明确FHP抗炎作用机制,采用RT-PCR检测NF-κB通路的信号转导元件及下游炎性因子合成基因的表达。由图3可知,LPS组细胞中TLR4/MyD88/NF-κB及TNF-α/IL-1β/IL-6的相对表达量极显著(p<0.01)高于NC组。然而,经不同质量浓度FHP预处理后,与LPS组相比,细胞NF-κB通路的信号转导基因及下游炎性因子的表达均显著减少(p<0.05或p<0.01),且浓度为400 μg/mL FHP对细胞NF-κB通路的信号转导功能抑制最佳。有文献指出,多酚和黄酮类物质可与细胞表面Toll样受体竞争结合,减少致炎物与炎性信号响应元件的接触,沉默炎性因子合成基因表达[30],因此,FHP抗炎机制可能是其功能组分中的总酚和黄酮结合TLR4,抑制NF-κB通路的信号转导功能,下调炎性因子基因的表达,从而减少炎性因子的分泌,缓解机体炎性损伤。炎症对机体的危害主要通过炎性损伤和氧化损伤实现,其发生机制与NF-κB通路和氧自由基有关[1,2,29],PC组地塞米松可与胞内的糖皮质受体结合,转位至细胞核后干扰NF-κB通路,缓解炎症的机制已被学者阐明,且在图3中得到验证,FHP也可影响NF-κB通路,说明FHP与地塞米松有共同的抗炎机制。然而,这不代表二者抗炎机制完全一致,在2.1研究中证实的FHP具有较强抗氧化活性,能够淬灭活性氧,减轻了炎症反应中的氧化损伤,综上FHP的抗炎机制与沉默NF-κB通路功能和抗氧化作用密切相关。此外,最新研究[17]表明多酚类物质通过 “ 肠道菌群-NF-κB通路 ” 的级联途径缓解机体炎症,因此更多关于FHP的抗炎信息可在体内研究中被挖掘。

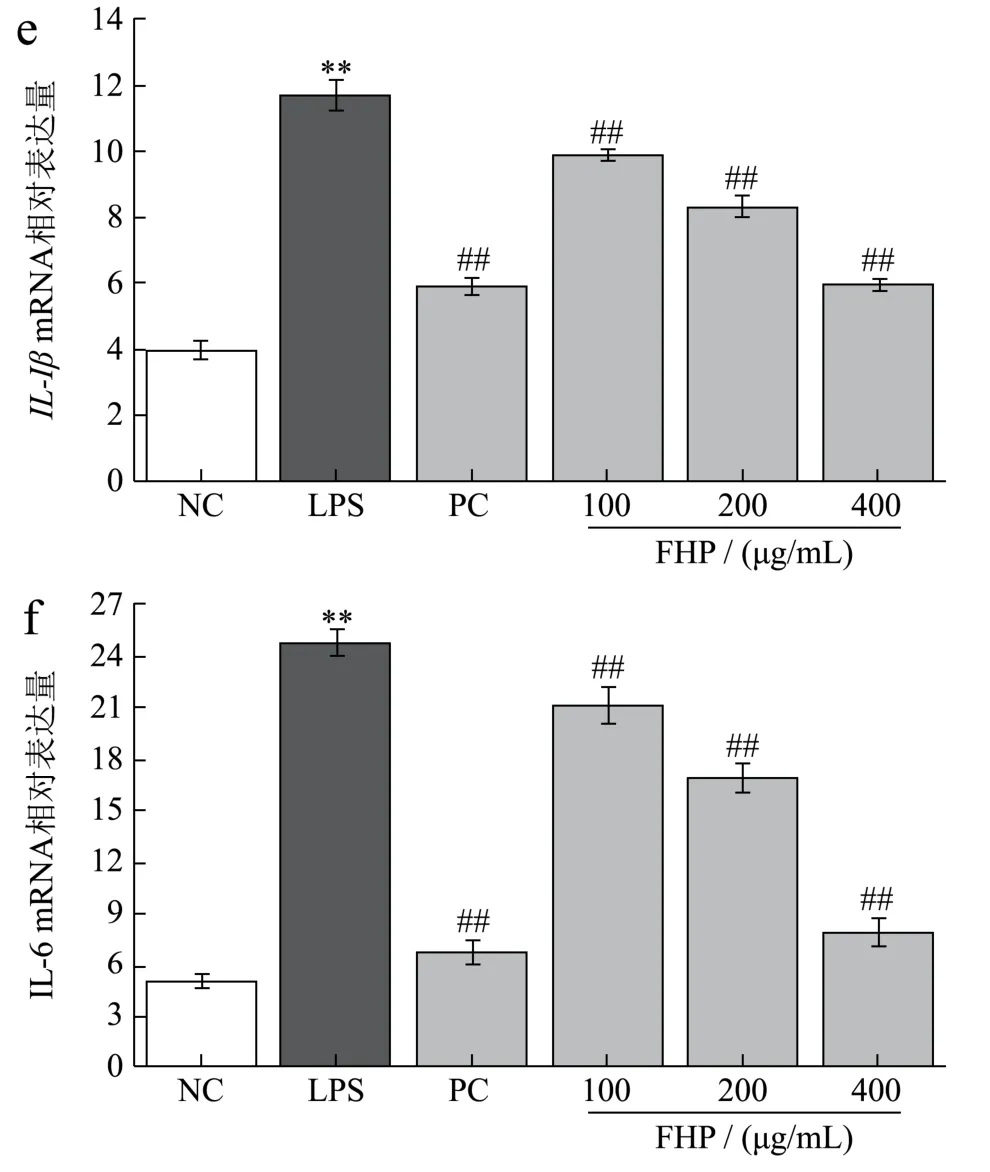
图3 火龙果皮发酵物对LPS诱导的RAW264.7细胞NK-κB通路元件和炎性因子表达的影响Fig.3 Effects of fermented Hylocereus undulatus peel on the genes expression of NF-κB pathway and pro-inflammatory factor in LPS-induced RAW264.7 cells
3 结论
本研究比较了火龙果发酵前后,提取物中总酚、黄酮和抗氧化活性的变化,并基于RAW264.7细胞炎症模型探究FHP抗炎作用及机制。结果表明,火龙果皮经干酪乳杆菌CICC20280发酵后,总酚、黄酮含量和抗氧化活性显著升高,且能够有效抑制促炎介质NO和ROS生成,减少过氧化物引发的早期炎症损伤。FHP在蛋白分泌和基因表达两个层次上显著抑制炎性因子TNF-α、IL-1β和IL-6,其作用机制是多酚和黄酮类物质通过下调NF-κB通路的关键元件TLR4/MyD88/NF-κB的表达,沉默通路功能实现。文中探讨了FHP功能组分和体外抗炎作用,而FHP物质分离、结构表征和体内抗炎有待后续的研究。

