橙皮素通过调控SIRT1/PGC-1α信号通路保护急性心肌梗死大鼠*
左新华,朱光旭,刘 岩
(1重庆康华众联心血管病医院检验科,重庆400000;2河南省人民医院心血管内科,河南郑州450003)
急性心肌梗死(acute myocardial infarction,AMI)是由于冠状动脉供血突然严重减少或中断,从而导致严重急性心肌缺血和缺血性坏死[1]。氧化应激反应则是影响AMI后心室重构的重要病理反应,与心肌细胞凋亡或坏死、心肌细胞病理性肥大和细胞外基质代谢紊乱密切相关[2-3]。心肌组织缺血后,会使活性氧簇(reactive oxygen species,ROS)增加,引起过度的氧化应激反应,造成心肌损伤。因此,寻找能够抑制氧化应激反应,改善AMI后心脏重构和功能的潜在药物具有重要的临床价值。
沉默信息调节因子1(silent information regulator 1,SIRT1)是一种保守的NAD+依赖性蛋白去乙酰化酶,是过氧化物酶体增殖物激活受体γ辅激活因子1α(peroxisome proliferator-activated receptorγcoactivator-1α,PGC-1α)的上游调控因子[4]。Naaz等[5]研究发现,褪黑素对AMI大鼠的保护机制与激活SIRT1/PGC-1α信号通路有关。据报道,橙皮素(hesperetin)是柑橘果皮中发现的一种黄酮苷,能抑制AMI后的心脏炎症反应[6]。以往研究表明,橙皮素具有显著的抗炎、抗氧化和抗凋亡等作用[7]。Wang等[8]研究认为,橙皮素是SIRT1激活剂,可改变NF-κB的乙酰化,发挥对小鼠肝炎的治疗作用。然而,橙皮素是否以及如何参与心肌梗死后的氧化应激反应,目前仍不清楚。因此,本研究采用大鼠AMI模型,探讨橙皮素是否通过激活SIRT1/PGC-1α信号通路,抑制氧化应激反应对心肌梗死后心肌细胞凋亡作用。
材料和方法
1 动物
SPF级SD雄性大鼠,体质量180~220 g左右,购自河南省实验动物中心,许可证号为SCXK(豫)2017-0001。所有大鼠自由饮食、饮水,清洁级饲养。经本院动物伦理委员会批准,并遵守3R保护原则进行实验。
2 主要试剂及仪器
橙皮素(纯度≥99%)购自北京索莱宝生物科技有限公司;SIRT1/2抑制剂购自Abcam;白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA试剂盒,以及总超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和丙二醛(malondialdehyde,MDA)测定试剂盒均购自南京建成生物工程研究所;抗SIRT1、PGC-1α和β-actin的I抗及羊抗兔II抗均购自Cell Signaling Technology。小型动物超声系统购自VisualSonics;酶标仪购自TECAN;光学显微镜购自Nikon;蛋白电泳仪购自北京六一仪器厂;凝胶成像系统购自Bio-Rad。
3 实验方法
3.1 动物模型制备按照文献[9]的方法,采用冠状动脉左前降支(left anterior descending coronary artery,LAD)结扎术构建AMI大鼠模型。首先通过腹腔注射1%戊巴比妥钠(30 mg/kg)将大鼠麻醉。仰卧位固定在手术平台上,气管插管辅助通气。在胸部左侧的第4和第5肋之间切开皮肤,然后钝性分离,剥离肌肉,露出心脏。在显微镜下打开心包,并结扎在肺动脉圆锥和左心室的连接处。结扎后,心肌变白。将切口逐层缝合,然后消毒并注射青霉素以防止感染。最后,在心电图中观察到ST段持续升高,伴有Q波和室性心律失常,表明AMI模型已成功制备。假手术模型的构建与AMI模型类似,但不结扎。
3.2 动物分组及样本采集将造模成功的AMI大鼠,根据随机数字表法分成模型组、橙皮素组和橙皮素+抑制剂组,每组12只。另取12只大鼠作为假手术组。橙皮素组和橙皮素+抑制剂组大鼠给予30 mg·kg-1·d-1的橙皮素灌胃干预[6],橙皮素+抑制剂组除橙皮素灌胃外,还需静脉注射SIRT1抑制剂(10 mg/kg)。假手术组和模型组分别给予等量生理盐水灌胃,每天1次,连续8周。
3.3 心功能检测8周后,使用小型动物超声系统(探头频率为20~40 MHz)测定各组大鼠的左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)、左心室收缩末期内径(left ventricular endsystolic diameter,LVESD)、左心室短轴缩短率(left ventricular fractional shortening,LVFS)和左心室射血分数(left ventricular ejection fraction,LVEF)。
3.4 样本采集心功能指标检测完成后,采集各组大鼠的外周血,离心取上清,置于-20℃中保存备用。然后将大鼠处死,完整取出心脏。从每组中随机选择6只大鼠,将心肌组织置于4%的多聚甲醛中固定;另外6只大鼠的心肌组织液氮速冻后,置于-80℃中保存。
3.5 炎症因子和氧化应激指标的检测采用ELISA法检测各组大鼠血清中IL-6和TNF-α的水平。根据试剂盒说明书分别对大鼠血清中SOD、GSH-Px和MDA的水平进行检测。
3.6 HE染色观察大鼠心肌组织的病理变化取出固定在多聚甲醛中的心肌组织,梯度乙醇脱水透明,石蜡包埋,然后将组织切成5μm厚的切片,HE染色后于光学显微镜下观察组织的病理学变化。
3.7 TUNEL法检测大鼠心肌组织细胞凋亡取制备完成的大鼠心肌组织切片,使用TUNEL试剂盒对心肌细胞的凋亡情况进行检测。凋亡细胞分布的同一区域的每个切片都是从5个高倍视野中随机选择的。然后,计算每个视野中的平均凋亡细胞数占细胞总数的百分比,由此计算出细胞凋亡率(%)。
3.8 Western blot法检测大鼠心肌组织中SIRT1/PGC-1α通路相关蛋白表达水平取出-80℃中保存的心肌组织,液氮研磨匀浆化,提取组织中的总蛋白,并用BCA蛋白分析试剂盒对蛋白浓度进行定量。总蛋白经10%SDS-PAGE分离后,转移到PVDF膜上,并在室温下用5%脱脂奶粉封闭2 h。洗膜,孵Ⅰ抗(抗SIRT1和PGC-1α抗体,稀释倍数为1∶1 000),在4℃条件下过夜。洗膜孵Ⅱ抗,在室温下孵育1 h,曝光显色,使用凝胶成像系统分析蛋白的相对表达量。其中以β-actin为内参照。
4 统计学处理
本研究所得数据均采用SPSS 22.0软件进行统计,计量资料以均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 各组大鼠心脏超声检查结果分析
与假手术组相比,模型组大鼠LVESD和LVEDD显著升高(P<0.05),LVFS和LVEF显著降低(P<0.05);与模型组相比,橙皮素组大鼠LVESD和LVEDD显著降低(P<0.05),LVFS和LVEF显著升高(P<0.05);与橙皮素组相比,橙皮素+抑制剂组大鼠LVESD和LVEDD显著升高(P<0.05),LVFS和LVEF显著降低(P<0.05),见表1。
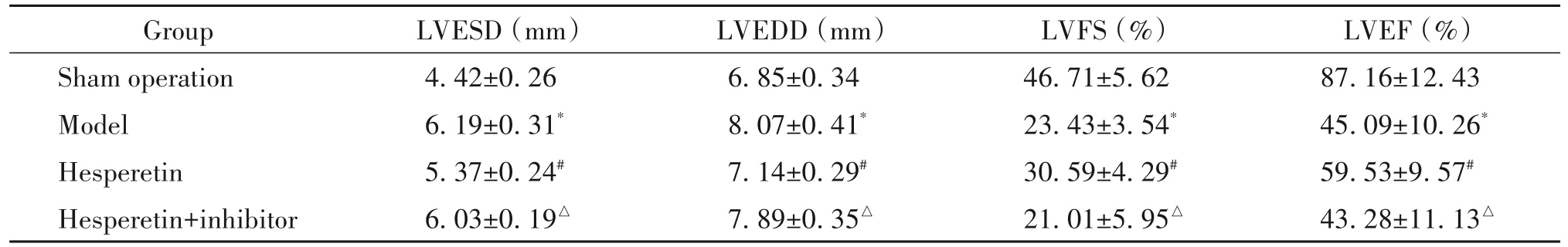
表1 各组大鼠心脏超声检查结果分析Table 1.Analysis of echocardiographic results of the rats in each group(Mean±SD.n=12)
2 各组大鼠血清中炎症因子水平和氧化应激指标的比较
与假手术组相比,模型组IL-6、TNF-α和MDA含量显著升高,SOD和GSH-Px水平显著降低(P<0.05);与模型组相比,橙皮素组IL-6、TNF-α和MDA含量显著降低,SOD和GSH-Px水平显著升高(P<0.05);与橙皮素组相比,橙皮素+抑制剂组IL-6、TNF-α和MDA含量显著升高,SOD和GSH-Px水平显著降低(P<0.05),见表2。
3 各组大鼠心肌组织的病理变化的比较
假手术组大鼠心肌细胞未见明显变性,排列规则、清晰,肌丝相对完整,细胞间隙均匀;模型组大鼠部分心肌组织损伤严重,心肌纤维溶解、部分断裂,大量心肌纤维排列明显紊乱,部分细胞核固缩、核碎裂,心肌毛细血管扩张,心外膜下可见更严重的炎症细胞浸润和心肌组织坏死;橙皮素组可见少量心肌细胞疏松、水肿、坏死,与模型组相比,部分心肌纤维排列较规则,炎症细胞浸润较轻,整体形态较为清晰;橙皮素+抑制剂组局部心肌纤维排列紊乱,伴有少量心肌细胞变性、坏死和轻度炎症细胞浸润,毛细血管轻度充血,病变程度明显重于橙皮素组,见图1。
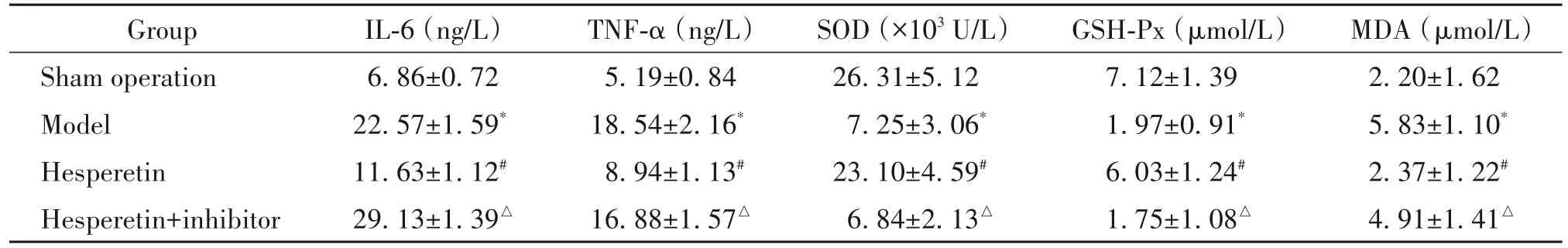
表2 各组大鼠血清中炎症因子水平和氧化应激指标的比较Table 2.The serum levels of inflammatory factors and oxidative stress indexes of the rats in each group(Mean±SD.n=12)
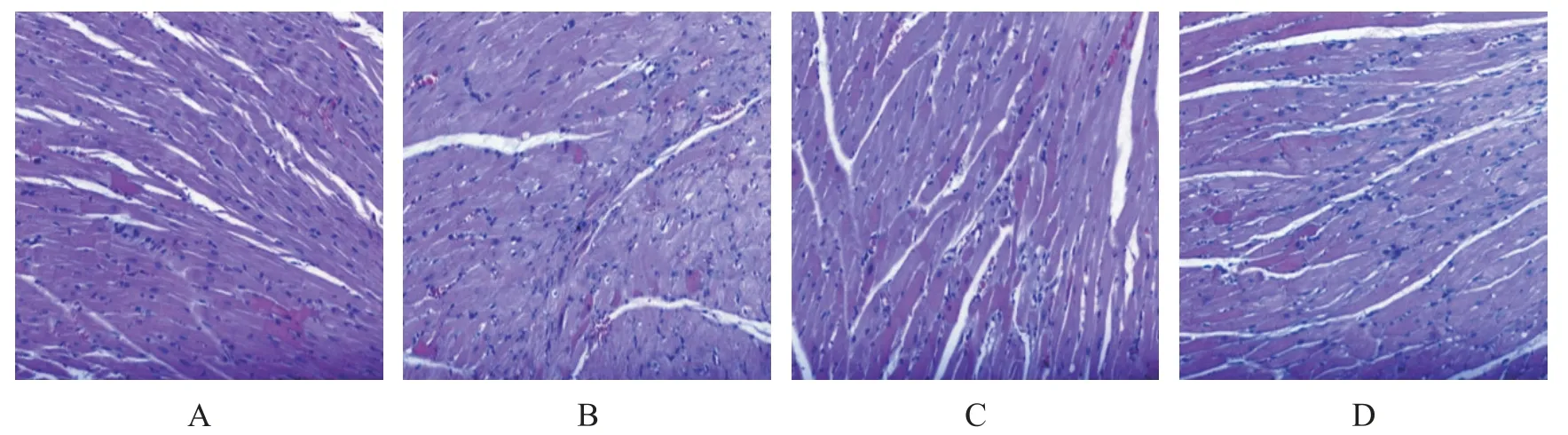
Figure 1.HEstaining of myocardial tissues of the rats in each group(×200).A:sham operation group;B:model group;C:hesperitin group;D:hesperitin+inhibitor group.图1 各组大鼠心肌组织HE染色结果图
4 各组大鼠心肌细胞凋亡的比较
与假手术组相比,模型组心肌细胞凋亡率显著升高(P<0.05);与模型组比较,橙皮素组心肌细胞凋亡率显著降低(P<0.05);与橙皮素组相比,橙皮素+抑制剂组心肌细胞凋亡率显著升高(P<0.05),见图2及表3。
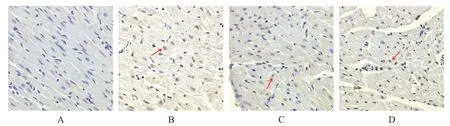
Figure 2.The images of cardiomyocyte apoptosis in infarcted area of rat heart tissue(TUNEL staining,×200).A:sham operation group;B:model group;C:hesperitin group;D:hesperitin+inhibitor group.图2 大鼠心脏组织梗死区的心肌细胞凋亡检测结果
5 各组大鼠心肌组织中SIRT1/PGC-1α通路相关蛋白表达水平的比较
与假手术组相比,模型组SIRT1和PGC-1α蛋白水平显著降低(P<0.05);与模型组相比,橙皮素组SIRT1和PGC-1α蛋白水平显著升高(P<0.05);与橙皮素组相比,橙皮素+抑制剂组SIRT1和PGC-1α蛋白水平显著降低(P<0.05),见图3及表3。
讨 论
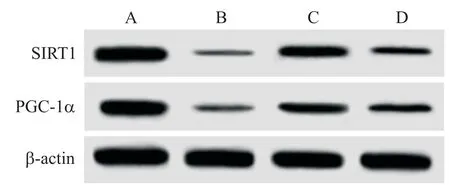
Figure 3.The images of Western blot for determining the protein levels of SIRT1 and PGC-1αin myocardial tissue of the rats in each group.A:sham operation group;B:model group;C:hesperitin group;D:hesperitin+inhibitor group.图3 各组大鼠心肌组织心肌组织中SIRT1和PGC-1α蛋白表达的Western blot图

表3 各组大鼠心肌组织中SIRT1和PGC-1α蛋白表达水平及心肌细胞凋亡率的比较Table 3.Comparison of SIRT1 and PGC-1αprotein expression levels in myocardial tissue and cardiomyocyte apoptotic rates of the rats in each group(Mean±SD.n=12)
AMI作为一种重要的心血管疾病,是导致患者死亡的主要原因,也是全球人口死亡的主要原因之一[10]。AMI病理反应十分复杂,包括炎症反应、氧化应激反应和细胞凋亡在内等各种发病机制,会影响AMI后的心室重构[11]。Bai等[12]的研究表明,AMI后过度的炎症和氧化应激反应可导致继发性心肌瘢痕增生、纤维化和心肌细胞凋亡等,并可导致梗死区组织形态异常和结构紊乱、功能障碍,最终导致重症患者心室重构不良和死亡。本研究通过LAD结扎术构建AMI大鼠模型,并用小型动物超声系统检测大鼠的心功能,结果显示,模型组大鼠LVEDD和LVESD显著升高,而LVFS和LVEF显著降低,说明模型组大鼠心功能下降。经HE染色观察模型组大鼠部分大量心肌纤维排列明显紊乱,部分细胞核固缩、核碎裂,心外膜下可见更严重的炎性细胞浸润和心肌组织坏死,揭示AMI模型构建成功。
橙皮素是柑橘果皮中的主要药理活性成分,其治疗作用主要是由于其抗氧化和自由基清除作用[13];它不但具有抗过敏、抗皮炎和神经保护作用,还可调节心血管系统的功能,增强机体对细菌和微生物的抵抗力,预防肿瘤[14]和遗传毒性,并提高其他药物的生物利用度[15]。在心血管系统中,橙皮素可扩张血管,降低血脂,降低毛细血管通透性和血管脆性[16]。在本研究中,AMI大鼠在橙皮素的作用下,心功能改善,心肌组织炎症细胞浸润减轻,血清中IL-6和TNF-α含量显著降低,说明橙皮素可抑制AMI大鼠的炎症反应,与前人结果一致[6]。
在AMI过程中,炎症反应往往都伴随着氧化应激反应。氧化应激可产生大量ROS,导致抗氧化系统失衡,造成氧化应激损伤,从而诱发细胞凋亡、坏死,进一步加强氧化应激反应和炎症反应之间的联系[17]。MDA是脂质过氧化产物,可进一步诱导ROS的产生,抑制抗氧化系统,加重损伤。SOD可清除ROS,增强抗氧化系统,保护心肌细胞[18]。在本研究中,AMI大鼠中MDA含量升高,SOD和GSH-Px活性降低,心肌细胞凋亡率显著升高,因此我们推测,AMI大鼠的氧化应激反应可能造成心肌细胞凋亡。Li等[19]的研究发现,橙皮素可上调SOD和GSH-Px等抗氧化酶的表达,发挥抗氧化的作用。本研究中,橙皮素显著提高了AMI大鼠体内的SOD和GSH-Px活性,降低了MDA水平,表明橙皮素可抑制AMI大鼠的氧化应激反应。
SIRT1是NAD+依赖的脱乙酰酶家族中高度保守的成员,可通过去乙酰化和激活PGC-1α来保护心肌细胞免受氧化应激的损伤[20]。SIRT1/PGC-1α去乙酰化途径的紊乱可增强氧化应激和促进线粒体功能障碍[21]。Cui等[22]的研究发现,促红细胞生成素通过SIRT1/PGC-1α去乙酰化,增强线粒体功能,并抑制阿霉素诱导的心脏毒性。白藜芦醇通过减轻氧化应激和线粒体功能障碍来减轻糖尿病心脏损伤,这与SIRT1对PGC-1α去乙酰化的调节有关[23]。本研究发现,橙皮素可提高AMI大鼠心肌组织中SIRT1和PGC-1α蛋白水平,而AMI大鼠在橙皮素和SIRT1抑制剂的双重作用下,心肌组织中SIRT1和PGC-1α蛋白水平较橙皮素组显著降低,表明橙皮素减轻AMI大鼠的氧化应激反应,可能与激活SIRT1/PGC-1α去乙酰化途径有关。
综上所述,橙皮素可通过激活SIRT1/PGC-1α信号通路,抑制AMI大鼠氧化应激反应,从而发挥心脏保护作用。然而,我们只研究了SIRT1/PGC-1α信号通路的重要作用,其他与氧化应激有关的信号通路尚需后续进一步研究。

