紫云英苷诱导DLBCL细胞系OCI-LY8凋亡*
王 瑜,朱明了,何施燕,陈 弘,陈佳玉
(绍兴文理学院医学院,浙江绍兴312000)
弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是最常见的侵袭性非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL),约占NHL的41%[1]。美罗华+环磷酰胺+阿霉素+长春新碱+泼尼松联合用药是目前DLBCL的标准治疗手段,可使患者5年生存率>71%[2],但因有明显毒副作用,且>1/3的患者治疗后会复发[3],不能实现对DLBCL的完全治疗。对于复发或难治性DLBCL患者,常需干细胞移植,但该法费用贵,供体难寻,排斥率高,有较大风险,且往往只能缓解症状,不能彻底治愈[4]。因此,寻找高效治疗DLBCL的替代药物一直是该领域研究的热点。
紫云英苷(astragalin)属于黄酮类化合物,普遍存在于药用植物中,有抗炎、抗氧化和保护心肌的功能[5-6]。有研究表明,astragalin可通过活化caspase-3而发挥抗黑色素瘤作用[7],但其抗DLBCL作用尚未见报道。因此,本研究拟观察astragalin对DLBCL细胞系OCI-LY8的作用及其分子机制。
材料和方法
1 实验材料
OCI-LY8细胞为本实验室所保存。清洁级BALB/c小鼠购自于浙江省实验动物中心,动物合格证号为SCXK(沪)2013-0016。Astragalin购自深圳市美荷生物科技有限公司;CCK-8为日本同仁公司产品;Hoechst 33342、BCA蛋白浓度测定试剂盒以及RIPA裂解液(强)均购自上海碧云天公司;AnnexinVFITC/PI双染试剂盒及脱脂奶粉购自BD;胎牛血清(fetal bovine serum,FBS)、RPMI-1640培养液以及胰蛋白酶均购自Gibco;Ⅰ抗和酶标Ⅱ抗购自武汉博士德生物技术公司;RT-qPCR引物源自上海生工生物公司;Trizol和SuperScript®ⅢFirst-Strand Synthesis System购自Invitrogen;ECL化学发光液购自Sigma。
2 方法
2.1 细胞培养用含10%FBS的RPMI-1640细胞培养液,将处于对数生长期的OCI-LY8细胞浓度调节至8×107/L,分别接种于96孔板(每孔100μL)和6孔板(每孔2 mL)中,均置于37℃、5%CO2条件下培养。
2.2 CCK-8法检测OCI-LY8细胞活力取上述96孔培养板,加入astragalin,使其终浓度分别为0、1、5、25和125μg/L,孵育0、24、48和72 h,设3复孔,加入CCK-8溶液每孔10μL,置于37℃、5%CO2饱和湿度条件下培养3 h,于490 nm波长下经酶标仪检测吸光度(A)值,分析OCI-LY8细胞活力,并作生长曲线。
2.3 Hoechst 33342染色观察OCI-LY8细胞核的变化取上述6孔培养板,加入astragalin,使其终浓度分别为0、5、25和125μg/L,设3复孔,37℃、5%CO2条件下孵育24 h后离心,弃上清,PBS洗3次,用10 μg/L Hoechst 33342染色,室温条件下避光染色10 min,PBS洗3次,加入50μL PBS,荧光倒置显微镜下观察OCI-LY8细胞核变化。
2.4 流式细胞术分析OCI-LY8细胞凋亡率取上述6孔培养板,加入astragalin,使其终浓度分别为0、5、25和125μg/L,设3复孔,继续培养24 h后离心,弃上清,PBS洗2次,用细胞凋亡死亡双染试剂盒染色15 min,PBS洗2次,用流式细胞术分析细胞凋亡和死亡率(试剂用量和染色方法按试剂说明书进行)。
2.5 RT-qPCR检测OCI-LY8细胞内mRNA的转录水平用含有0μg/mL和25μg/m Lastragalin的培养液孵育OCI-LY8细胞24 h,Trizol法提取细胞总RNA,经Nano Drop2000定量后,采用SuperScript®ⅢFirst-Strand Synthesis System逆转录生成cDNA(试剂用量和操作均按说明书进行)。以β-actin为内参,实时荧光定量PCR检测细胞p53、caspase-3、Bax、Bcl-2、JAK1、JAK2和STAT3的mRNA水平,经2-ΔΔCt法计算,分析各mRNA的相对水平。引物序列见表1。
2.6 Western blot分析蛋白水平的变化用含有0 μg/L和25μg/L astragalin的培养液分别孵育OCI-LY8细胞24 h,离心弃上清液,用PBS洗3次,加入适量细胞裂解液,提取蛋白,经蛋白定量试剂盒定量后以β-actin为内参照进行Western blot,观察OCI-LY8细胞p53、caspase-3、Bax和Bcl-2的蛋白表达及JAK1、JAK2和STAT3蛋白的磷酸化水平。

表1 RT-qPCR引物序列Table 1.The primer sequences for RT-qPCR
2.7 抑瘤实验取4周龄雄性BALB/c小鼠,随机分为6组,每组10只。在无菌条件下饲养1周以适应环境。取对数生长期的DLBCL细胞OCI-LY8,1 000 r/min离心5 min,去上清,PBS清洗3次,完全去上清液,将细胞沉淀并用生理盐水稀释成2×1010/L,于小鼠腹股沟皮下注射0.5 mL细胞悬液。注射3 d后,各组小鼠分别每天灌胃0、5、25、125、625和3 125 μg/kg剂量的astragalin,10 d后杀鼠,取瘤组织称重,分析该药的抑瘤作用。
3 统计学处理
用SPSS 19.0软件处理实验数据。实验数据用均数±标准差(mean±SD)表示,多组间差异的比较用单因素方差分析,以P<0.05表明差异有统计学意义。
结 果
1 Astragalin抑制OCI-LY8细胞的活力
分别经0、1、5、25和125μg/L的astragalin作用OCI-LY8细胞0 h、24 h、48 h和72 h,结果如图1所示,astragalin能显著抑制OCI-LY8细胞的活力,且作用效果随用药剂量和用药时间的增加而增强。

Figure 1.The results of viability by CCK-8 assay.OCI-LY8 cells were treated with 0,5,25 and 125μg/L astragalin.Mean±SD.n=3.*P<0.05,**P<0.01 vs0μg/L group.图1 CCK-8法检测细胞活力
2 Astragalin导致OCI-LY8细胞核型改变
经0、5、25和125μg/L的astragalin分别作用OCI-LY8细胞24 h,结果如图2所示,经5、25和125 μg/L astragalin作用后的OCI-LY8细胞,出现细胞核染色质浓集、核碎裂现象,形成凋亡小体,且作用效果随用药剂量的增加而增强。
3 Astragalin上调OCI-LY8细胞的细胞凋亡水平
分别经0、5、25和125μg/L的astragalin作用OCI-LY8细胞24 h,流式细胞术检测结果显示,astragalin可诱导OCI-LY8细胞凋亡,且作用效果随用药剂量的增加而增加(P<0.01),见图3。
4 Astragalin改变OCI-LY8细胞各基因的mRNA水平
经25μg/L astragalin作用OCI-LY8细胞24h后,RT-qPCR检测结果显示,细胞内p53、caspase-3和Bax的mRNA水平显著上调,而Bcl-2、JAK1、JAK2和STAT3的mRNA水平显著下降(P<0.01),见图4。
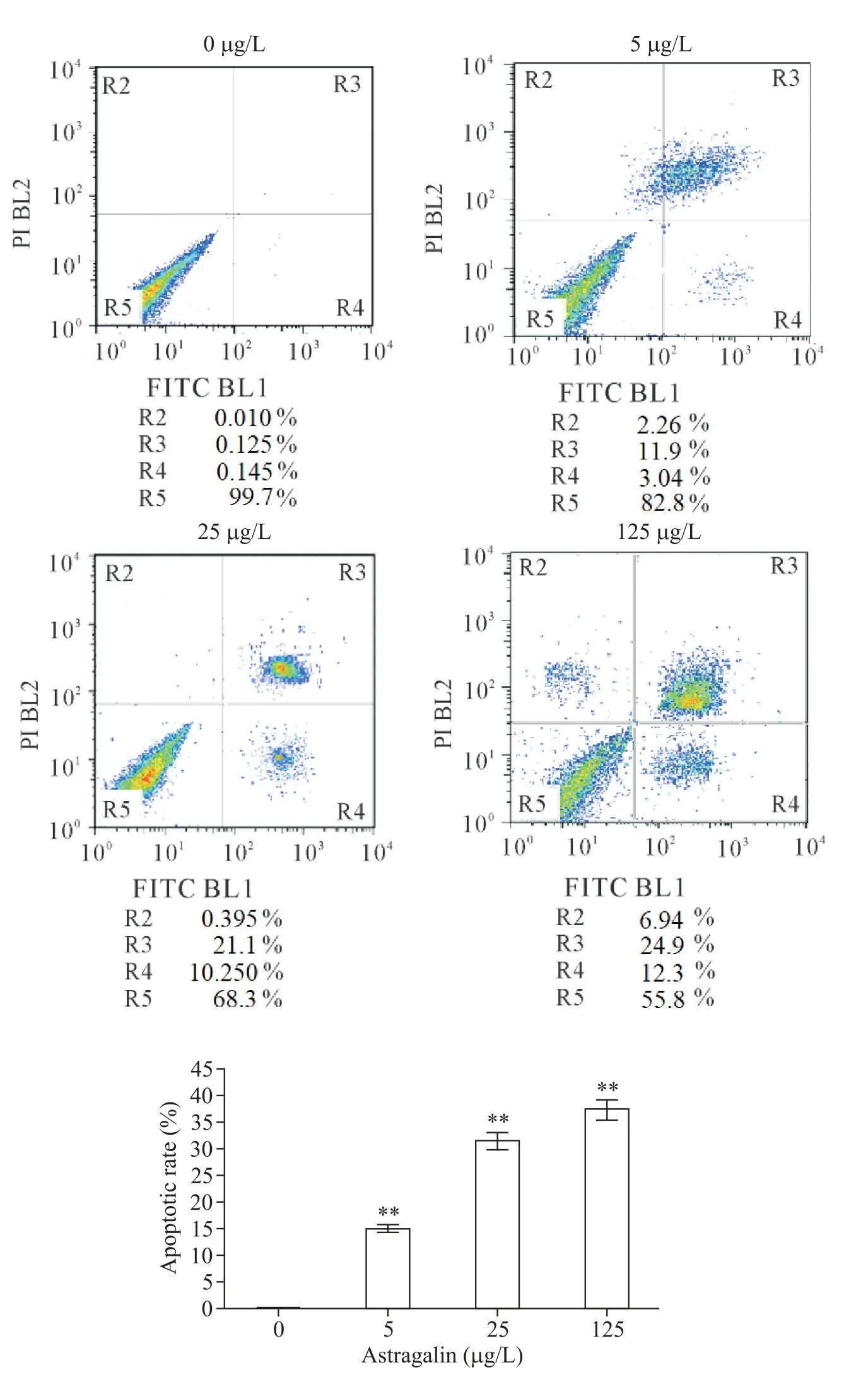
Figure 3.The results of apoptotic rate examined by flow cytometry.OCI-LY8 cells were treated with 0~125μg/L astragalin.Mean±SD.n=3.**P<0.01 vs0μg/L group.图3 流式细胞术检测细胞凋亡率的结果
5 Astragalin改变OCI-LY8细胞的蛋白水平
经25μg/L astragalin作用OCI-LY8细胞24h后,Western blot检测结果显示,astragalin可显著上调OCI-LY8细胞内p53、caspase-3和Bax蛋白水平,并下调蛋白Bcl-2的蛋白水平及JAK1、JAK2和STAT3的磷酸化水平,见图5。
6 Astragalin抑制DLBCL生长
抑瘤实验结果显示,astragalin可显著抑制荷瘤小鼠肿瘤的生长,且作用效果随用药剂量的增加而增强(P<0.01),见图6。
讨 论
JAK/STAT信号通路主要由酪氨酸激酶相关受体、酪氨酸激酶JAK以及转录因子STAT三组分构成[8],近年来越来越多的资料证实,该信号通路可作为肿瘤治疗药物的靶点[9-11]。研究表明,JAK1和JAK2在经某种外界刺激后的磷酸化水平受抑,而活性降低的JAK1和JAK2可抑制STAT3蛋白在细胞内募集,并下调STAT3蛋白活性[12-13],p-STAT3下降可改变线粒体跨膜蛋白,导致Bax与Bcl-2同源二聚体比例增加,增强线粒体膜的通透性,诱导细胞色素C自线粒体中释放出来,上调凋亡终末效应分子caspase-3的表达水平,促进肿瘤细胞发生凋亡,从而发挥抗肿瘤的作用[12-13]。
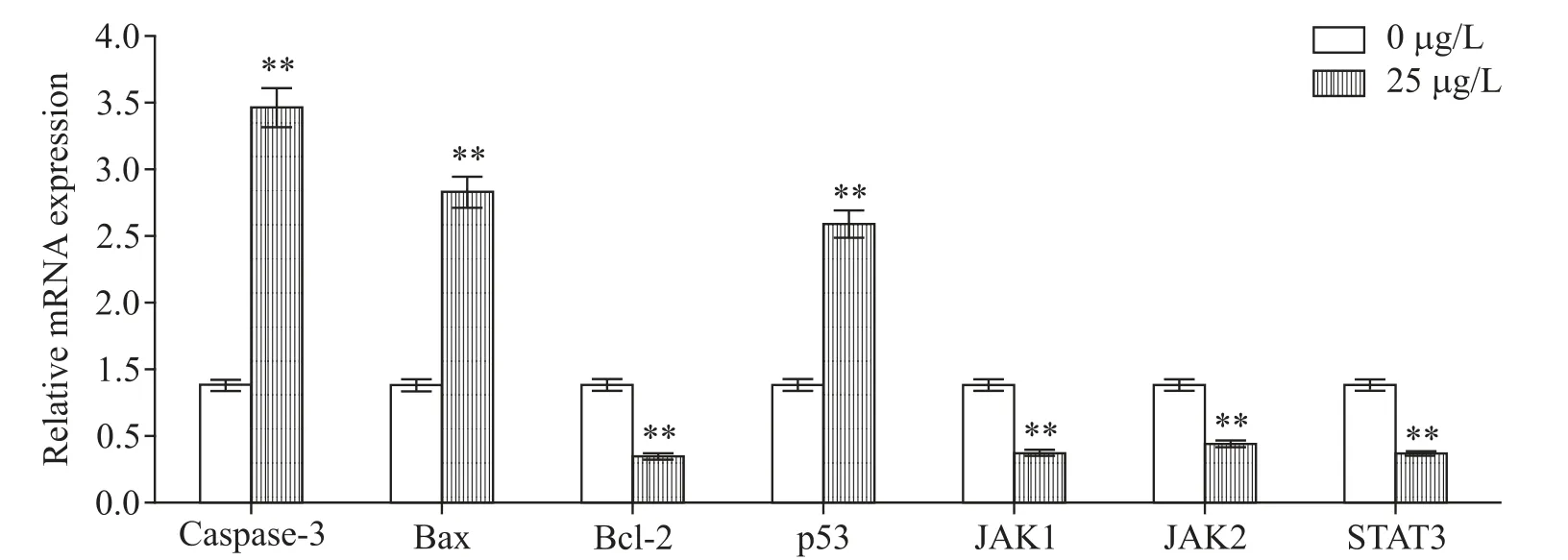
Figure 4.The results of RT-qPCR.OCI-LY8 cells were treated with 0 and 25μg/L astragalin.Mean±SD.n=3.**P<0.01 vs0μg/L group.图4 RT-qPCR检测结果
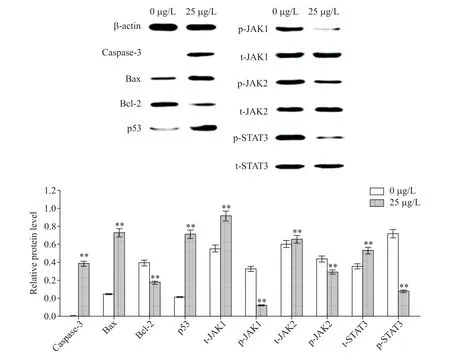
Figure 5.The results of Western blot.OCI-LY8 cells were treated with 0 and 25μg/L astragalin.Mean±SD.n=3.**P<0.01 vs 0 μg/L group.图5 Western blot检测结果
本实验将astragalin作用于DLBCL细胞OCILY8,经CCK-8法、Hoechst 33342染色和流式细胞术证实,astragalin可抑制OCI-LY8细胞活力并诱导其凋亡。同时RT-qPCR以及Western blot实验结果显示,细胞内p53、caspase-3和Bax蛋白水平显著上调,Bcl-2蛋白含量及JAK1、JAK2和STAT3蛋白磷酸化水平显著下降,因此,astragalin可抑制JAK/STAT信号通路的活化。同时当astragalin作用于OCI-LY8细胞后,p53蛋白水平显著上调。p53是一种抑癌基因,它不仅可以激活Fas和TNF介导的外源性凋亡途径,同时能激活线粒体途径来诱导肿瘤细胞发生凋亡[14-15]。故而,在本研究中p53协同JAK/STAT信号通路发挥着抗DLBCL细胞OCI-LY8的作用。此外,小鼠抑瘤实验也进一步证实astragalin的抑癌作用。
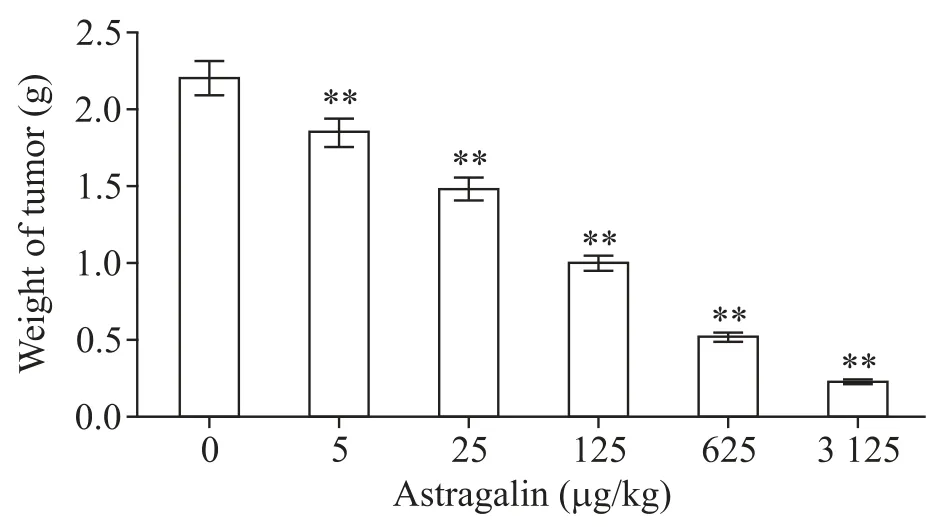
Figure6.The results of tumor inhibiting experiment.Mean±SD.n=10.**P<0.01 vs0μg/kg group.图6 荷瘤小鼠抑瘤实验检测结果
综上所述,astragalin可通过上调p53的表达和影响JAK/STAT信号通路,来抑制DLBCL细胞OCI-LY8活力,并诱导其发生凋亡,为抗DLBCL替代药物的研发提供了重要依据。
- 中国病理生理杂志的其它文章
- ERK信号通路介导的EP300过表达在苯肾上腺素诱导小鼠心肌细胞肥大中的作用*
- 益肾通络方对大鼠勃起功能障碍及NO-cGMP通路的影响*
- 静脉注射SCAD重组腺病毒减轻自发性高血压大鼠心肌肥厚和纤维化*
- Thioredoxin-interacting protein contributesto cardiac fibrosisby elevating oxidative stress in cardiac fibroblasts*
- 延髓头端腹内侧部NADPH氧化酶2激活导致活性氧簇释放在皮肤/肌肉切开和牵拉引起的慢性术后疼痛中的作用*
- 干扰海马spastin表达通过抑制突触传递介导小鼠认知功能障碍*

