昆虫滞育表观遗传调控的研究进展
安颢敏, 刘 文, 王小平
(华中农业大学植物科学技术学院, 昆虫资源利用与害虫可持续治理湖北省重点实验室, 武汉 430070)
周期性的季节变化驱动生物在长期进化过程中形成休眠(dormancy)等现象(Guppy and Withers, 1999; Lennon and Jones, 2011)。生物在休眠期一般具有更强的环境耐受性,能够在恶劣环境中延续种群。休眠表型的形成往往需要环境信号的诱导(Boonetal., 2001; Lennon and Jones, 2011)。 表观遗传(epigenetics)可能参与生物休眠调节(Shuetal., 2016; Rossarietal., 2020)。在植物种子休眠诱导期,多种表观遗传调控因子显著上调,与内源植物激素耦联调控种子休眠(Kallioo and Piiroinen, 1959; Sondheimeretal., 1968; Liuetal., 2011)。 小鼠Musmusculus和秀丽隐杆线虫Caenorhabditiselegans染色质修饰水平能够响应休眠诱导信号,进而调控其休眠或滞育(Demoinetetal., 2017; Husseinetal., 2020)。
昆虫滞育是休眠的一种类型,是受遗传调控的一种特定的发育,一旦进入滞育需要完成滞育发育才能受温度、湿度等环境条件影响而解除滞育。昆虫滞育可分为专性滞育(obligatory diapause)和兼性滞育(facultative diapause),所有专性滞育的发生不取决于环境条件,而兼性滞育的发生需要温度、光周期等环境信号的诱导(Danks, 1987)。依据滞育发生的时期,昆虫滞育又可分为卵滞育或胚胎滞育(egg/embryonic diapause)、幼虫滞育(larval diapause)、蛹滞育(pupal diapause)、成虫滞育或生殖滞育(adult/reproductive diapause)(Danks, 1987)。滞育过程包括滞育前期(pre-diapause)、滞育期(diapause)和滞育后期(post-diapause),其中滞育前期包括滞育诱导和准备,滞育期包括滞育启动、维持和解除,滞育后期包括滞育后静止和滞育后发育(Denlinger, 2002; Koštál, 2006)。昆虫在滞育诱导期感受环境变化,其体内的胰岛素(insulin)、保幼激素(juvenile hormone, JH)和蜕皮激素(ecdysterone)等响应滞育诱导期的环境信号,调控滞育准备;昆虫在滞育准备期积累营养物质供完成滞育过程、渡过不良环境(Hahn and Denlinger, 2011)。滞育诱导和准备这两个时期深刻影响昆虫滞育的进入与终止以及滞育后的发育和存活,是昆虫滞育机制研究的关键(Koštál, 2006; Hahn and Denlinger, 2011)。
昆虫的发育与滞育由分子水平的变化决定(Denlinger, 2002)。环境信号是诱导昆虫非遗传多型(polyphenism)现象的关键(Hartfelder and Emlen, 2005),这种环境信号诱导的生物发育可塑性与表观遗传息息相关(Glastadetal., 2019)。表观遗传是不依赖DNA序列的改变所产生的可遗传的变异(Bonasioetal., 2010),受到多种环境信号的调控(Rando, 2012)。表观遗传机制包括核小体定位(nucleosome positioning)、染色质重塑(chromatin remodeling)、组蛋白修饰(histone modification)、DNA甲基化(DNA methylation)、RNA可变剪接(alternative RNA splicing)、非编码RNA(noncoding RNA)、RNA修饰(RNA modification)和假基因(pseudogene)等(蔡禄, 2012; 杨莹等, 2018; Reynolds, 2019; Yaoetal., 2019)。在昆虫中,表观遗传可能参与其变态发育、寿命、生殖和性别决定(Suhetal., 2015; Cardoso-Júnioretal., 2018; Zhangetal., 2018; Kirfeletal., 2020; Pengetal., 2020),也可能调控昆虫滞育。目前报道了昆虫DNA甲基化可以响应光周期信号(Pegoraroetal., 2016; Delaneyetal., 2017),组蛋白乙酰化可以耦联昆虫内分泌信号(Georgeetal., 2019; George and Palli, 2020; Lyuetal., 2020),可能是昆虫滞育调控的重要环节。组蛋白修饰、DNA甲基化、RNA甲基化和非编码RNA等表观遗传过程参与昆虫滞育调控已见诸报道。本文从不同类型昆虫滞育表观遗传调控的角度综述了近年来这一领域的研究进展,以期为深入开展昆虫滞育调控机制研究提供帮助。
1 卵滞育或胚胎滞育调控
昆虫卵滞育可以发生在胚胎发育的任何阶段,在直翅目、鳞翅目和双翅目昆虫中较为常见。卵滞育分为母体分泌的滞育激素(diapause hormone, DH)调控和胚胎自身合成激素调控两类(Denlingeretal., 2005)。家蚕Bombyxmori分泌的滞育激素是一种神经肽,由母体脑—咽下神经节在卵成熟期合成并释放;DH作用卵巢后诱导形成滞育卵(Denlingeretal., 2005)。组蛋白乙酰化、DNA甲基化、RNA甲基化和miRNA对昆虫卵滞育具有潜在的调控作用(图1: A)。

图1 表观遗传参与昆虫卵滞育调控Fig. 1 Epigenetics involved in regulation of insect egg diapauseA: 昆虫卵滞育涉及的表观遗传调控机制:组蛋白乙酰化(Reynolds and Hand, 2009);DNA甲基化(Sasibhushan et al., 2013; Li et al., 2019);RNA甲基化(Jiang et al., 2019);miRNA(Fan et al., 2017)。不同线条表示不同类型的表观遗传调控机制,线条的高度表示同种修饰类型在不同滞育时期的变化过程而非不同表观遗传调控机制之间的水平差异(图2~4同)。Epigenetic regulation mechanisms involved in insect egg diapause, including histone acetylation (Reynolds and Hand, 2009), DNA methylation (Sasibhushan et al., 2013; Li et al., 2019), RNA methylation (Jiang et al., 2019), and miRNA (Fan et al., 2017). Different lines indicate different types of epigenetic regulations, and the height of lines indicates change process of the same type of epigenetic regulation in different diapause periods but not the horizontal differences among different epigenetic regulations (the same for Figs. 2-4). B: 家蚕RNA甲基化能够响应DH水平,低水平的DH和盐酸可以降低家蚕RNA甲基化水平从而解除滞育(Jiang et al., 2019)。RNA methylation in the silkworm can respond to DH level, and low levels of DH and HCl can reduce RNA methylation and relieve diapause of the silkworm (Jiang et al., 2019). C: 盐酸可以解除家蚕卵滞育,引起家蚕滞育卵中miRNA差异表达(Fan et al., 2017)。HCl can relieve egg diapause and cause different expression levels of miRNAs in diapause eggs of the silkworm (Fan et al., 2017). D: 盐酸可能通过抑制miR-2761-3p活性从而激活SDH功能最终解除家蚕滞育(Rubio et al., 2011; Fan et al., 2017)。HCl may activate the silkworm SDH by inhibiting miR-2761-3p activity, and finally relieve diapause (Rubio et al., 2011; Fan et al., 2017). DH: 滞育激素Diapause hormone; SDH: 山梨醇脱氢酶Sorbitol dehydrogenase.
组蛋白乙酰化促进异染色质向常染色质变构,高乙酰化水平通常与转录激活有关(Drazicaetal., 2016),但也有研究发现组蛋白乙酰化水平的升高能引起基因转录的抑制。转录抑制子Reptin是组蛋白乙酰转移酶Tip60的活性亚基,其促进组蛋白乙酰化,但是起到基因转录抑制的作用(Qietal., 2006)。在南方地蟋Allonemobiussocius滞育前Reptin表达上调两倍,进入滞育后又被显著下调(Reynolds and Hand, 2009)。Tip60介导的组蛋白乙酰化可能参与抑制滞育准备相关基因的表达,这些基因(如脂质降解酶基因等)的下调可能参与滞育准备期的物质积累,在滞育维持中这些基因的转录可能被重新激活。
DNA甲基化可能参与家蚕卵滞育调控。在家蚕滞育卵中DNA甲基转移酶表达水平较高,推测其参与家蚕的卵滞育维持(Sasibhushanetal., 2013)。不过家蚕二化品系中发现DNA甲基转移酶基因BmDnmt1和BmDnmt2的表达可以被盐酸诱导,而盐酸可以解除家蚕卵滞育(Lietal., 2019)。Dnmt1和Dnmt2主要参与维持DNA甲基化(maintenance of DNA methylation)(Ooietal., 2007),暗示高水平的DNA甲基化是家蚕卵滞育解除的关键。此外,无论在何种光周期条件下饲喂DNA甲基转移酶抑制剂5-氮杂胞嘧啶核苷(5-azacytidine),都不能改变光周期对家蚕卵滞育的影响(Egietal., 2016)。DNA甲基化对家蚕卵滞育的调控作用需要进一步明确。
RNA修饰参与昆虫滞育调控的研究非常有限,目前仅在家蚕卵滞育调控中有所报道。选取的4种不同化性品系AK4(一化)、Qiufeng(二化)、NH(多化滞育)和Nistari(多化非滞育)中,RNA m6A甲基化相关的Mettl3,Mettl14,Wtap/fi(2)d,Ythdc1和Ythdf3基因在蛹和成虫的卵巢、头部和卵中表达模式各不相同,表现出一定的化性相关性。相较一化和多化品系,二化品系家蚕RNA m6A相关基因的表达更为多变,可能一化和多化品系具有更为稳定的滞育特性,较少受到外界因素的影响。m6A相关基因在家蚕蛹和成虫期表达模式的差异表明m6A可能参与了家蚕的滞育准备;而酸处理和低浓度的DH处理能够显著降低卵和BmN(家蚕卵巢细胞)细胞的m6A水平,暗示低水平m6A是家蚕卵滞育解除的因素之一;而高浓度的DH则与高水平m6A相关,推测高水平m6A参与家蚕的卵滞育维持(Jiangetal., 2019)(图1: B)。
miRNA也是调控家蚕卵滞育的候选因子。相比滞育卵,盐酸解除滞育后有61个miRNA表达模式发生了显著变化,其中23个miRNA表达上调,38个下调(图1: C),这些miRNA的潜在靶基因可能参与调控蛋白质生产、加工和运输(Fanetal., 2017),可能与滞育维持分子事件相关。高通量测序结果暗示山梨醇脱氢酶(sorbitol dehydrogenase, SDH)和Bmo-miR-2761-3p表达负相关(Fanetal., 2017),SDH是家蚕利用山梨醇(glycogen)合成糖原的关键酶(Rubioetal., 2011)。双荧光素酶报告分析显示,Bmo-miR-2761-3p能够抑制BmSdh的表达;盐酸处理后BmSdh表达显著上调,而Bmo-miR-2761-3p显著下调(Fanetal., 2017),暗示miR-2761-3p对BmSdh的转录活性抑制是家蚕卵滞育维持期重要的分子事件(图1: D)。
从表观遗传调控家蚕卵滞育的研究中不难发现,多种表观遗传机制可能共同调控其滞育,调控的时期似乎也类似。这些表观遗传调控过程发生在染色体、DNA和RNA等不同水平,在滞育调控中具有不同的生物学功能,可能各自发挥作用,也可能协同调控滞育相关的核心过程,例如DH的合成或靶标细胞对DH的响应等。目前,关于表观遗传调节卵滞育的研究主要是相关性层面的工作,尚缺乏功能性验证研究。因此,哪些表观遗传调控过程在卵滞育调控中发挥关键作用仍不明确,需要进一步深入研究。
2 幼虫滞育调控
幼虫滞育在鳞翅目昆虫中较为常见,大多数幼虫滞育的昆虫以末龄幼虫进入滞育,也有初龄幼虫滞育的报道(Denlingeretal., 2005)。在滞育诱导条件下,高浓度的JH抑制促前胸腺激素(prothoracicotropic hormone, PTTH)的释放,PTTH缺乏导致蜕皮激素合成受阻,从而抑制幼虫变态,昆虫发育停滞在幼虫阶段。因此,JH合成上调和蜕皮激素缺乏是幼虫滞育的关键(Bogus and Scheller, 1996; Denlingeretal., 2005)。组蛋白乙酰化、组蛋白甲基化、DNA甲基化、siRNA和miRNA可能参与昆虫的幼虫滞育(图2: A)。
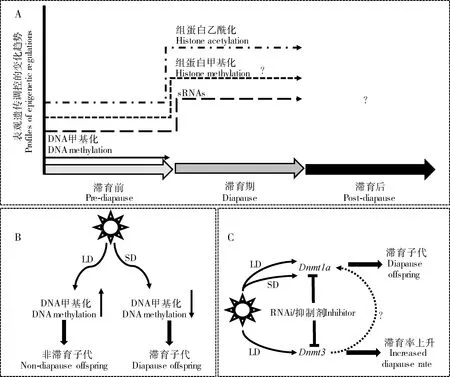
图2 表观遗传参与昆虫幼虫滞育调控Fig. 2 Epigenetics involved in regulation of insect larval diapauseA: 昆虫幼虫滞育涉及的表观遗传调控机制:组蛋白乙酰化(Santos et al., 2018);组蛋白甲基化(Poupardin et al., 2015; and Koštál, 2017);DNA甲基化(Pegoraro et al., 2016);sRNAs(Poupardin et al., 2015; Batz et al., 2017)。Epigenetic regulation mechanisms involved in insect larval diapause, including histone acetylation (Santos et al., 2018), histone methylation (Poupadin et al., 2015; and Koštál, 2017), DNA methylation (Pegoraro et al., 2016), and sRNAs (Poupadin et al., 2015; Batz et al., 2017). B: 丽蝇蛹集金小蜂雌蜂DNA甲基化水平能够响应光周期信号(Pegoraro et al., 2016)。DNA methylation of female wasp of Nasonia vitripennis was able to respond to photoperiodic signals (Pegoraro et al., 2016). C: Dnmt1a介导的DNA维持甲基化是子代丽蝇蛹集金小蜂滞育的关键;而Dnmt3介导的DNA从头甲基化可能最先响应光周期信号的变化;但这一分子过程的具体机制尚不清晰(Pegoraro et al., 2016)。Maintenance of DNA methylation mediated by Dnmt1a is the key to diapause of N. vitripennis, and de novo DNA methylation mediated by Dnmt3 may be the first to respond to photoperiodic signals; however, specific mechanism of the process is still unclear (Pegoraro et al., 2016). LD: 长日照Long day; SD: 短日照 Short day.
独居采油蜂Tetrapediadiversipes是一种生活在热带的独居蜂,一年两化,在雨季发生的第1代不滞育,旱季发生的第2代以5龄幼虫进入滞育(Santosetal., 2018)。滞育期幼虫组蛋白乙酰转移酶基因Kat7、组蛋白基因H3和邻近锌指溴结构域蛋白2B(bromodomain adjacent to zinc finger domain protein 2B, BAZ2B)基因表达显著上调,而组蛋白基因H2A和H2B表达下调(Santosetal., 2018)。KAT7属于MYST家族,主要催化H4组蛋白乙酰化修饰(Drazicaetal., 2016);包含溴尿嘧啶结构域的BAZ2B是组蛋白乙酰化修饰的阅读器,能够与乙酰化修饰的组蛋白发生互作,尤以与组蛋白H3的互作最强(BAZ2B与H3的转录活性一致也印证了这一观点)(Filippakopoulosetal., 2012)。表明KAT7介导的H4乙酰化和BAZ2B相关的H3乙酰化修饰参与该蜂的幼虫滞育维持,组蛋白乙酰化水平的升高可能伴随滞育维持期基因转录的变化,至于究竟影响了哪些基因的表达尚需进一步研究。
丽蝇蛹集金小蜂Nasoniavitripennis的滞育受到母体调控,以幼虫进入滞育(Saunders, 1965)。雌性丽蝇蛹集金小蜂DNA甲基化水平在不同的光周期条件下显著不同,表明母体DNA甲基化水平能够响应环境光周期信号(图2: B);且无论在何种光周期下,通过RNAi干扰DNA甲基转移酶基因Dnmt1a或饲喂5-氮杂胞嘧啶核苷都会诱导雌蜂产生滞育后代,敲低Dnmt3表达则会增加长光照下该蜂的滞育率(Pegoraroetal., 2016)。Dnmt3与从头DNA甲基化(denovoDNA methylation)相关(Ooietal., 2007),提示低水平维持DNA甲基化是参与丽蝇蛹集金小蜂滞育诱导的主要因素,而从头甲基化水平的降低可能最先响应光周期信号(图2: C)。这是由DNA甲基化过程决定的,从头DNA甲基化不需要模板链上存在甲基化修饰,而维持甲基化需要模板链上已经存在的甲基化修饰指导(Ooietal., 2007)。

miRNA也可能参与幼虫滞育调控。滞育诱导条件下,白纹伊蚊Aedesalbopictus卵母细胞miRNA丰度没有明显变化,表明miRNA并不作为跨代的表观遗传信号参与白纹伊蚊滞育诱导,而在滞育幼虫中miRNA丰度发生了显著变化,表明miRNA可能参与白纹伊蚊的幼虫滞育维持;这些丰度发生变化的miRNA可能参与发育停滞、胁迫耐受、免疫应答和代谢调控,可能与白纹伊蚊滞育维持分子事件相关(Batzetal., 2017)。
表观遗传调控的最终结果是基因的程序性表达,目前的研究尚未明确表观遗传作用幼虫滞育相关靶标基因效应元件的位点和过程。与表观遗传调控家蚕卵滞育类似,不同表观遗传过程可能同时参与C.costata的幼虫滞育调控,进一步提示表观遗传调控昆虫滞育存在协同。另外,在昆虫幼虫滞育调控中并未发现表观遗传能够耦联JH和蜕皮激素等幼虫滞育调控的关键激素信号,因此需要进一步拓展表观遗传响应或诱导昆虫幼虫滞育内分泌信号的研究。
3 蛹滞育调控
蛹滞育在鳞翅目和双翅目昆虫中较为常见。滞育诱导条件下PTTH合成受阻,PTTH缺乏进一步降低20-羟基蜕皮酮(20-hydroxyecdysone, 20E)合成,低水平的PTTH和20E是昆虫蛹滞育的内分泌基础(Denlingeretal., 2005)。表观遗传参与昆虫蛹滞育调控的研究较多,组蛋白乙酰化、组蛋白去甲基化和miRNA可能参与昆虫蛹滞育调控(图3: A)。
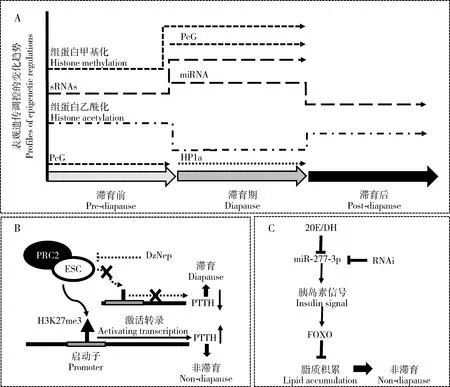
图3 表观遗传参与昆虫蛹滞育调控Fig. 3 Epigenetics involved in regulation of insect pupal diapauseA: 昆虫蛹滞育涉及的表观遗传调控机制:多梳蛋白家族(PcG)(Lu et al., 2013; Yocum et al., 2015);异染色质蛋白(HP1a) (Reynolds, 2017);组蛋白乙酰化(Reynolds et al., 2016);组蛋白甲基化(Reynolds et al., 2013);sRNAs(Reynolds et al., 2016);miRNA(Reynolds et al., 2017, 2019)。Epigenetic regulation mechanisms involved in insect pupal diapause, including polycomb group (PcG) (Lu et al., 2013; Yocum et al., 2015), heterochromatin protein 1a (HP1a) (Reynolds, 2017), histone acetylation (Reynolds et al., 2016), histone methylation (Reynolds et al., 2013), sRNAs (Reynolds et al., 2016), and miRNA (Reynolds et al., 2017, 2019). B: 棉铃虫PRC2介导PTTH启动子H3K27me3能够调节PTTH水平从而调控其滞育(Lu et al., 2013)。PRC2 mediated PTTH promoter H3K27me3 in Helicoverpa armigera can regulate PTTH level and then regulate diapause (Lu et al., 2013). C: miR-277-3p通过抑制转导到胞内的胰岛素信号抑制FOXO的核输出,进而促进脂质积累,最终导致美洲棉铃虫进入滞育;对miR-277-3p的抑制可能是蛹滞育昆虫解除滞育的关键(Ling et al., 2017; Reynolds et al., 2019)。miR-277-3p inhibits nuclear output of FOXO by inhibiting insulin signal transduction into the cell, thus promoting lipid accumulation, and eventually leading to diapause in Helicoverpa zea; inhibition of miR-277-3p may be the key for diapause elimination of pupal diapause insects (Ling et al., 2017; Reynolds et al., 2019). DzNep: PRC2抑制剂 PRC2 inhibitor; PTTH: 促前胸腺激素Prothymocytic hormone; 20E: 20-羟基蜕皮酮20-Hydroxyecdysone; DH: 滞育激素Diapause hormone; RNAi: RNA干扰RNA interference; FOXO: O型插头转录因子Forkhead box O.
多梳蛋白家族(polycomb group, PcG)是一种转录抑制子,通过组蛋白的翻译后修饰影响染色质结构,进而沉默相关基因的表达;PcG蛋白在进化上具有良好的保守性,主要包括两个参与不同组蛋白修饰过程的蛋白,即参与H2AK119Ub的PRC1(polycomb repressive complex 1)和H3K27me3的PRC2(Reynoldsetal., 2017)。PcG家族的功能实现需要与转录激活子三胸蛋白家族(trithorax group, TrxG)相互拮抗,这一过程需要组蛋白甲基化修饰的参与(Kennison, 1995; Ringrose and Paro, 2007; Schwartz and Pirrotta, 2007)。
在棉铃虫Helicoverpaarmigera蛹滞育中,定位于PTTH神经分泌细胞的PRC2亚基ESC(extra sex comb)在非滞育蛹脑中表达高于滞育期蛹脑(Luetal., 2013);而PRC2是H3K27me3的关键修饰调控因子(Ringrose and Paro, 2004; Campos and Reinberg, 2009)。ESC能够激活棉铃虫PTTH启动子,表明PRC2介导的H3K27me3在PTTH启动子上富集;向非滞育蛹注射PRC2抑制剂DzNep后,H3K27me3水平降低,PTTH表达下调,处理蛹表现出滞育状态,表明PRC2介导低水平H3K27me3是棉铃虫蛹滞育诱导的关键(Luetal., 2013)(图3: B)。在苜蓿切叶蜂Megachilerotundata蛹滞育调控中,滞育的预蛹中有5个上调的PcG家族基因,包括Bmi-1(BLymphomaMo-MLVInsertionRegion1),E(pc)(enhancerofpolycomb),Psc(posteriorsexcomb),Asx(additionalsexcomb)和Scm(sexcombonmidleg)(Yocumetal., 2015),暗示PcG参与了苜蓿切叶蜂滞育维持。此外,siRNA相关的Ago-2基因也参与了苜蓿切叶蜂的滞育维持(Yocumetal., 2015),表明多种表观遗传修饰调控可能同时参与某一昆虫的蛹滞育过程。
表观遗传参与昆虫蛹滞育调控在麻蝇Sarcophagabullata中的研究较为丰富。异染色质蛋白1a(heterochromatin protein 1a, HP1a)可能参与麻蝇的蛹滞育调控。相比非滞育蛹,滞育蛹中HP1a表达下调近50%(Reynolds, 2017)。HP1家族是一类保守的表观遗传调控因子,通过与H3K9me3互作促进异染色质结构域(如端粒和着丝粒)的形成;HP1还可以结合常染色质并与其他蛋白质(如组蛋白去甲基酶dKDM4A)或RNA互作,从而调控基因转录(Meisteretal., 2011; Reynolds, 2017)。HP1a的下调促进滞育蛹异染色质向常染色质变构,可能参与滞育维持相关基因的转录激活。
组蛋白H3乙酰化水平降低是一些物种的滞育特征(Denlinger, 2002)。组蛋白H3乙酰化能够参与麻蝇的蛹滞育诱导、维持和解除,表明低水平组蛋白H3乙酰化可能是麻蝇蛹滞育调控的关键(Reynoldsetal., 2016)。尽管总的H3乙酰化水平降低,但参与去乙酰化过程的相关基因Hdac3,Hdac6,Sirt1和Sirt2表达并没有明显上调(Reynoldetal., 2016),因此介导滞育过程中H3去乙酰化的调节机制有待进一步研究。
组蛋白去甲基化可能参与麻蝇的蛹滞育调控。组蛋白去甲基化酶基因Lsd1和Su(var)3-9在注定滞育的幼虫中分别上调1.5和2倍(Reynoldsetal., 2013)。Lsd1和Su(var)3-9分别参与H3K4和H3K9的去甲基化过程(Czerminetal., 2001; Di Stefanoetal., 2007),表明低水平H3K4和H3K9甲基化可能参与麻蝇蛹滞育诱导。进入滞育后,相比正常发育的麻蝇,Lsd1和Su(var)3-9的表达又显著降低,表明一定水平的H3K4和H3K9甲基化可能有助于麻蝇的滞育维持。此外,miRNA相关的Ago-1,siRNA相关的Ago-2和R2D2以及piRNA相关的Piwi和Spindle-E均在滞育诱导条件下显著上调,表明小RNAs可能参与了麻蝇蛹滞育诱导(Reynoldsetal., 2013);一些miRNA还可以阻止麻蝇蛹进入滞育(Reynoldsetal., 2017),miRNA调控网络可能参与麻蝇的滞育决定。在麻蝇以外的多种昆虫中都发现miRNA参与调控蛹滞育。美洲棉铃虫Helicoverpazea的蛹滞育可以被20E, DH和DH类似物解除,对滞育蛹分别注射3种激素均导致胰岛素/FOXO通路相关的miR-277-3p显著下调(Reynoldsetal., 2019)。在埃及伊蚊Aedesaegypti中,干扰miR-277-3p能够激活胰岛素信号增强FOXO的核输出,从而导致脂肪体脂质减少(Lingetal., 2017)。miR-277-3p丰度的降低可能是一些昆虫解除滞育的关键(图3: C)。
表观遗传参与昆虫蛹滞育调控的研究较多,其中尤以麻蝇蛹滞育调控研究最为丰富。这些报道以相关性研究为主,机制研究较为欠缺,亟待深入研究。PRC2介导的棉铃虫PTTH启动子区H3K27me3能够影响其蛹滞育,这一研究表明滞育关键基因座及其调控子区域的表观遗传在昆虫的滞育调控中具有重要作用。在美洲棉铃虫蛹滞育调控中,20E和DH介导的胰岛素/FOXO相关miR-277-3p下调表明,耦联内分泌信号是表观遗传调控昆虫滞育的可能环节。综上,需要进一步探讨蛹滞育调控中表观遗传与内分泌信号之间的相互作用,以及表观遗传对滞育诱导环境信号的应答机制。
4 成虫滞育或生殖滞育调控
成虫滞育的昆虫主要表现为雌性卵巢和雄性附腺发育受到抑制,脂质大量积累,有些昆虫还具有钻土和寻找庇护所的行为特征(Danks, 1987)。目前认为,成虫滞育主要因JH缺乏引起(Denlingeretal., 2005; Liuetal., 2016)。昆虫脑感受滞育诱导环境信号后抑制咽侧体(corpus allatum, CA)合成JH,低水平JH作用卵巢后导致成虫滞育;反之,滞育解除或发育信号可以促进CA合成JH,高水平JH解除成虫滞育并促进生殖(Cadetal., 1987; Denlingeretal., 2005)。目前表观遗传参与昆虫成虫滞育调控的研究较少,在尖音库蚊Culexpipiens中的研究表明组蛋白去乙酰化、TrxG家族基因和miRNA可调控成虫滞育(图4)。
滞育诱导条件可能影响尖音库蚊的组蛋白乙酰化水平和染色质结构。低温短光照条件下尖音库蚊Sin3和NuRD复合体基因表达显著上调(Hickneretal., 2015),NuRD复合体具有核小体重构和去乙酰化能力(Clapier and Cairns, 2009),而Sin3本身即包括HDAC1和HDAC2两种去乙酰化酶活性(Reynoledsetal., 2017);表明滞育诱导条件可能降低尖音库蚊染色质乙酰化水平,进而促进染色质向异染色质变构,暗示组蛋白乙酰化和染色质重构与滞育诱导或滞育准备期相关基因的沉默有关。此外,20E合成基因Spook和Disembodied,以及TrxG家族基因亦显著上调(Hickneretal., 2015),TrxG与PcG拮抗能够调控果蝇Drosophila的寿命和应激反应(Sieboldetal., 2010);不过滞育诱导条件下尖音库蚊PcG家族基因的表达情况尚不明确,TrxG家族基因的上调可能参与尖音库蚊滞育诱导期对环境信号的响应,也可能参与滞育准备期相关分子事件(如脂质积累)的激活。
滞育的尖音库蚊成虫羽化后的第22天开始出现脂肪体和卵巢的生理表型,参与尖音库蚊脂质代谢和卵巢发育的相关miRNA在尖音库蚊成虫羽化第1天就表现出明显的表达差异,可能参与其滞育准备;进入滞育后,雌虫miRNA表达显著下调、丰度较低,可能参与其滞育维持(Meutietal., 2018)。表观遗传可能通过作用于内分泌信号、脂质代谢和卵黄原沉积调控成虫滞育。

图4 表观遗传参与昆虫成虫滞育的时期Fig. 4 Period of epigenetics involved in insect adult diapause涉及的表观遗传调控机制Epigenetic regulation mechanisms involved: 三胸蛋白家族Trithorax group (TrxG) (Hickner et al., 2015); 组蛋白乙酰化Histone acetylation (Hickner et al., 2015); miRNAs (Meuti et al., 2018).
5 小结与展望
目前的报道认为,组蛋白修饰、DNA甲基化、RNA甲基化和小非编码RNA均可能参与昆虫滞育调控,但其他类型表观遗传在昆虫滞育中的作用尚不明确,需要进一步拓展和补充。表观遗传在昆虫的滞育诱导、滞育准备、滞育维持和滞育解除调控中可能都有作用,现有的研究主要集中在卵滞育、幼虫滞育和蛹滞育昆虫中,在成虫滞育昆虫中的研究较少,亟待进一步研究。表观遗传调控的最终结果是靶标基因的程序性表达(Luetal., 2013; Geetal., 2017, 2018),现有的研究已经聚焦到表观遗传能够调控滞育相关基因的转录活性(Luetal., 2013; Batzetal., 2017; Fanetal., 2017),然而这些研究尚不足以揭示昆虫滞育表观遗传调控的分子机制。相比之下,更多的研究仅仅关注到滞育选择压力下和滞育期间昆虫表观遗传调控水平的差异,对于发展昆虫滞育的表观遗传调控理论作用有限,需要进一步明确昆虫滞育表观遗传调控的具体机制。
5.1 昆虫滞育表观遗传调控潜在的分子机制
滞育可以发生在昆虫发育的各个时期,无论是滞育还是发育调控都需要内分泌信号的准确调节。而表观遗传是一个系统性调控过程,在昆虫的各个发育时期都具有生物学功能。因此,表观遗传耦联内分泌调控是其调节滞育的可能方式。目前的研究已经关注到,组蛋白去乙酰化诱导20E合成基因表达(Hickneretal., 2015),并且参与JH功能(Georgeetal., 2019; George and Palli, 2020)。在赤拟谷盗Triboliumcastaneum中,组蛋白去乙酰化酶HDAC1和HDAC3通过影响JH应答基因Kr-h1(Krüppelhomolog1)的表达,调节变态发育(Georgeetal., 2019; George and Palli, 2020)。在家蚕中,施加外源20E能够激活Bm12细胞系环磷酸腺苷(cyclic adenosine monophosphate, cAMP)响应元件结合蛋白(cAMP responsive element binding protein, CREB)的表达,并诱导CBP(CREB binding protein)介导的组蛋白H3K27ac(Lyuetal., 2020)。上述研究均指向表观遗传可能耦联昆虫内分泌信号。然而表观遗传如何响应或诱导内分泌信号调控昆虫滞育尚需进一步深入研究。
表观遗传调控还需要许多信号通路参与,雷帕霉素靶蛋白(mechanistic target of rapamycin, mTOR)通路可能是滞育调控中耦联环境信号与表观遗传的关键环节。mTOR通路能够响应能量、生长因子和压力信号,调控细胞生长、增殖、发育和代谢(Markaki and Tavernarakis, 2013)。在黑腹果蝇D.melanogaster中,TOR活性降低能够显著增强FOXO活性从而破除胰岛素抵抗以延长果蝇寿命(Luongetal., 2006)。而胰岛素/TOR通路能够响应温度信号调控蟋蟀Modicogryllussiamensis的冬季若虫滞育(Mikietal., 2020)。TOR的活性下降可能与昆虫滞育启动相关(Wangetal., 2020)。在棉铃虫滞育蛹脑中,TOR和TOR相关蛋白Raptor显著下调,另一TOR相关蛋白P-S6K则显著上调;P-S6K能够响应上游活性氧(reactive oxygen species, ROS)和AKT并促进下游CREB与HIF-1α启动子结合,进而激活HIF-1α的表达;高水平HIF-1α能够显著降低滞育昆虫线粒体活性,从而静默昆虫能量代谢以诱导滞育进入,CREB激活HIF-1α表达可能伴随CBP介导的组蛋白乙酰化修饰(Wangetal., 2020)。
果蝇TORC1的激活需要瞬时受体电位类M通道蛋白(transient receptor potential channel M-like, TRPML)的介导(Wongetal., 2012),瞬时受体电位通道蛋白(transient receptor potential channels, TRPCs)可能在mTOR通路中发挥作用。生物钟系统是昆虫响应环境光周期的核心(Saunders, 2020),果蝇TRPCs可以耦联环境温度信号与生物钟系统(Wolfgangetal., 2013),且TRP复合体本身即可作为果蝇生理电信号的储存装置(Xuetal., 1997)。瞬时受体电位C1通道蛋白(transient receptor potential channel C1, TRPC1)介导的Ca2+信号流能够激活核内PCAF(P300/CBP-associated factor)介导的表观遗传修饰(Yapetal., 2019),表明TRPC1可能耦联环境信号和表观遗传调控,在昆虫滞育调控中可能扮演重要角色。瞬时受体电位A1通道蛋白(transient receptor potential channel A1, TRPA1)通过响应环境温度变化,从而介导家蚕滞育诱导(Satoetal., 2014)。在亲代卵期干扰BmTrpa1能够显著提高25℃(滞育诱导温度)下子代卵的非滞育率,TRPA1的缺失能够影响家蚕的滞育诱导进而影响亲代蛹期DH的释放(Satoetal., 2014)。尽管TRPCs作为生物感知环境信号的分子元件已是不争的事实(Venkatachalam and Montell, 2007),但TRPCs是否参与表观遗传调控昆虫滞育尚需证据加以支持。
5.2 未来的研究方向
昆虫滞育的表观遗传调控主要包括两个问题:一是滞育诱导的环境信号如何影响表观遗传;二是表观遗传如何作用昆虫滞育。未来应当重点开展:(1)表观遗传响应滞育诱导环境信号的分子机制研究;(2)表观遗传耦联内分泌调控的分子机制研究;(3)介导表观遗传调控的细胞信号转导研究;(4)表观遗传的协同调控在昆虫滞育中的功能研究。值得注意的是,表观遗传响应滞育诱导环境信号的时期远远早于滞育表型的形成时期,表观遗传信号经历多次积累、传递和转换,这种传递和转换可能伴随昆虫的变态发育和跨代调控。表观遗传可能作为滞育调控或发育决定的分子标志,解析表观遗传密码在滞育调控中的具体作用对于宏观理解昆虫滞育机制具有重大意义。
可以预见,表观遗传调控参与生物发育可塑性研究会全面进入机制研究阶段。以表观遗传为切入点,滞育调控为中心,明确表观遗传在滞育调控机制中的位置、响应滞育诱导环境信号具体过程、与滞育相关基因互作机制以及诱导或响应滞育内分泌调控过程将会是表观遗传调控昆虫滞育机制研究的核心内容。明确表观遗传参与昆虫滞育调控的具体机制是昆虫滞育研究的必经之路,对于了解生物休眠和生物发育具有重要意义,可以进一步发展和提高昆虫资源保护利用、害虫防控与综合治理等领域的技术与水平。
致谢感谢华中农业大学植物科学技术学院朱智慧副教授在本文撰写中提出的宝贵建议和意见。

