博来霉素诱导的小鼠肺纤维化组织中组蛋白3和组蛋白4乙酰化变化
李明玮,张永锋,霍 静
(1首都医科大学附属复兴医院风湿免疫科,北京 100038;2首都医科大学附属北京朝阳医院风湿免疫科;*通讯作者,E-mail:dr-limingwei@126.com)
肺纤维化(pulmonary fibrosis,PF)是多种慢性肺脏疾病常见的终末病理表现,也是慢性肺脏疾病死亡的主要原因。肺纤维化的发病机制仍不十分清楚,目前假说有损伤、炎症、修复障碍及各种原因导致的肺泡损伤(如氧化应激)等。但是,上述因素均不能完全阐明其发病机制。近10年,涉及组蛋白(histone)乙酰化/去乙酰化与脏器纤维化的研究逐渐进入人们的视线。脏器纤维化动物模型及临床试验均表明,组蛋白乙酰化是脏器保护机制[1-3]。肺纤维化初步研究证实,体外培养的肺纤维化患者肺成纤维细胞,组蛋白乙酰化水平下降[4]。因而,为深入探讨肺纤维化发病机制提供了全新的理念。
本研究拟通过博来霉素气管给药建立模拟肺纤维化的小鼠模型,在病程进展过程中,动态监测肺组织炎症/纤维化程度及组蛋白3和组蛋白4乙酰化水平,以明确肺纤维化过程中组蛋白3和组蛋白4乙酰化在肺组织炎症/纤维化过程中的变化情况,为探明肺纤维化潜在的机制变化,及后续靶点的寻找提供理论依据。
1 材料与方法
1.1 主要试剂
博来霉素A2(日本化药株式会社,日本),Masson染色试剂盒(索莱宝生物科技有限公司),苏木素伊红(HE)染色试剂盒(索莱宝生物科技有限公司),总组蛋白3抗体(CST,赛信通生物试剂有限公司,美国),总组蛋白4抗体(CST,赛信通生物试剂有限公司,美国),乙酰化组蛋白3抗体(CST,赛信通生物试剂有限公司,美国)和乙酰化组蛋白4抗体(CST,赛信通生物试剂有限公司,美国),PCNA抗体(碧云天生物技术有限公司),TBS溶液(索莱宝生物科技有限公司)。
1.2 肺纤维化的小鼠模型建立
6-7周龄雄性C57BL/6J小鼠,SPF级,购于北京维通利华实验动物技术有限公司(许可证号:SCXK(京)2012-0001),饲养于首都医科大学动物部(许可证号:SCXK(京)2015-0012)清洁级动物房。所有动物实验经首都医科大学动物实验及实验动物福利委员伦理审查通过(伦理编号:AEEI-2016-005)。独立通气笼盒(individual ventilated cages,IVC)系统,饲养密度<5只/笼,12 h光照/12 h黑暗,室温21-22 ℃,相对湿度50%-70%,自由饮水、摄食。
6-7周龄雄性C57BL/6J小鼠48只,随机分为博来霉素组、盐水组和正常对照组。腹腔注射10%水合氯醛(3.5 μl/g体质量)麻醉小鼠,单次气管内给药,博来霉素组给予博来霉素A2生理盐水溶液2.5 μl/g体质量(相当于5 mg/kg体质量)[5],盐水组给予生理盐水溶液2.5 μl/g体质量。自由喂养。于气管给药后第7,14,21天,各组随机选取动物依次处死、取肺。
1.3 组织学检查
将10%甲醛缓慢注入新鲜肺组织,至肺充盈涨大(内固定),迅速置于10%甲醛固定不低于24 h。将肺组织包埋在石蜡中,制备切片(4 μm),分别进行HE染色和Masson三色染色。
采用肺泡炎分级评分[5]评估HE染色肺泡炎症。100倍视野下,选取所有视野进行评分,视野选取应避开大气管与大血管,取所有视野评分值的均数作为该样本炎症评分,采用盲评方法。
Masson染色肺组织用于纤维化分级评分[6]。100倍显微镜下,拍摄所有视野照片,每个视野随机放大40倍显微照片一张,放大视野选取避开大气管与大血管,取所放大照片评分值的均数作为该样本纤维化分级评分,采用盲评方法。
1.4 组蛋白3、4乙酰化率检测
Western blot检测总组蛋白3(1 ∶1 000稀释,CST,#9715),总组蛋白4(1 ∶500稀释,CST,#2592),乙酰化组蛋白3(1 ∶1 000稀释,CST,#9649)和乙酰化组蛋白4(1 ∶500稀释,CST,#13534)的表达,以PCNA(1 ∶1 000稀释,碧云天,AF0261)作为内部参照,使目标蛋白表达标准化。使用SDS-PAGE(分离胶12%,积层胶5%)分离变性核蛋白样品(100 ℃,5 min;每个泳道50 μg)。通过电转印迹将蛋白转移到PVDF膜上。室温用含有5%脱脂奶粉的TBS溶液封闭2 h。在4 ℃下,一级抗体孵育过夜。加二级抗体是荧光羊抗兔IgG(1 ∶10 000)或荧光羊抗鼠IgG(1 ∶10 000),室温孵育2 h。使用Odyssey LI-COR SA双色红外激光成像系统扫描成像,分析蛋白条带。组蛋白乙酰化率=乙酰化组蛋白/总组蛋白。
1.5 统计学分析

2 结果
2.1 实验小鼠一般情况
小鼠造模后饲养过程中,存在自然死亡,博来霉素组死亡8只、盐水组死亡2只、空白对照组死亡0只。博来霉素组4只小鼠发生下肢运动障碍,均伴有下肢皮肤紫绀、脱毛、肌肉萎缩、皮温厥冷。
2.2 肺泡炎评分
通过对小鼠肺组织进行HE染色观察各组肺泡炎情况,结果发现,肺泡炎症博来霉素组明显重于盐水组,博来霉素组广泛肺泡结构破坏,肺泡间隔明显增厚,实质区明显增多,肺泡内及间质炎性细胞浸润,给药后7 d病变呈局灶性,给药后14 d呈弥漫性>20%肺组织,严重时>50%肺组织,伴有出血(红色箭头),肺大泡(向左箭头),甚至官腔闭合(三角箭头),给药后21 d时肺组织病变更重(见图1)。博来霉素组在气管给药后7,14,21 d时肺泡炎评分均显著高于盐水组(见表1)。博来霉素组肺泡炎评分峰值出现在第14天,第7天与第14天差异显著。说明博来霉素气管给药,诱导肺泡炎,持续进展,给药后第14天达到高峰,随后趋于平稳,逐渐下降。

图1 小鼠肺组织病理HE染色镜下表现 (×400)Figure 1 HE staining of pulmonary tissues in mice (×400)
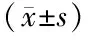
表1 各组肺泡炎评分比较
2.3 肺纤维化评分
通过对小鼠肺组织进行Masson染色观察各组肺纤维化情况,结果显示,博来霉素组肺纤维化明显重于盐水组,博来霉素组肺组织结构紊乱,肺泡间隔广泛增厚明显(隔厚度≥3X正常),部分间质纤维化毗连呈墙,甚至条块状胶原纤维沉积于肺间质(红色箭头),严重时肺泡腔被胶原纤维填满(实三角形),肺泡间隔消失,正常肺泡结构不能保留,胶原纤维条块连结成片(>显微镜视野50%)(见图2)。博来霉素组在气管给药后7,14,21 d肺纤维化评分均显著高于盐水组(见表2)。博来霉素组肺纤维化评分进行性升高,峰值出现在第21天。说明博来霉素气管给药后,纤维化持续进展,给药后7-14 d变化急剧,14-21 d变化趋于平稳。
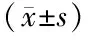
表2 各组肺纤维化评分比较

图2 小鼠肺组织病理Masson染色镜下表现 (×400)Figure 2 The pathological changes of pulmonary tissues by Masson staining (×400)
2.4 肺组织组蛋白3乙酰化率
Western blot检测组蛋白3、乙酰化组蛋白3(acetylated histone 3,AcH3)表达,通过乙酰化组蛋白3/组蛋白3计算组蛋白3乙酰化率。结果显示,博来霉素组组蛋白3乙酰化率显著低于空白对照组(0.859±0.188vs0.900±0.203,P=0.049);博来霉
素组组蛋白3乙酰化率显著低于盐水组(0.859±0.188vs1.076±0.165,P=0.000,见图3)。

与空白对照组比较,*P<0.05;与盐水组比较,##P<0.01图3 小鼠肺组织组蛋白3乙酰化率Figure 3 The acetylation rate of histone 3 in the lung tissue of mice
气管给药后,博来霉素组第7天(0.855±0.183vs1.037±0.142,P=0.041)、14天(0.797±0.224vs1.186±0.160,P=0.000)组蛋白3乙酰化率显著低于盐水组;然而,第21天两组无显著差异(0.927± 0.159vs0.951±0.103,P=0.832,见图4)。组蛋白3乙酰化率博来霉素组谷值出现在第14天,第21天逐渐回升至正常;盐水组峰值出现在第14天,21天逐渐下降至正常,两组变化趋势相反。
2.5 肺组织组蛋白4乙酰化率
Western blot检测组蛋白4、乙酰化组蛋白4(acetylated histone 4,AcH4)表达,通过乙酰化组蛋白4/组蛋白4计算组蛋白4乙酰化率。博来霉素组组蛋白4显著低于空白对照组(0.971±0.067vs1.016±0.096,P=0.043);博来霉素组组蛋白4显著低于盐水组(0.971±0.067vs1.039±0.097,P=0.003,见图5)。
博来霉素组组蛋白4乙酰化率在气管给药后第7天(0.976±0.091vs1.094±0.121,P=0.006)、第14天(0.932±0.026vs1.017±0.060,P=0.045)显著低于盐水组;第21天两组无显著差异(1.002±0.044vs0.980±0.068,P=0.662,见图6)。博来霉素组组蛋白4乙酰化率谷值出现在第14天,与盐水组比较变化趋势相异(见图6)。

与盐水组比较,*P<0.05,**P<0.01B.各组小鼠肺组织组蛋白3乙酰化率的比较图4 小鼠肺组织组蛋白3乙酰化率随给药时间的变化Figure 4 Changes of histone 3 acetylation rate in the lung tissues of mice along with the administration time
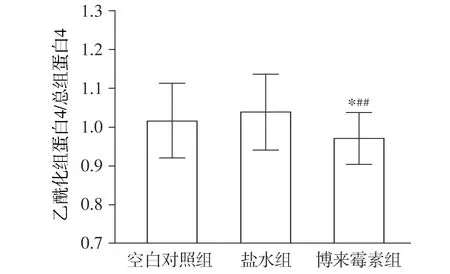
与空白对照组比较,*P<0.05;与盐水组比较,##P<0.01图5 小鼠肺组织组蛋白4乙酰化率Figure 5 The changes of histone 4 acetylation rate in the lung tissue of mice
2.6 小鼠肺组织病理评分与组蛋白乙酰化相关性
组蛋白3乙酰化率与肺泡炎评分负相关(r=-0.458,P双侧=0.002);与肺纤维化评分不存在相关性(见图7)。组蛋白4乙酰化率与肺泡炎(r=-0.495,P双侧=0.001)、纤维化(r=-0.396,P双侧=0.010)病理评分均呈负相关(见图7)。

图7 小鼠肺组织组蛋白乙酰化率与病理评分相关性Figure 7 Correlation between histone acetylation rate and pathological scores in the lung tissues of mice
2.7 组蛋白乙酰化对肺纤维化病变影响
二元线性回归分析:以肺泡炎评分作为因变量,自变量组蛋白4乙酰化率、组蛋白3乙酰化率标准化系数分别为-0.422、-0.362,均P<0.01,标准化系数绝对值组蛋白4乙酰化率大于组蛋白3乙酰化率,提示乙酰化率降低对肺泡炎的作用,组蛋白4强于组蛋白3。以纤维化评分作为因变量,组蛋白4乙酰化率与纤维化评分呈负相关(r=-0.412,P=0.010),组蛋白3乙酰化率与纤维化评分无相关性,提示乙酰化率降低对肺纤维化作用,组蛋白4强于组蛋白3。

与盐水组比较,*P<0.05,**P<0.01B.小鼠肺组织组蛋白4乙酰化率在气管给药后的比较图6 小鼠肺组织组蛋白4乙酰化率随时间的变化Figure 6 Changes of histone 4 acetylation rate in the lung tissue of mice along with the administration time
3 讨论
肺纤维化的病理过程包括肺实质的慢性炎症和纤维细胞外基质的沉积,导致肺泡壁增厚,导致出现慢性不可逆的肺功能下降。典型症状包括干咳、气短和运动受限[7]。空气污染、吸烟和病毒感染被认为可能是造成肺纤维化的原因,然而迄今为止,肺纤维化的发病机制仍然不完全清楚,阻止肺纤维化进展的药物方案仍然有限[8]。本研究主要探索肺纤维化可能涉及的分子变化。研究表明组蛋白乙酰化/去乙酰化平衡在纤维化进程及其基因调控中起重要作用[9],组蛋白去乙酰化修饰组蛋白,可以改变染色质构型,调控基因表达,其平衡失控是纤维化发生、发展的主要驱动力[10]。在脏器纤维化的进程中,组蛋白去乙酰化是细胞的活化、分化、凋亡基因转录的关键开关。
博来霉素处理肺纤维化小鼠的肺成纤维细胞中,因组蛋白去乙酰化酶2和组蛋白去乙酰化酶4的表达升高导致的组蛋白乙酰化水平降低,进而导致凋亡因子Fas表达下降,促使肺成纤维细胞凋亡敏感性降低,从而抑制成纤维细胞的凋亡,促进肺纤维化的发生[11]。研究显示组蛋白去乙酰化机制与抑制抗纤维化因子COX-2、IP-10启动子区的异染色质蛋白1、以及Thy-1等关系密切[4,12],通过乙酰化水平的改变,调控基因的表达,进而影响纤维化的形成。
本研究通过博来霉素诱导建立肺纤维化动物模型,检测肺组织组蛋白3、组蛋白4乙酰化水平,及二者随肺泡炎到肺纤维化的动态改变。结果显示,发生肺纤维化时,肺组织组蛋白3、组蛋白4的乙酰化水平均降低,这一变化与既往文献基本一致。在肺成纤维细胞体外实验中,组蛋白3和/或组蛋白4在LPS诱导的肺纤维化过程中乙酰化水平降低[12]。
本研究显示小鼠肺纤维化早期(给药7 d)组蛋白3、组蛋白4的乙酰化水平呈进行性下降趋势,随后逐渐回升。组蛋白3与组蛋白4相比较,组蛋白4乙酰化反应更为敏感,肺纤维化早期组蛋白4乙酰化水平下降更为显著,回升更为迅速。相关性分析提示,组蛋白4去乙酰化既与肺泡炎关系密切,也与肺纤维化关系密切,组蛋白3去乙酰化在肺纤维化的进程中仅与肺泡炎关系密切;多元回归分析显示,组蛋白3去乙酰与肺泡炎的密切性弱于组蛋白4去乙酰化。本研究初步探索组蛋白去乙酰化参与肺纤维化进程,组蛋白4与组蛋白3比较,去乙酰化反应更为敏感、影响更为广泛。组蛋白4乙酰化作为纤维化的标记,研究也更为广泛,新近的研究显示,丙戊酸作为组蛋白去乙酰化酶类抑制剂,能够显著减少心房的扩张和纤维化;与其能够显著升高心房中组蛋白4乙酰化水平有关[13]。
本研究中,组蛋白乙酰化水平在肺纤维化过程中后期出现回升,组蛋白4乙酰化率甚至出现反超对照组的现象。在肾脏损伤研究中,损伤后近端肾小管细胞中乙酰化组蛋白瞬时减少,24 h后逐渐恢复,这一变化可持续3周[14],同时发现这一变化与管状上皮细胞的修复相关[15]。因此,本研究结果提示在肺纤维化变化的过程中,组蛋白由早期的去乙酰化转变为乙酰化。
另外,本研究发现,盐水组与空白对照组小鼠比较,组蛋白乙酰化水平升高,组蛋白3乙酰化水平升高更为明显,病程早期即迅速升高;组蛋白4乙酰化升高水平不显著。因试验设计要验证博来霉素气管给药的造模效果,需设立给药溶剂组即盐水组进行对照,以排除溶剂对造模效果的影响。但是盐水气管给药也并非生理过程,对呼吸系统属于一种物理刺激。这一结果提示一方面盐水气管给药作为一种物理刺激,诱发肺组织组蛋白乙酰化水平一过性升高,组蛋白3乙酰化在此过程中反应更为敏感、迅速;另一方面,盐水作为诱导药物博来霉素的溶剂,并没有促进组蛋白乙酰化水平下降的作用,这从侧面反应博来霉素诱导肺纤维化模型,组蛋白乙酰化水平降低,结果可信。
总之,本研究揭示肺纤维化的表观遗传学发病机制的冰山一角,组蛋白3与组蛋白4的乙酰化变化深度参与肺纤维化进程,为通过调控组蛋白乙酰化水平治疗肺纤维化,甚至逆转病程,找到了可靠的检测标记。此外,组蛋白乙酰转移酶对组蛋白乙酰化水平具有调控作用,本研究为针对该乙酰转移酶制定的肺纤维化药物提供了可靠的治疗参考标记[16],为后续相关研究的开展打下基础。

