雌激素通过组胺H1受体调节内脏敏感性的机制研究
秦 斌,许绍娴,蒋潇洒,谢丹红,许晓毓,戴 菲,董 蕾
(西安交通大学第二附属医院消化内科,西安 710004;*通讯作者,E-mail:dong556@126.com)
肠易激综合征广泛影响着人类生活质量,特别是给女性的工作和生活状态带来困扰,其重要的病理生理机制之一为内脏高敏感。近年有很多关于雌激素和肠易激综合征(IBS)相关性的研究发现,雌激素可能影响内脏敏感性。以往的研究多有关其经典受体ERα和ERβ介导的雌激素效应[1],近年也有雌激素通过G蛋白偶联受体调节内脏感知的研究报道,这些研究多集中在雌激素通过中枢层面调节内脏敏感性[2]。然而,肠道是IBS发病和内脏敏感性出现重要的一环,雌激素对肠黏膜功能的直接作用很少被研究。因为雌激素受体在消化道的分布研究较少,雌激素、肠黏膜靶点与内脏敏感性三者的联系尚不清楚。我们前期研究证实,多种雌激素受体在人类肠道黏膜肥大细胞中表达,并发现雌激素受体之一GPR30的表达与内脏高敏感相关症状有关,并进一步通过动物实验证实雌激素受体同样表达于大鼠肠道肥大细胞[3]。肥大细胞通常释放组胺、P物质等活性产物从而发挥活性作用,其中组胺H1R是组胺参与免疫和过敏反应最主要的结合位点,并且有多项研究发现H1R参与IBS发病过程[4],但雌激素是否通过肠道H1R发挥作用尚无研究。本研究在前期研究的基础上,通过去卵巢大鼠动物模型,探讨外源性雌激素引起内脏肌电活动(VMR)改变是否与组胺有关,并进一步探讨雌激素通过H1R调节内脏敏感性的作用。
1 材料与方法
1.1 主要试剂与仪器
β-雌二醇(Sigma-Aldrich,美国),DMSO(Sigma-Aldrich,美国)。Fexofenadine(Sigma-Aldrich,美国),组胺ELISA试剂盒(上海西唐,中国),大鼠H1R抗体(Santa Cruz,美国)。Power lab记录分析仪(ADI公司,澳大利亚),生物电放大器(成都生物仪器厂,中国),凝胶成像分析系统与Western显像系统(Bio-Rad公司,美国)。8F导尿管(B. Braun医疗公司,马来西亚)。
1.2 实验动物与分组
雌性SD大鼠,清洁级,体质量200-250 g,8周龄,购自西安交通大学医学动物实验中心(许可证号:SYXK(陕)2018-001)。实验动物给予自来水和普通动物饲料喂养。所有动物均行双侧卵巢切除术,术后7-10 d实验动物分为4组(n=6):对照组给予对照剂(0.1 ml橄榄油+0.1 ml DMSO腹腔注射)后不采用束缚应激;其余三组均在用药后0.5 h给予束缚应激,分别为:给予对照剂(0.1 ml橄榄油+0.1 ml DMSO腹腔注射);雌二醇组:给予雌二醇(10 μg/kg,溶于0.1 ml橄榄油腹腔注射+0.1 ml DMSO腹腔注射);雌二醇+组胺H1R阻断剂组,腹腔注射雌二醇(10 μg/kg,溶于0.1 ml橄榄油)+H1R阻断剂Fexofenadine(20 mg/kg,溶于DMSO)。
1.3 双侧卵巢切除术和导丝埋置
8%异戊巴比妥钠(0.1 ml/100 g体质量)腹腔注射麻醉大鼠,俯卧位固定四肢在板上,背部和颈部备皮后用碘酒充分消毒;腰椎水平沿背部正中线两侧2-3 cm纵行切开后逐层分离。暴露出粉红色豌豆大小的卵巢,用镊子将脂肪组织和卵巢拉出;分别结扎两侧输卵管和血管,将卵巢摘除。医用导线(AF-250A)剪成15-20 cm长度,腹横肌周围备皮消毒,行一侧腹部皮肤切口后暴露腹外斜肌;用小圆针将3根(1根备用)电极紧密缝在肌纤维上,电极之间距离0.5 cm;将1根长塑料导管(10 cm)沿腹部及背侧皮下组织引至颈后外侧皮下,在颈外侧皮肤消毒切开后引出。检查无出血后分别缝合腹部和颈部切口。手术后大鼠均单独饲养,自由进食,恢复7-10 d后用于实验。
1.4 急性束缚应激后内脏肌电(VMR)检测
根据实验分组给药后30 min行束缚应激,用胶带将大鼠前肩、双前肢及胸部绑缚到背部,限制大鼠上肢的活动,但不限制大鼠身体的活动和呼吸;将大鼠单独放置到笼中,束缚时间为2 h。束缚应激后解除胶带,30 min后将大鼠放置到筒状大鼠固定器内使大鼠不能活动、转身或逃跑;Powerlab电生理记录仪系统与大鼠颈部裸露电极相连,将带有球囊的导尿管(8F)插入大鼠距肛门3.5-4 cm处直肠。待大鼠适应固定和球囊扩张(CRD)后,阶梯向球囊内注气,体积分别为0,0.4,0.8,1.2 ml;提高压力时需排空气体并间隔3 min。每个压力梯度持续扩张20 s,重复3次记录VMR;大鼠VMR使用Chart5.0软件进行测量计算,VMR的分析采用扩张过程中20 s的曲线下面积(AUC)减去扩张前基线期20 s的面积。将对照组大鼠0.4 ml扩张时AUC设为参照AUC,VMR求相对值。
1.5 标本采集和组胺检测
各组大鼠球囊扩张结束后,腹腔内注射过量10%水合氯醛处死动物,打开腹腔,用注射器取右心室血,4 ℃下1 500 r/min离心10 min,取上清,-70 ℃保存,用于检测血浆组胺含量。其后分离截取大鼠远端结肠,用生理盐水冲洗后-70 ℃冰箱保存,用于检测组织中组胺含量和Western blot检测。一块大鼠远端结肠组织用冰生理盐水反复冲洗剪碎,使用微量电动组织匀浆器将组织块快速研磨制成10%的组织匀浆。血浆和组织中组胺含量测定参照ELISA试剂盒说明书和既往研究分别进行[5]。
1.6 Western blot法检测肠道H1R受体
参照既往的方法[6],简要步骤如下:取实验大鼠肠道标本一块剪碎加入裂解液,倒出组织匀浆液置于EP管中高速离心5 min提取蛋白。准备BCA工作液稀释BSA标准品,酶标仪计算待测样品的蛋白含量。DS-PAGE凝胶电泳:取出蛋白样本,冰上溶解,提取计算好的蛋白样品与缓冲液在室温下按照1 ∶5体积比均匀混合,95 ℃煮沸5 min。制胶和灌胶后进行蛋白质的转移至PVDF膜上。将PVDF膜放入到5%牛奶封闭后加入H1R一抗,摇床上4 ℃过夜,加入二抗室温2 h,浸入增强化学发光试剂中显色。按30 s、1 min、3 min、5 min梯度曝光,用扫描仪对显影结果进行扫描,用Gel-Pro软件分析目的蛋白与内参的灰度比值,作为H1R蛋白表达的相对水平。
1.7 统计学分析

2 结果
2.1 急性束缚应激对去卵巢大鼠VMR的影响
大鼠在直肠扩张体积为0 ml时,VMR表现为平滑的曲线,当球囊扩张体积为0.4 ml时,肌电图变得密集,当球囊扩张体积为0.8 ml和1.2 ml时,肌电图波形变得更加密集,并出现明显增高和成簇出现的波峰(见图1)。对不同球囊扩张体积下两组大鼠腹壁肌电活动(VMR)统计分析发现,在0 ml和0.4 ml球囊直肠扩张时两组大鼠腹壁肌电图曲线下面积无统计学差异,在球囊扩张体积为0.8 ml和1.2 ml时,应激组大鼠VMR明显高于对照组(P<0.01,见图1)。

与control组相比,*P<0.01,**P<0.01图1 应激组与对照组球囊扩张后VMR的比较Figure 1 Comparison of VMR after CRD between stress group and control group
2.2 外源性雌激素对VMR的影响
与应激组相比,雌激素组大鼠在0.4 ml直肠球囊扩张时VMR无明显差异,而在0.8 ml(P=0.036)和1.2 ml(P=0.017)球囊扩张时VMR明显升高(见图2)。
2.3 阻断H1R对外源性雌激素调节VMR的影响
给予去卵巢大鼠H1R阻断剂Fexofenadine(Fex)和雌二醇(estradiol)后检测动物腹壁肌电活动,发现:两组大鼠在0.0 ml和0.4 ml体积直肠球囊扩张时VMR无明显差异,而estradiol+Fex组在0.8 ml和1.2 ml体积球囊扩张时VMR明显低于estradiol组(P<0.01,见图2)。当球囊扩张体积为0.8 ml和1.2 ml时,VMR波形逐渐密集,在1.2 ml时出现增高和成簇出现的波峰(见图2)。

图2 不同组别直肠球囊扩张后VMR的比较Figure 2 Comparison of VMR after CRD between different groups
2.4 血浆和肠道组胺的变化
四组大鼠血浆组胺浓度相比无差异(P=0.53,见表1)。与control相比,stress组肠道组胺含量升高(P=0.04),estradiol+stress组肠道组胺含量明显高于control组和stress组(P<0.01),H1R阻断剂Fex组肠道组胺含量明显高于control组和stress组(P<0.01),而estradiol+stress组和estradiol+Fex+stress组之间无统计学差异(P=0.34,见表1)。

表1 不同组别血浆和肠道组胺含量的比较
2.5 肠道H1R蛋白的表达
通过Wesern blot法检测H1R在肠道的表达发现:estradiol+stress组和estradiol+Fex+stress组、control组、stress组大鼠肠道H1R的相对蛋白含量(H1R/GADPH)无明显统计学差异(P=0.93,见图3)。
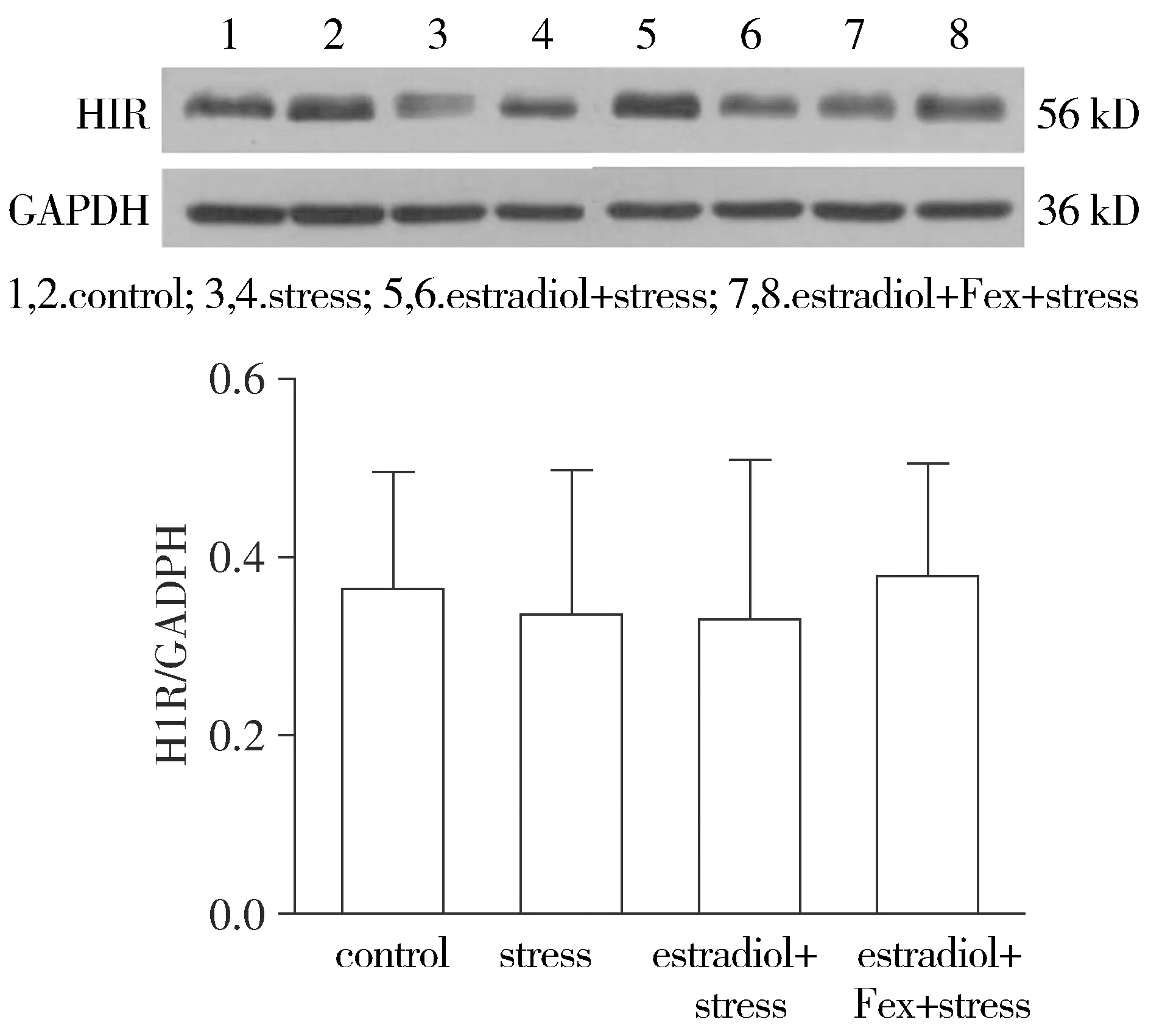
图3 不同组别肠道H1R的含量比较Figure 3 Comparison of H1R content in colon among different groups
3 讨论
前期的研究发现,在肠道可以检测出雌激素多种受体,并且与内脏敏感性相关[3],但是否通过组胺等活性物质发挥作用尚不明确。本实验证实了雌激素引起VMR升高的同时肠道组胺也出现了升高,而阻断组胺H1R时可以逆转雌激素对VMR的作用。
大鼠腹壁电生理检测即VMR能直接记录腹壁肌电活动,从而反映大鼠的内脏敏感性,为大鼠内脏痛检测提供了客观和可量化的指标,是目前肠道电生理研究中通用的反映内脏敏感性的方法[7]。在本实验中VMR随扩张球囊压力升高而增高,检测结果具有可重复性,说明VMR间接地提示了动物模型内脏敏感状态。研究通过结直肠球囊扩张后记录VMR,发现急性束缚应激大鼠内脏敏感性高于未接受应激者,说明急性束缚应激模型可以诱发内脏高敏感状态,因此本研究采用急性束缚应激联合直肠球囊扩张的方法检测大鼠VMR作为动物模型。大鼠的雌激素水平因性别而异,雄性大鼠的雌激素来源于体内多个器官,影响因素较多难以控制其含量,因此本实验未使用雄性大鼠。而雌性大鼠的雌激素主要来源于卵巢,但其水平随着动情周期波动,因此本研究中使用雌性大鼠,在双侧卵巢切除后给予外源性雌激素,使实验动物间雌二醇水平具有可比性。
去卵巢雌性大鼠在急性束缚应激前给予外源性雌激素能明显增加大鼠内脏敏感性,直接说明雌激素能影响内脏感知,这与以往的研究结果一致[8]。但以往的研究多发现雌激素在中枢层面的作用[9,10],而雌激素促使外周肠道释放活性物质少有研究,本研究通过检测肠道活性物质的改变探讨雌激素对肠道靶点的直接作用。组胺是人和动物体内重要的化学递质,多数贮存于肥大细胞中,当机体受到某种刺激引起肥大细胞膜通透性增加便会释放组胺等活性物质。因此本研究选择肠道组胺水平来反映肥大细胞脱颗粒的状态。但组胺存在于消化道、呼吸道、皮肤等多个部位,因此研究中同时检测了血浆组胺水平,以免肠道外来源的组胺影响结论的推断。研究中检测到雌二醇干预后VMR的增高伴随着肠道组胺含量的增加,而血浆组胺水平并无改变,提示肠道可能是雌激素调节内脏感觉的靶点之一,且雌二醇的作用与肠道组胺等活性物质的改变有关,而大鼠血浆组胺无明显改变提示雌激素作用的靶点可能为肠道肥大细胞而非中枢位点。肠道存在多种活性物质,包括五羟色胺、P物质、血管活性肠肽等,本研究仅证实了肠道组胺水平的变化,并未排除其他活性物质潜在的作用,不能除外多种活性物质协同作用调节内脏敏感性。
组胺影响肠道功能的作用不但与组胺的含量有关,还可能与组胺受体的水平和活性相关,而组胺受体亚型有四种,其中组胺1型受体H1R是其参与免疫和超敏反应最主要的结合位点[11],既往研究发现H1R参与IBS内脏高敏感发病过程[4,12]。通过使用组胺H1R阻断剂Fexofenadine(Fex)阻断组胺H1信号,证实Fex联合雌激素降低了雌激素对内脏敏感性的影响。研究还发现Fex对大鼠血浆和结肠的组胺水平均无影响,说明H1R阻断剂起作用依赖的是阻断H1信号,而不是影响组胺的释放,同时进一步说明组胺是雌激素调节内脏感知的中间介质之一。研究还检测了实验动物肠道H1R的含量,发现在4个不同的组别中,虽然各组大鼠内脏敏感性不同,但H1R的含量无统计学差异,提示影响内脏敏感性高低的是肠道组胺的含量,而不是H1R的含量水平。本研究的另一局限性在于仅研究了组胺受体一种亚型的作用,无法完全排除组胺其他亚型的影响。并且虽然证实了组胺通过肠道受体H1R调节内脏敏感性,但因为动物模型中未阻断中枢神经系统下传的通路,因此不能完全排除中枢层面的影响。
综上所述,本研究证实雌激素调节大鼠内脏敏感性的作用与肠道组胺的含量有关,外源性雌激素可以增加肠道组胺含量而增加内脏敏感性,在H1R阻断剂抑制组胺的作用后,雌激素对内脏敏感性的增强效应减低,而具体的信号通路尚需进一步通过细胞实验研究阐明。

