改良式背部正中单切口入路卵巢切除术构建大鼠骨质疏松模型的研究
刘攀杰,李永贤,马延怀,张顺聪,袁 凯,郭丹青,罗培杰,郭惠智
(1广州中医药大学第一临床医学院脊柱骨科,广州 510000;2广州中医药大学第一附属医院脊柱骨科;*通讯作者,E-mail:drzsc@sina.com)
骨质疏松症已成为我国面临的重要公共健康问题[1]。随着人口老龄化的加剧,骨质疏松症尤其是绝经后骨质疏松症的发生率逐渐上升。据不完全统计,目前我国骨质疏松症患者近7 000万,骨量减少者超过2亿人[2]。骨质疏松症最严重的并发症就是骨质疏松性骨折,具有骨质量差、愈合缓慢和发病率高、致残致死率高、治疗费用昂贵等特点。因此,骨质疏松预防及治疗相关研究显得尤为重要。动物实验被广泛应用于骨质疏松症的研究[3],而动物模型的构建是其重要前提和基础。据文献报道[4],雌激素缺乏的大鼠,其骨代谢变化与人类十分相似,因而在骨质疏松症病理机制、诊断、治疗药物的药代动力学等方面具有相当高的参考价值。1969年,Saville[5]首次建立了大鼠绝经后骨质疏松模型,此后经反复证实,双侧卵巢切除法已广泛应用于绝经后骨质疏松的研究。虽然该去势模型仍有一定的局限性,但由于该模型成功率高、稳定性可靠、重复性好、适用范围广,目前为止,已成为骨质疏松模型和其他去除雌激素影响的模型广泛使用的方法[6,7]。据以往文献报道,背侧部双切口入路去卵巢术较腹部正中切口入路及腹股沟切口入路更为安全便捷,因而被广泛推崇[8]。然而,背侧部双切口入路仍有些许缺陷,如术口易开线、感染等。因此,笔者在背部双切口入路去卵巢术基础上,提出改良式背部正中单切口入路去卵巢术。本研究旨在比较改良式背部正中单切口入路与背部双切口入路两种造模方式的安全性及便捷性,为进行去卵巢相关研究的广大科研工作者提供参考。
1 材料与方法
1.1 实验动物
SPF级健康雌性Sprague-Dawley(SD)大鼠30只,体质量(250±30)g,购自南方医科大学实验动物中心。大鼠分笼饲养,由广州中医药大学第一附属医院SPF级动物实验中心提供大鼠专用饲料,自由饮水。饲养环境:室温24 ℃,日照12 h,相对湿度45%-65%,通风良好。适应环境2周后开始实验。采用单纯随机对照实验方法,将30只大鼠1-30随机编号,采用随机数表法完全随机分组,平均分为背部双切口组(OVXD)、背部正中单切口组(OVXS)、假手术组(sham)各10只。
1.2 仪器与材料
micro-CT(Skyscan1172,bruker公司,比利时);麻醉药物(1%戊巴比妥钠),碘伏,75%酒精,注射用青霉素钠(160万U),500 ml 0.9%氯化钠注射液,手术刀,手术剪,眼科剪,手术镊,组织钳,止血钳,持针器,角针,非吸收性外科缝线,无菌纱布及棉球,无菌中单,5 ml注射器,1 ml注射器。
1.3 背侧部双切口入路去卵巢手术
大鼠术前禁食12 h,腹腔注射0.1%戊巴比妥钠溶液(45 mg/kg)麻醉,俯卧位固定,在背部双侧肋缘下与尾骶段广泛性备皮剃毛,分别用碘伏和酒精于术部消毒,覆盖无菌铺单,以背部后正中线旁开1.5 cm,双侧肋缘下1 cm为切口,向下逐层切开1-1.5 cm,钝性分离皮下组织肌肉,暴露腹腔,可见白色脂肪组织,轻柔提拉出脂肪,可见粉红色桑葚状的卵巢,轻柔分离卵巢下输卵管与脂肪,用组织钳夹闭卵巢下输卵管,将输卵管连同其周围血管用外科缝线环形结扎,剪除卵巢,将断端输卵管送回腹腔,逐层缝合。同法切除另一侧卵巢。碘伏再次消毒术口。于大鼠大腿肌肉内注射青霉素8万IU。造模完毕。
1.4 改良式背侧部正中单切口入路去卵巢手术
禁食麻醉固定同1.3叙述。以背部后正中线上平肋缘下1.5 cm处为中心点O,边长2 cm正方形备皮剃毛,分别用碘伏和酒精于术部消毒(见图1A),覆盖无菌铺单,于O点处纵向切口1.5-2 cm(见图1B),拉动术区皮肤,将O点切口左侧移1 cm,钝性分离皮下组织肌肉,暴露腹腔,可见白色脂肪组织,轻柔提拉出脂肪,可见粉红色桑葚状的卵巢,轻柔分离卵巢下输卵管与脂肪,用组织钳夹闭卵巢下输卵管,将输卵管连同其周围血管用外科缝线环形结扎(见图1C),剪除卵巢,将断端输卵管送回腹腔,缝合肌肉一针。拉动术区皮肤,将O点切口右侧移1 cm,同法切除右侧卵巢。缝合术口皮肤。碘伏再次消毒术口。于大鼠大腿肌肉内注射青霉素8万IU。造模完毕。
1.5 术后处理
术后前3 d每天肌注青霉素8万IU/只。密切观察术口及大鼠精神状况。

A.确定O点 B.纵向切口1.5-2 cm C.结扎切除卵巢图1 改良式背侧部正中单切口入路去卵巢术Figure 1 Modified single incision dorsolateral median approach for ovariectomy
1.6 骨密度测量
选择micro-CT对大鼠股骨样本逐个扫描。样本固定后,设置参数:50 kV,500 μA,0.5 mm滤过滤器,952 ms曝光,像素尺寸8.89 μm,2帧平均,0.4°旋转180°对股骨进行成像。扫描后应用micro-CT自带分析软件进行分析,以股骨内正中松质骨区域为圆心设置感兴趣区域。计算相对骨体积(relative bone volume,BV/TV)。
1.7 统计学处理
2 结果
2.1 手术耗时
从切开皮肤开始计时,至术口缝合完毕计时终止。所有手术均由同一实验人员完成。OVXD组与OVXS组手术平均时间分别(19.38±0.55)min和(15.10±0.51)min,背部单切口组比背部双切口组手术用时平均缩短5 min(P<0.001,见图2)。
2.2 术中出血量
手术出血量以纱布棉球术后与术前质量差值为标准。OVXD组与OVXS组平均出血量分别为(2.48±0.36)g和(2.44±0.40)g,两组手术方式出血量差异无统计学意义(P=0.83,见图3)。

图3 两组大鼠出血量Figure 3 Comparison of blood loss between two groups
2.3 术中及术后1周内大鼠死亡情况
两组大鼠术后均未出现死亡情况。

与OVXD组比较,**P<0.001图2 两组大鼠手术时间Figure 2 Comparison of operation time of rats between two groups
2.4 术后1周内术口开裂情况
术后1周内OVXD组与OVXS组大鼠术口开裂数量分别为4只和2只,术口开裂再次缝合线结数量分别为10个和4个。双切口组大鼠术口开裂数量与单切口组差异无统计学意义(P=0.628,见表1),但由于双切口组多为一侧术口或双侧术口开裂,其所需再次缝合的线结数量明显高于单切口组。

表1 术后1周内大鼠术口开裂情况
2.5 术后老鼠术口感染数量
术后1周内OVXD组与OVXS组出现切口开裂、红肿、脓性分泌物等感染迹象的大鼠数量分别为4只和2只,感染率分别为40%和20%。均予以再次缝合后单笼饲养,并抗生素抗感染治疗后康复。
2.6 术后2月造模成功率
术后2月OVXD组与OVXS组相对骨体积分别为21.828%±2.622%和19.185%±2.309%(P=0.867),sham组为40.316%±2.573%,两种术式骨质疏松造模均成功,与假手术组比较差异有统计学意义(P<0.001,见图4,5)。

与假手术组比较,**P<0.001图4 术后2月各组大鼠骨密度评价Figure 4 Bone mineral density evaluation of rats in each group two months after operation
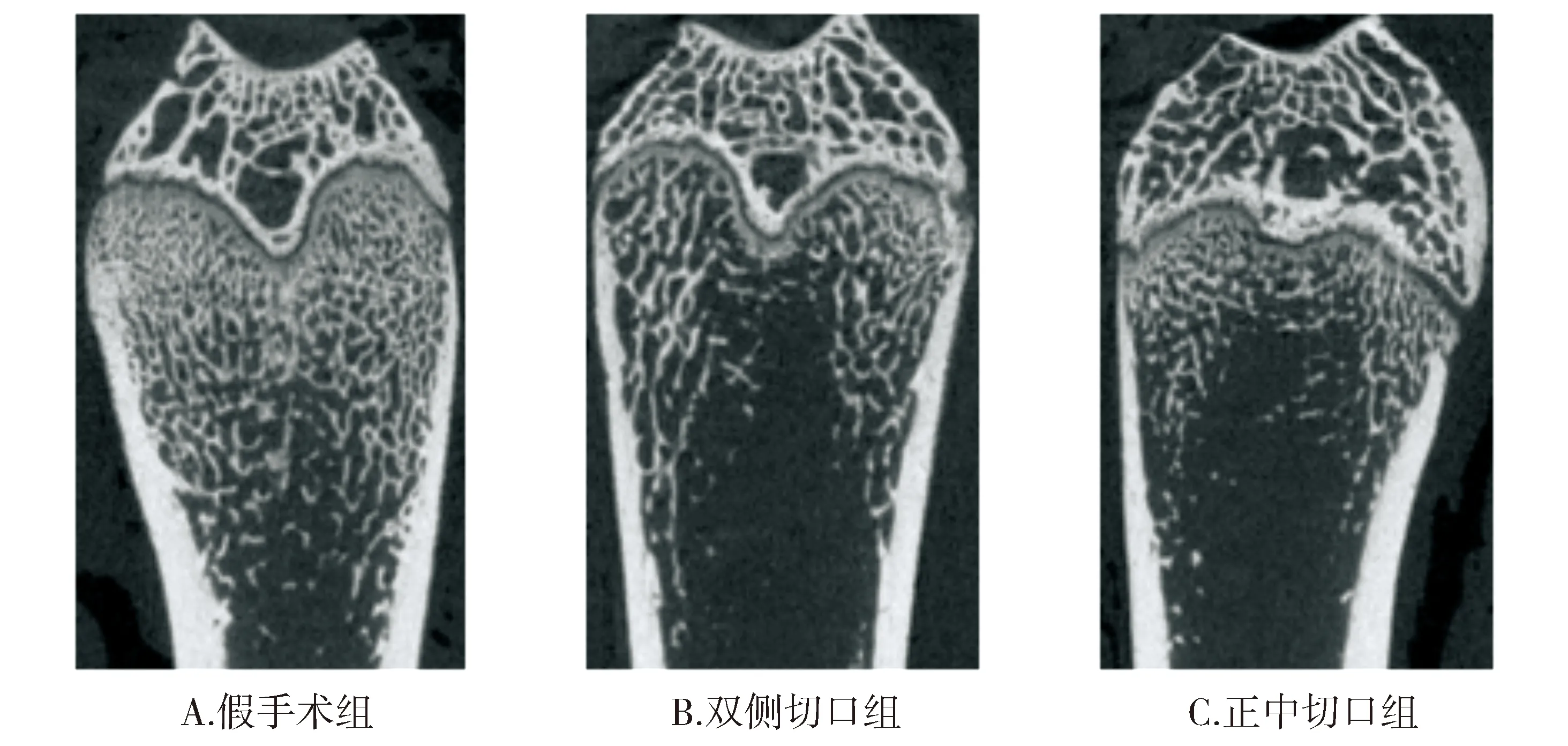
图5 术后2月各组大鼠股骨远端Micro-CTFigure 5 Micro-CT of distal femur in each group two months after operation
3 讨论
骨质疏松已经成为世界性难题。骨质疏松症因其所致并发症骨质疏松性骨折而严重危害人群健康。骨质疏松症以骨量低、骨组织微结构损坏而导致骨脆性增加,易发生骨折为特征,包括原发性骨质疏松和继发性骨质疏松两大类[9]。前者主要包括绝经后骨质疏松症(Ⅰ型)、老年骨质疏松症(Ⅱ型)和特发性骨质疏松症,后者主要指由任何影响骨代谢的疾病和/或药物及其他明确病因所诱发[2]。成骨细胞介导骨形成,破骨细胞介导骨吸收,两者不断更新并保持动态平衡,此过程即骨重建[10]。成骨细胞的骨形成功能和破骨细胞的骨吸收功能对维持骨重建的平衡起着决定性作用。当成骨细胞活性大于破骨细胞活性时,骨重建呈正平衡时,骨量增加;成骨细胞活性小于破骨细胞活性时,骨重建呈负平衡,将导致骨质疏松症的发生[11]。绝经后骨质疏松症一般发生在女性绝经后5-10年内,在我国,相比于男性,绝经后妇女有着更高的骨质疏松症的发病率[12]。绝经后妇女卵巢功能衰退,循环雌激素水平急剧下降。雌激素是维持骨代谢平衡的重要物质之一,雌激素可通过RANKL/RANK/OPG途径直接作用于破骨细胞,促使破骨细胞凋亡、抑制破骨细胞分化、成熟,从而使得骨吸收减少[13]。另外,雌激素通过改变转录因子的活性,调节自噬,减弱氧化应激反应,降低NF-κB活性,降低骨硬化蛋白,抑制成骨细胞凋亡并增加成骨细胞的存活时间,从而影响骨代谢,所以雌激素缺乏可引起骨代谢失衡,导致骨量减少或骨质疏松[14,15]。
有研究表明,绝经后患有骨质疏松的妇女,其总胆固醇和高密度脂蛋白(HDL)的水平明显高于正常骨量的妇女,且胆固醇、HDL水平等与骨密度呈负相关[16]。深入研究发现,骨髓腔内的脂肪细胞和成骨细胞均来源于骨髓间充质干细胞,两者同宗同源,并且在一定条件下可以互相转换[17-19]。绝经后骨质疏松症为高转换型骨质疏松,其形成由于成骨细胞的相对下降和破骨细胞的相对上升,在成骨与破骨的同时,使得骨量总体呈下降趋势;而成骨细胞的形成减少,又与脂肪细胞的形成增多相偶联,哺乳动物骨髓腔中骨量减少的同时常伴随着脂肪细胞的聚集,成骨/成脂分化表现出一定的“此消彼长”规律,故此骨髓中的脂肪细胞数量与松质骨的骨量成反比,骨量减少的同时,骨髓腔内脂肪细胞总是增多[20-22]。骨质疏松动物模型的成功建立对于研究骨质疏松发病机制、防治措施以及新药研发等十分重要。如今有很多方法可以成功获得骨质疏松动物模型,包括激素干预诱发的骨质疏松动物模型、局部废用性骨质丢失动物模型、营养缺陷诱发的骨质疏松动物模型以及其他类型的骨质疏松动物模型(如维甲酸、链脲佐菌素、基因工程法诱导而成等)[23,24]。去势(去卵巢)方法以其简易便捷、安全可靠及耗费低廉等特点而应用广泛,目前已被公认为最可靠的建模方式,而且FDA和WHO已经推荐去卵巢大鼠作为研究绝经后骨质疏松症的经典模型[25,26]。去势法排除雌激素干扰,与人绝经后骨质疏松症患者十分相似,当前研究多使用3-10月龄未孕雌鼠,造模持续时间多为12-24周以建成绝经后骨质疏松模型[27-29]。去卵巢对大鼠体质量和能量代谢调节的影响和终身高脂饮食十分相似,卵巢切除术后神经免疫信号发生改变,神经免疫因子的动态选择性变化导致脂肪形成增加,从而使得术后的大鼠普遍肥胖[30,31]。大量研究表明骨髓脂肪细胞和成骨祖细胞之间存在相互关系,脂肪生成越多,成骨生成越小,反之亦然[32]。正常成年雌性大鼠雌激素水平正常,而雌激素在身体对胰岛素敏感性和脑氧化应激起着重要的作用,这也是卵巢切除后大鼠肥胖的另一原因[33]。
卵巢位于腰大肌外侧缘,位置靠近背部,从背部开口容易找到卵巢。大鼠腹部经常接触垫料,腹部开口法和腹股沟切口法的感染几率较大,大鼠清醒后挠抓咬切口,容易咬断缝合线使切口裂开,背部两侧切口感染几率相对较小,但双切口较为费力,两侧切口皆在背部肋缘下松软处,大鼠皮韧坚厚,松软处下刀,做切口稍显费力,正中单切口法于脊背部正中下刀,切口方便简单。经过对比,背部正中单切口组比背部双切口组手术用时明显缩短,原因考虑双切口组需要多缝合一处等长切口,而缝合一处切口时间约为5 min。术后两组大鼠术口开裂数量无显著性差异,但由于双切口组多为一侧术口或双侧术口开裂,其所需再次缝合的线结数量明显高于单切口组。相同暴露因素下,术口越多,术口开裂频率越大,所需再次缝合线结数量愈多。背部正中单切口位置较高,大鼠爪牙难以触及,大鼠为俯睡动物,感染风险亦相对降低。
综上,背部正中单切口卵巢切除术的操作更为简便,缩短手术时间,减少术后并发症的发生,术后术口开裂频率较低,所需再次缝合线结数量较少。提高大鼠骨质疏松造模安全性及减轻研究者术后再次缝合术口及处理其他并发症的负担。

