二甲双胍和紫草素对人鼻咽癌细胞CNE-2Z增殖及凋亡的影响及其机制
王楠楠,苏 凯,崔忆旋,陶 露,时宗芬,陈晓芬,翟丽倩,马士崟,赵 报
(蚌埠医学院第一附属医院耳鼻咽喉科,蚌埠 233000;*通讯作者,E-mail:mashiyinent@sina.com;#共通讯作者,E-mail:Zhaobao86@126.com)
鼻咽癌发生于鼻咽腔顶部和侧壁,是一种头颈部常见的恶性肿瘤。其病因与遗传、环境以及EB病毒等有关。好发于中年男性,但可发于任何年龄组。发病位置隐蔽,临床症状不明显,常常因广泛侵润周围组织及发生淋巴转移后才发现,故诊断较困难,且预后较差。与T1-2期鼻咽癌患者相比,T4期患者的5年局部控制率较差,预后不良,因此临床治疗鼻咽癌的关键为有效降低肿瘤远处转移率,提高晚期肿瘤患者的局部控制率[1]。二甲双胍(metformin)是一种有效的口服降血糖药物,近年来研究发现,该药能降低糖尿病患者的肿瘤罹患率,抑制肿瘤细胞的生长[2];已有研究表明二甲双胍能显著提高非小细胞肺癌、子宫内膜癌、结直肠癌患者生存率。它能够激活AMPK通路,抑制细胞有氧呼吸,从而抑制肿瘤细胞增殖[3-9]。还有多项研究证实二甲双胍可以提高肿瘤细胞对化疗药物的敏感性。体内及体外实验证实其能够抑制肿瘤细胞生长及侵袭、迁移能力,为恶性肿瘤治疗提供了新的研究方向。已有研究证明坏死性凋亡是一种可调控的程序性细胞死亡方式,目前的研究表明,坏死性凋亡是由RIPK3(receptor-interacting serine/threonine-protein kinase 3)以及其底物MLKL(mixed lineage kinase domain-like protein)共同介导,对于机体的生长发育和组织器官的稳态具有重要作用。此外,对肿瘤耐药细胞株的研究证实,在规避肿瘤多药耐药方面坏死性凋亡诱导剂具有“广谱性”[10-14]。紫草素(shikonin)是从紫草中提取的一种萘醌类物质。丙酮酸脱氢酶作为糖酵解的关键酶,已有研究表明,紫草素不仅可以通过抑制其亚型PKM2从而抑制糖酵解,还可以通过抑制PKM2诱导细胞发生坏死性凋亡[15]。本研究旨在探讨二甲双胍和紫草素联用对于鼻咽癌细胞CNE-2Z的作用形式及其可能分子机制,为鼻咽癌的临床治疗提供新的思路。
1 材料和方法
1.1 细胞株及主要试剂
人鼻咽癌细胞CNE-2Z购自美国ATCC公司,培养于蚌埠医学院药学院生化实验室。RPMI-1640培养基、胰蛋白酶(含EDTA)购自公司美国Hyclone公司,胎牛血清(FBS)购自浙江天杭生物科技股份有限公司,MTT试剂、双染细胞凋亡检测试剂盒(Annexin Ⅴ FITC/PI)、BCA蛋白定量试剂盒购于上海碧云天公司,Bcl-2、Bax、RIP1、RIP3蛋白抗体购自美国CST公司。
1.2 细胞培养
人鼻咽癌细胞CNE-2Z培养于含10%胎牛血清、100 U/ml青霉素、100 μg/L链霉素的RPMI-1640培养基中,于37 ℃、5% CO2的培养箱中培养。
1.3 MTT实验检测细胞增殖
取对数期生长状态良好的CNE-2Z接种入96孔板,调整每孔培养液为100 μl,细胞数为7 000。将细胞分为4组:空白组、二甲双胍组、紫草素组、二甲双胍+紫草素组。待细胞贴壁后,空白组不做处理,二甲双胍组加入浓度为40 mmol/L的二甲双胍药液,紫草素组加入浓度为3 μmol/L的紫草素药液,二甲双胍+紫草素组加入浓度为40 mmol/L的二甲双胍和3 μmol/L的紫草素混合药液,放入37 ℃、5% CO2培养24,48,72 h,每孔加入15 μl浓度为5 g/L的MTT溶液,继续培养4 h,去上清,每孔加入150 μl DMSO,37 ℃孵育30 min,检测吸光度值(OD490)。细胞存活率=实验组OD490/对照组OD490×100%。取平均值绘制药物剂量效应曲线,计算药物的半数抑制浓度(IC50)。
1.4 药物协同作用Isobologram分析
根据MTT实验结果,得到不同浓度二甲双胍、紫草素对CNE-2Z细胞的IC50,分别设为M和S,标于横坐标轴和纵坐标轴上,连接M、S两点的直线为相加线。同时根据MTT实验结果,求得不同浓度二甲双胍与低浓度紫草素(3 μmol/L)联用时的IC50浓度b,若Q(a,b)点在MS连线上,则表示两药联用为相加作用;在该连线以下,表示两药联用为协同作用;在该连线以上,表示两药联用为拮抗作用[16]。
1.5 Annexin Ⅴ-FITC/PI双染检测细胞凋亡
选对数期生长状态良好的CNE-2Z细胞,接种于6孔板(3×105个/孔),将细胞分为4组:空白组、二甲双胍组、紫草素组、二甲双胍+紫草素组。待细胞贴壁后,空白组不做处理,二甲双胍组加入浓度为40 mmol/L的二甲双胍药液,紫草素组加入浓度为3 μmol/L的紫草素药液,二甲双胍+紫草素组加入浓度为40 mmol/L的二甲双胍和3 μmol/L的紫草素混合培养液。放入37 ℃、5% CO2的培养箱中培养48 h,用不含EDTA的胰酶消化细胞,600g离心5 min,用PBS清洗2次,其中空白组分为4份,分别为空白对照组、Annexin Ⅴ-FITC组、PI组以及对照组。每组加入200 μl Annexin Ⅴ-FITC结合液,加入2.5 μl的Annexin Ⅴ-FITC染色液,4 ℃避光冰浴15 min加入5 μl PI染色液,继续4 ℃避光冰浴5 min。用流式细胞仪检测细胞凋亡率,此实验重复3次。
1.6 侵袭迁移实验检测细胞侵袭迁移能力
将按1 ∶4稀释好的matrigel铺于Transwell小室滤膜上,置于37 ℃培养箱过夜凝胶。取对数期生长的CNE-2Z细胞以每孔30×104接种于6孔板,贴壁后细胞分为4组:空白组、二甲双胍组、紫草素组、二甲双胍+紫草素组,分别加入2 ml培养液、浓度为40 mmol/L的二甲双胍药液、浓度为3 μmol/L的紫草素药液、浓度为40 mmol/L的二甲双胍和3 μmol/L的紫草素混合药液,37 ℃、5% CO2培养24 h吸除培养液,PBS清洗2次,消化离心细胞,用不含血清的培养液重悬细胞,并调整细胞密度为3×105/ml。每组取100 μl细胞悬液分别加入含有matrigel和不含matrigel的Transwell小室中,向24孔板下室加入500 μl含血清的完全培养液,将接种好的24孔板放入37 ℃、5%CO2的培养箱中继续培养48 h吸去培养液,用4%多聚甲醛4 ℃固定20 min,吸去多聚甲醛,用棉签轻轻擦去matrigel及小室内的细胞,用结晶紫避光染色15 min,PBS洗3次,晾干后于显微镜下观察计数。
1.7 平板克隆形成实验检测细胞集落形成能力
取对数期生长的CNE-2Z细胞以每孔3×105个接种于6孔板,待贴壁后吸去上清并分别加入2 ml培养液、浓度为40 mmol/L的二甲双胍药液、浓度为3 μmol/L的紫草素药液浓度为40 mmol/L的二甲双胍和3 μmol/L的紫草素混合药液,37 ℃、5% CO2培养12 h。吸去培养液,用PBS洗2次,消化离心细胞,用培养液重悬细胞,并调整细胞密度为3×105/ml。取30 μl细胞悬液种于6孔板中,每孔加入2 ml培养液,37 ℃、5% CO2继续培养6 d。每个处理组细胞设置2个复孔,待培养至出现肉眼可见的克隆后,吸去培养液,用PBS清洗3次,用4%多聚甲醛4 ℃固定20 min,吸去多聚甲醛,每孔加入1 ml结晶紫染液,避光染色15 min,PBS洗3次,晾干后于显微镜下计数。
1.8 Western blot法检测Bcl-2、Bax、RIP1、RIP3、MMP9蛋白表达水平
取对数期生长良好的鼻咽癌细胞CNE-2Z细胞,以每孔3×105接种于6孔板,PBS洗2次,加入60 μl含有PMSF的裂解液,4 ℃过夜,4 ℃ 12 000 r/min离心30 min,取上清液,用BCA蛋白定量法测定蛋白浓度,计算出每组样本所需上样量。将蛋白总量相同的样本加入到蛋白凝胶内,90 V恒压待溴酚蓝到达分离胶的底部后终止。80 V恒压将凝胶上的蛋白转移至PVDF膜。室温摇床下用快速封闭液封闭15 min,使用TPBS洗涤5 min,重复3次。按1 ∶1 000的比例分别稀释β-actin、Bcl-2、Bax、RIP1、RIP3、MMP-9一抗,摇床摇晃1 h,4 ℃过夜。用TPBS按照1 ∶5 000稀释的HRP标记山羊抗兔IgG孵育2 h,ECL发光试剂盒显影。
1.9 统计学分析
采用SPSS21.0软件分析实验数据,实验数据以均数±标准差表示,各组间差异采用多因素方差分析和LSD-t检验比较各组间差异,P<0.05为差异有统计学意义。
2 结果
2.1 二甲双胍和紫草素联用对CNE-2Z细胞增殖的影响
MTT结果显示,二甲双胍与紫草素联合作用于细胞48 h,细胞抑制率显著强于二者单药作用(见图1),与单药组相比差异具有统计学意义(P<0.05)。此外,通过Isobologram分析发现,40 mmol/L二甲双胍及其与3 μmol/L紫草素联用对CNE-2Z细胞的IC50坐标(3,40)落在M(二甲双胍IC50)与S(紫草素IC50)相加线左下方(见图2),表明40 mmol/L二甲双胍和3 μmol/L紫草素联用具有协同作用,所以选用40 mmol/L的二甲双胍和3 μmol/L紫草素进行后续实验。
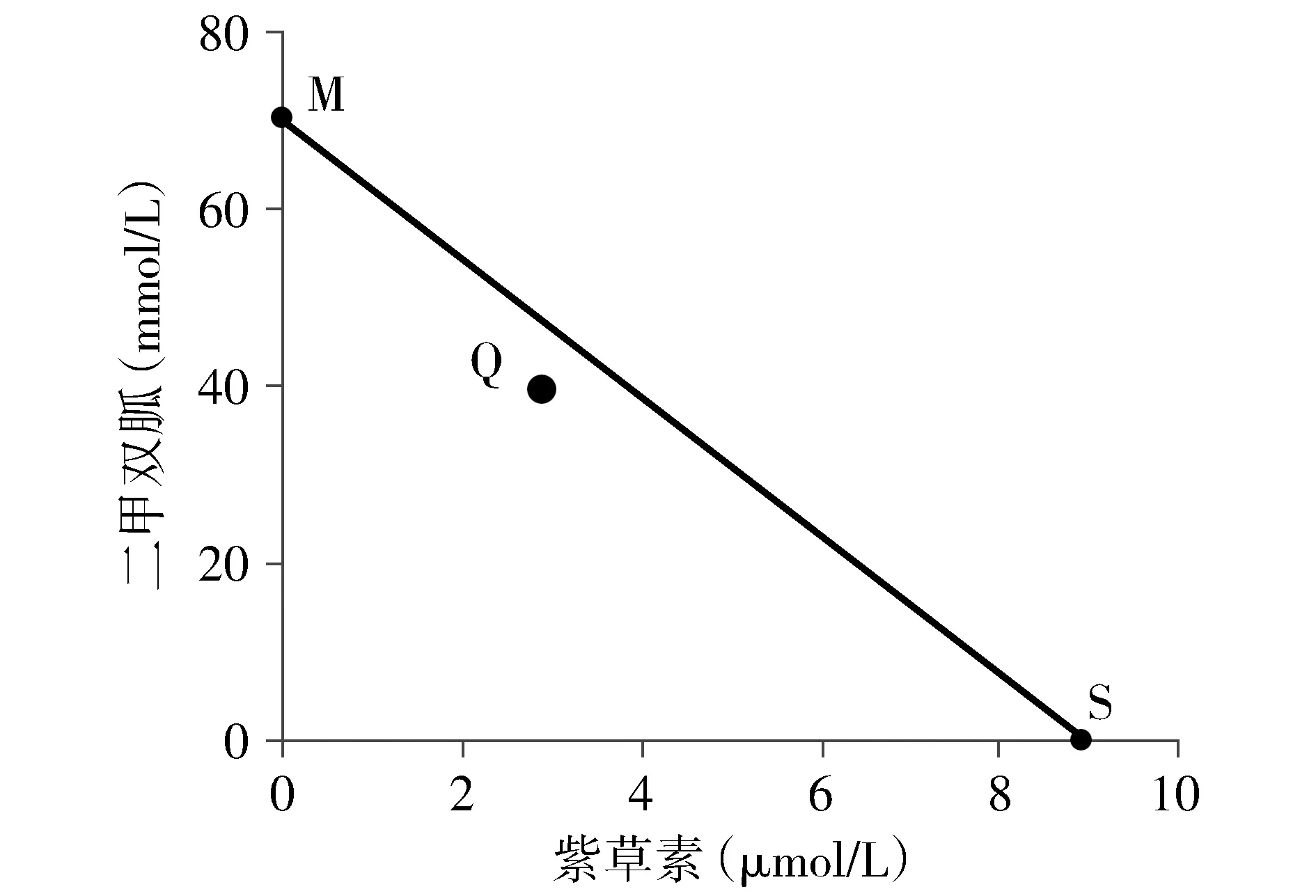
图2 Isobologram分析二甲双胍与紫草素联用的协同作用Figure 2 Isobologram analysis of the synergistic effect of metformin combined with shikonin
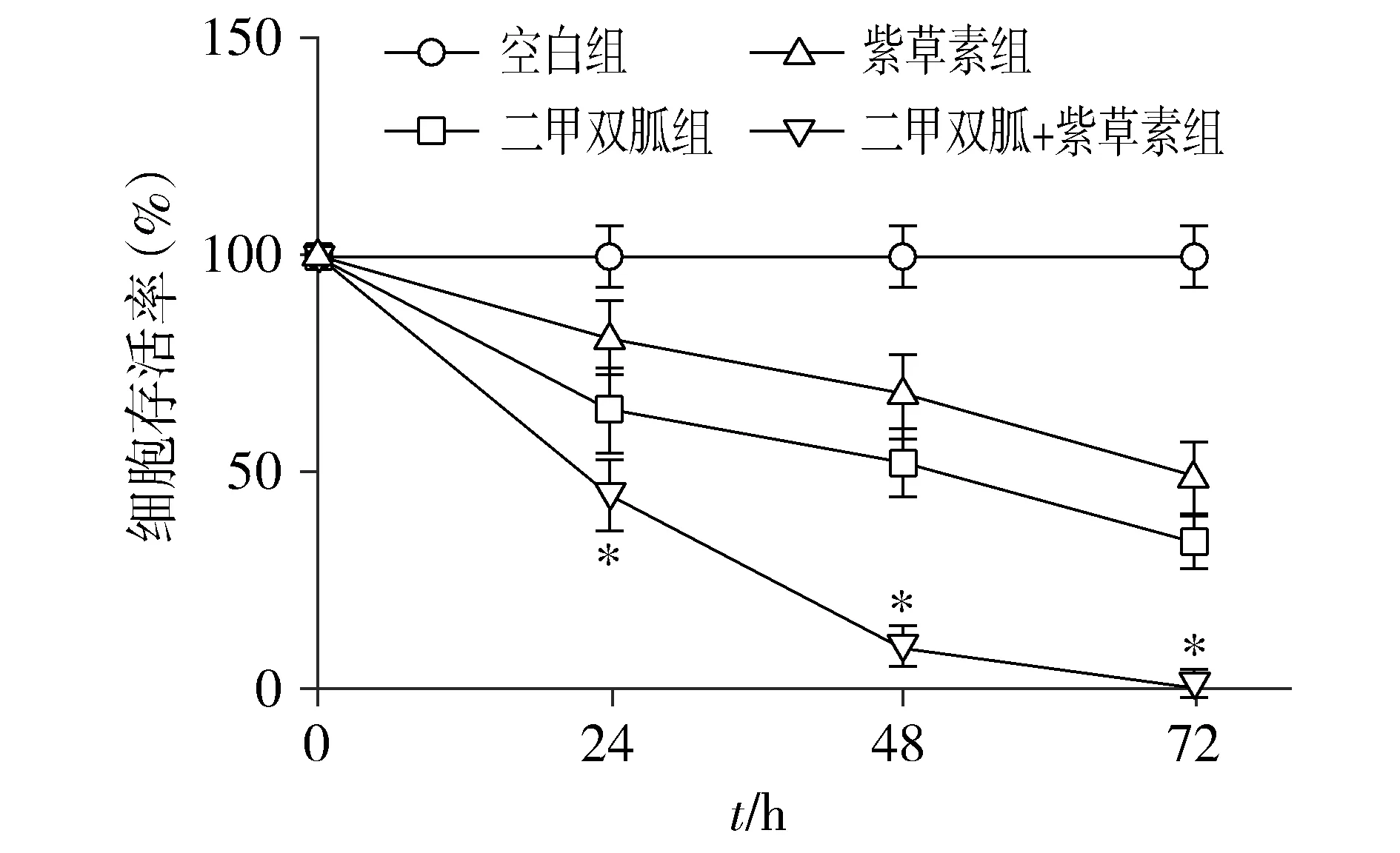
与其他三组比较,*P<0.05图1 不同处理方式对CNE-2Z细胞增殖的影响Figure 1 Effects of metformin and shikonin on proliferation of CNE-2Z cells
2.2 二甲双胍和紫草素联用对CNE-2Z细胞凋亡的影响
Annexin Ⅴ-FITC双染结果显示,空白组凋亡率为9.79%±0.7%,二甲双胍组细胞凋亡率为21.82%±0.5%,紫草素组细胞凋亡率为22.05%±0.5%,二甲双胍+紫草素组细胞的凋亡率为55.8%±0.3%。二甲双胍、紫草素都可以促进CNE-2Z细胞凋亡,且联合效果更加显著,与单药组相比差异具有统计学意义(P<0.05,见图3)。
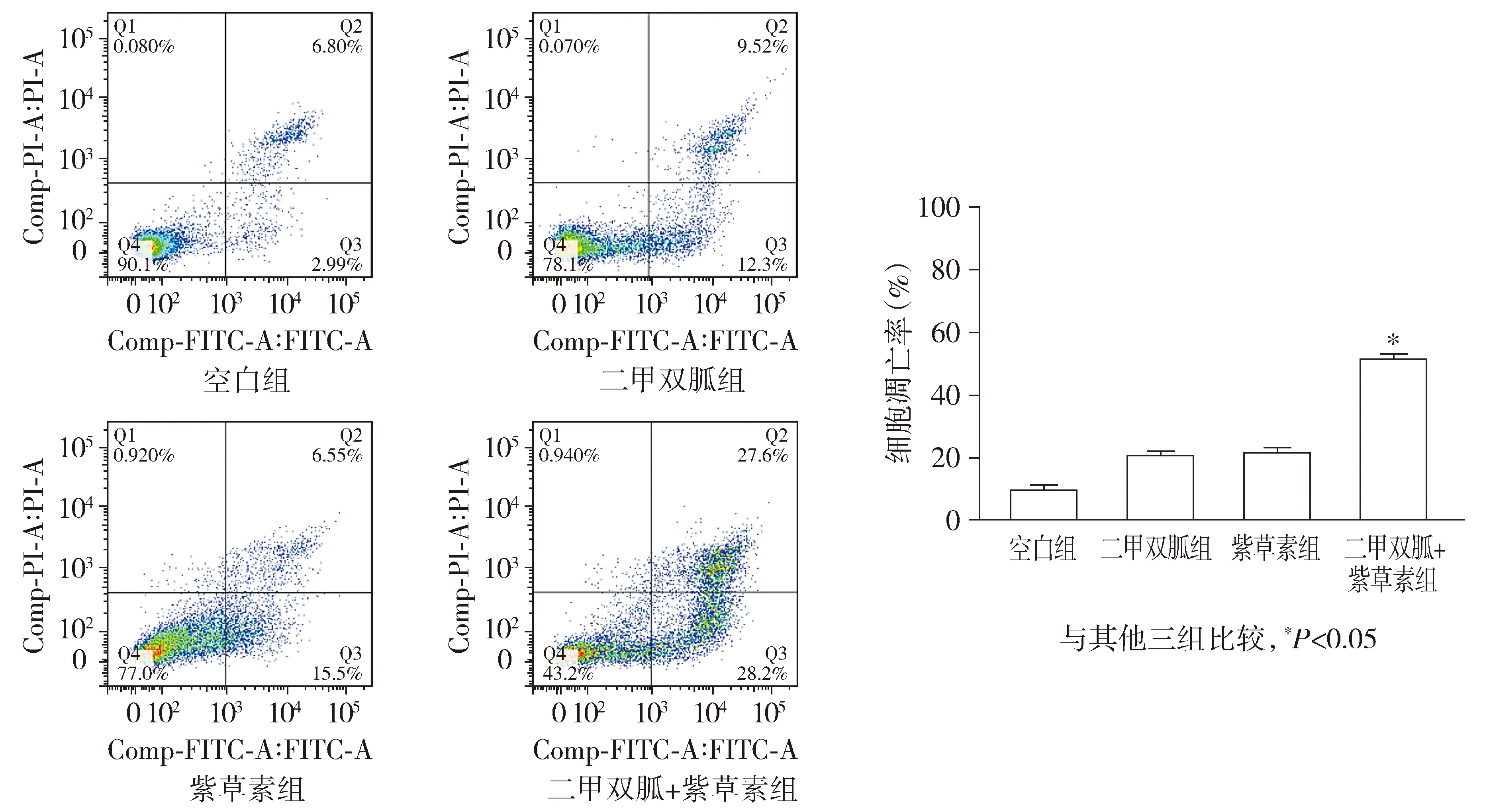
图3 不同处理方式对CNE-2Z细胞凋亡的影响Figure 3 Effects of metformin and shikonin on apoptosis of CNE-2Z cells
2.3 二甲双胍和紫草素联用对CNE-2Z细胞侵袭迁移能力的影响
检测结果表明,与单药相比,二甲双胍和紫草素联用能明显抑制CNE-2Z细胞的侵袭迁移能力,差异具有统计学意义(P<0.05,见图4)。
2.4 二甲双胍和紫草素联用对CNE-2Z细胞克隆形成能力的影响
平板克隆实验结果示,二甲双胍+紫草素组细胞集落数明显低于二甲双胍组、紫草素组,与单药组相比差异具有统计学意义(P<0.05,见图5)。
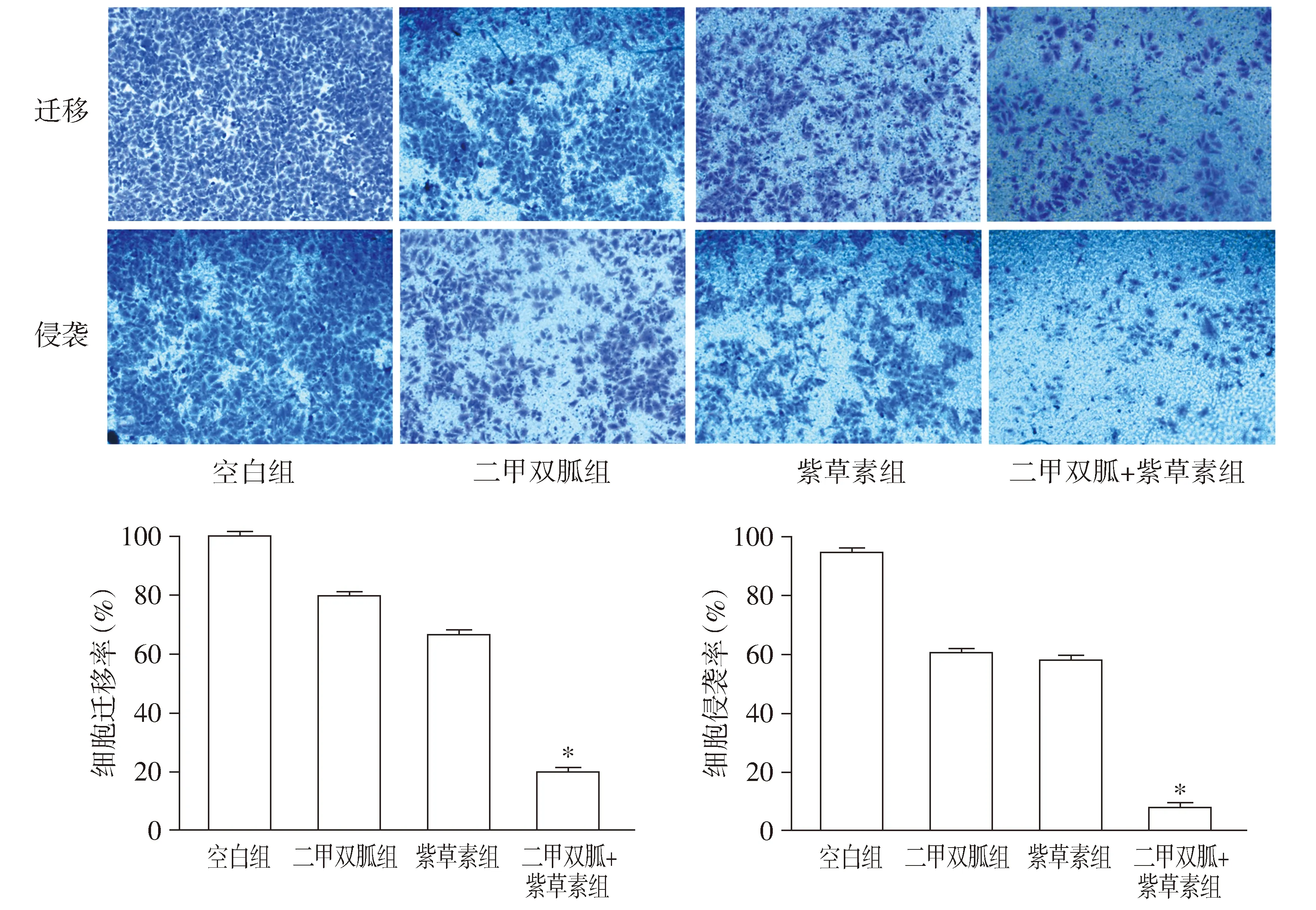
与其他三组比较,*P<0.05图4 不同处理方式对CNE-2Z细胞侵袭迁移能力的影响Figure 4 Effects of metformin and shikonin on invasion and migration of CNE-2Z cells
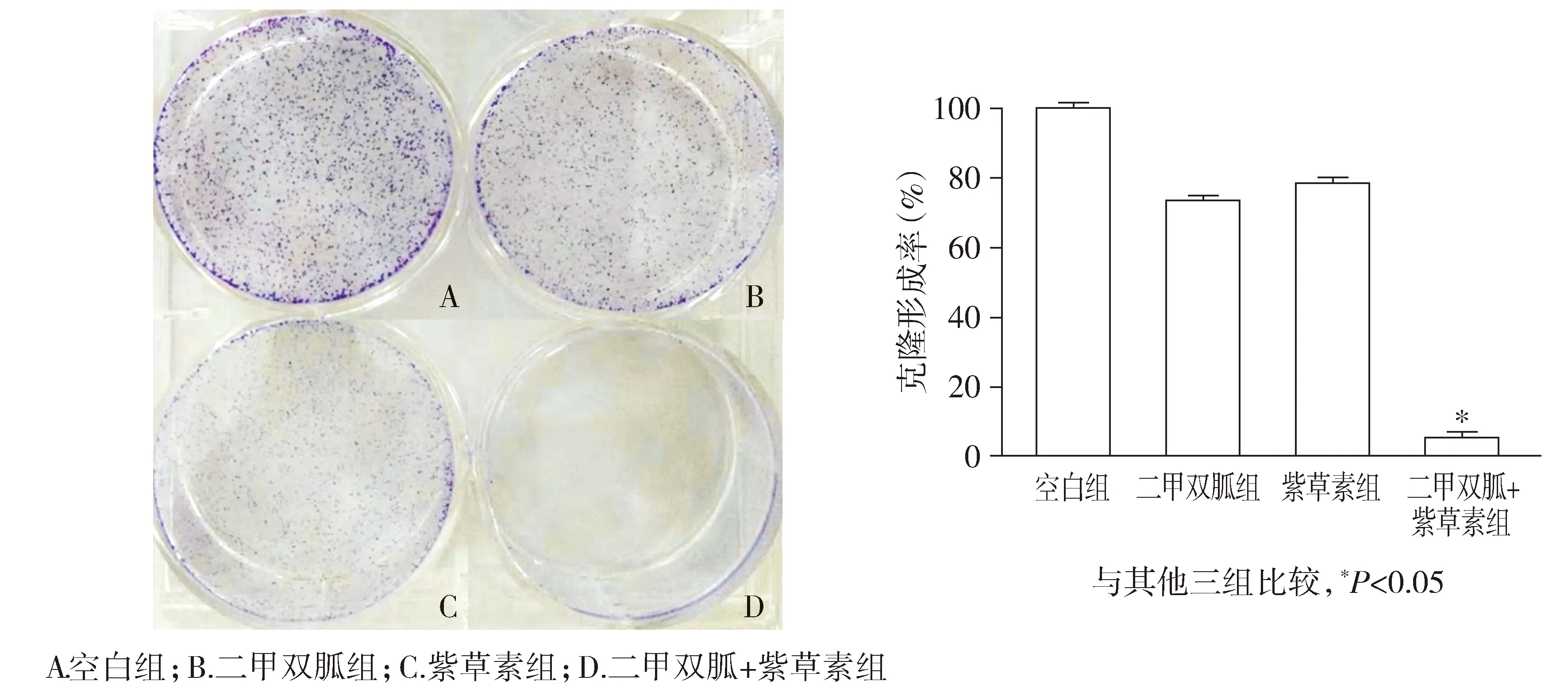
图5 不同处理方式对CNE-2Z细胞克隆形成的影响Figure 5 Effects of metformin and shikonin on the colony formation of CNE-2Z cells
2.5 二甲双胍和紫草素联用对CNE-2Z细胞凋亡相关蛋白Bcl-2、Bax及MMP-9、RIP1、RIP3表达的影响
检测结果表明,二甲双胍和紫草素联用可下调Bcl-2和MMP-9的表达和上调Bax、RIP1和RIP3的表达,与单药组相比,差异具有统计学意义(P<0.05,见图6)。
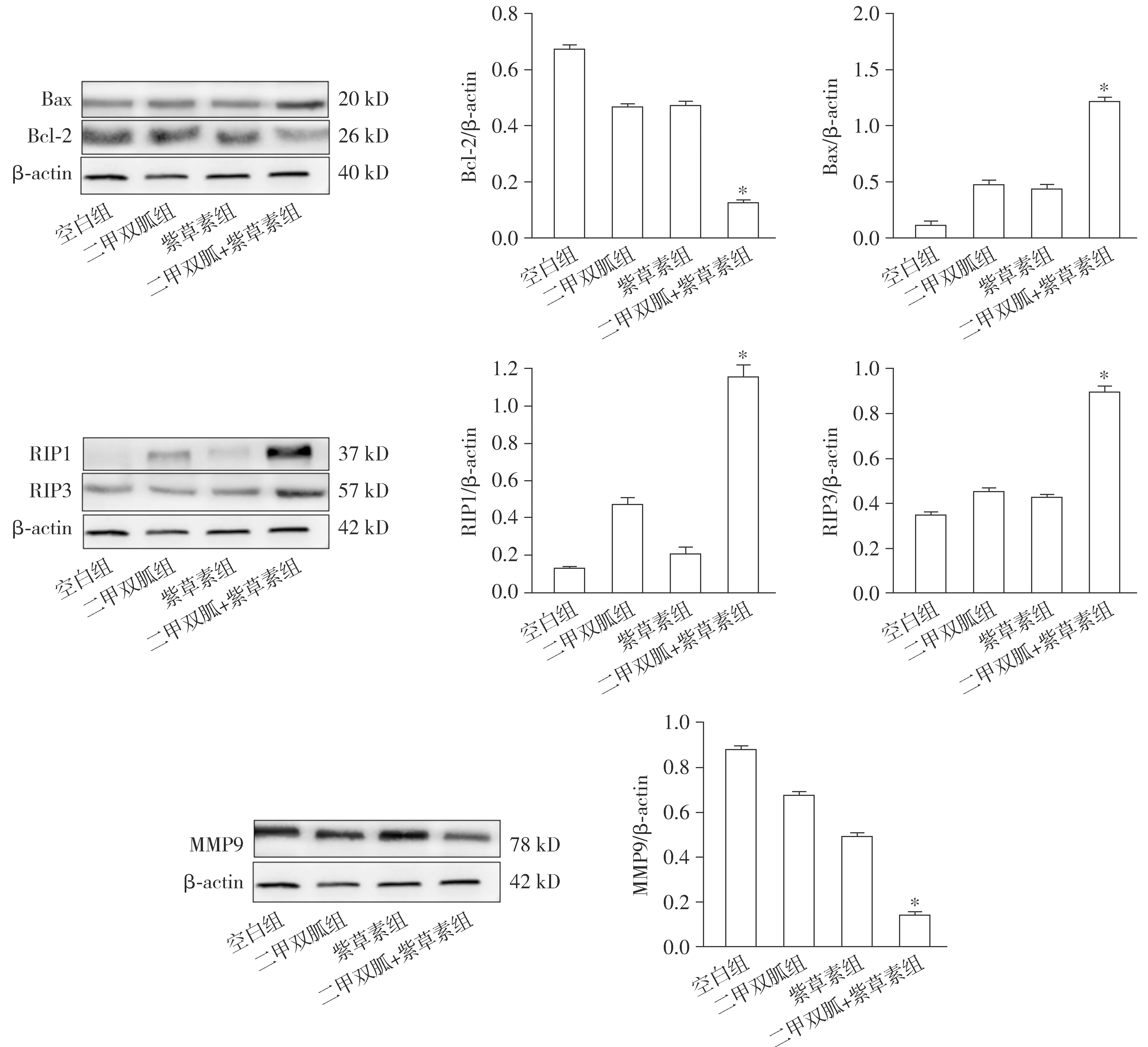
与其他三组比较,*P<0.05图6 不同处理方式对CNE-2Z细胞凋亡相关蛋白表达的影响Figure 6 Effects of metformin and shikonin on expression of apoptosis-related proteins in CNE-2Z cells
3 讨论
鼻咽癌是我国高发恶性肿瘤之一,且近年来发病人群有逐渐扩大的趋势,肿瘤细胞由于其快速生长的特点,并且肿瘤组织的血管结构异常导致供血减少,故缺氧是肿瘤细胞普遍存在的状态,因此糖酵解在肿瘤细胞中代谢活跃。二甲双胍抗肿瘤细胞的增殖和凋亡作用是近几年的研究热点,它作为降糖药物最重要的机制便是AMPK依赖的降糖机制。它能特异性地抑制细胞中的线粒体呼吸链酶复合体Ⅰ,下调丙酮酸脱氢酶表达,引起线粒体有氧呼吸功能减弱、三磷酸腺苷(adenosine triphosphate,ATP)生成减少,AMP/ATP的比例升高,从而激活AMPK,抑制糖质新生、脂肪生成和蛋白质合成,因此,AMPK同样可以通过此途径抑制肿瘤细胞增殖[3]。丙酮酸激酶作为糖酵解的限速酶,其亚型PKM2在肿瘤细胞里特异、高度表达,紫草素作为一种萘醌类物质普遍认为是PKM2的抑制剂,其抗肿瘤机制研究已取得一定进展,它通过抑制肿瘤细胞糖酵解,导致肿瘤细胞能量供应不足从而抑制其增殖[17],除此之外,紫草素还能够通过调控受体相互作用蛋白1(receptor-interacting protein 1,RIPK1)/受体相互作用蛋白3(receptor-interacting protein 3,RIPK3)的表达诱导细胞发生坏死性凋亡。
凋亡蛋白Bcl-2和Bax的作用机制是通过线粒体途径介导cyt-c等物质的释放、改变线粒体外膜的通透性、改变线粒体形态、影响膜间隙蛋白释放及caspase级联活化等途径影响细胞凋亡过程而调控细胞凋亡[18-21],二甲双胍和紫草素联合作用时Bcl-2活性下调,Bax活性上调且较单药作用更明显,说明联合用药可能调控线粒体凋亡途径促进CNE-2Z细胞凋亡且较单药作用更强。
MMP9能够专一降解基膜中的Ⅳ型胶原蛋白,从而使肿瘤细胞失去阻隔作用,促进肿瘤细胞的侵袭、转移。坏死性凋亡是紫草素诱导细胞凋亡方式之一,RIP1和RIP3是坏死性凋亡的关键蛋白,RIP1通过激酶依赖性和非依赖性功能调节细胞死亡和炎症,RIP1和RIP3最后通过磷酸化的方式形成复合体,诱导细胞凋亡[22]。当二甲双胍和紫草素联合作用于CNE-2Z细胞时,MMP9活性较单药明显降低,RIP1和RIP3活性较单药明显增高,表明联合用药可抑制肿瘤细胞基膜降解并协同促进紫草素诱导的坏死性凋亡作用。
综上,二甲双胍联合紫草素作用于鼻咽癌CNE-2Z细胞具有协同作用,可通过激活线粒体凋亡途径[23,24]、促进细胞坏死性凋亡来诱导细胞凋亡,及降低MMP9活性从而抑制鼻咽癌细胞CNE-2Z的侵袭转移。

