Bi2S3/BiOCl复合材料的制备及光催化性能的研究∗
艾礼莉,王鲁香,贾欣欣,贾殿赠
(新疆大学 化学学院,新疆 乌鲁木齐830046)
0 引言
随着工业社会的高速发展,水污染、大气污染和土壤污染日益严重,这些环境污染问题不仅破坏了生态环境,而且严重危害人类的身体健康[1,2].水体中的六价铬[Cr(VI)]具有高毒性、高致癌性、强迁移性及难降解性.Cr(VI)可以通过消化道、呼吸道、皮肤和粘膜侵入人体,并积聚在肝、肾和内分泌腺中,对人体产生慢性毒害.相比之下,三价铬[Cr(III)]对人体几乎不产生毒害作用.因此,可以将剧毒的Cr(VI)还原为低毒的Cr(III),从而解决Cr(VI)的污染问题.目前应用于废水中去除Cr(VI)的方法主要有化学法、物理化学法、生物法和光催化法.化学法、物理化学法和生物法易造成二次污染,而光催化法是半导体材料利用光能产生强氧化性的空穴和强还原性的电子,从而实现对Cr(VI)的还原,无需添加其它化学试剂,具有绿色、简单、高效等优点[3,4].目前,以TiO2为代表的光催化材料还存在可见光吸收差、光生电子与空穴复合几率较高等缺点.铋基材料作为一类新型的光催化材料,具有光谱响应范围宽、廉价易得等优点[5].BiOCl是一种典型的铋基光催化材料,其层状结构有利于电子的跃迁和转移,但其带隙值通常在3.2 eV左右,属于紫外光响应的光催化剂[6,7].为了扩展其对可见光的吸收范围,可将BiOCl与窄带隙半导体光催化材料复合,以增强其对可见光的响应能力[8].Tang等人[9]通过简单的水热法制备出CdS/BiOCl异质结,在模拟光照条件下,CdS/BiOCl异质结比单一纯相的BiOCl和CdS表现出更高的罗丹明B光催化降解能力,这可归因于CdS/BiOCl异质结能够促使光生电子-空穴对的有效分离.此外,Bi2MoO6/BiOCl[10]、BiOBr/BiOCl[11]等复合材料也相继被报道,与纯相BiOCl相比,这些复合材料展现出良好的光催化性能.
基于以上考虑,本文首先在水热条件下制备了BiOCl纳米片,由于Bi2S3的溶度积常数(Ksp= 1.0 × 10−97)远远小于BiOCl的溶度积常数(Ksp= 1.8 × 10−31),因此在BiOCl纳米片的悬浮液中加入不同浓度的Na2S溶液,通过水热反应制备出Bi2S3/BiOCl复合材料.利用X射线粉末衍射仪、场发射扫描电子显微镜、紫外可见漫反射光谱、荧光光谱以及紫外可见吸收光谱等分析手段,系统研究了Na2S溶液浓度对复合光催化材料物相组成、形貌及光催化还原Cr(VI)性能的影响.
1 实验部分
1.1 试剂与仪器
本文所使用的试剂主要有五水硝酸铋[Bi(NO3)3·5H2O]、氯化钠(NaCl)、甘露醇(C6H14O6)、九水硫化钠(Na2S·9H2O)、重铬酸钾(K2Cr2O7)和去离子水.主要表征仪器设备有X射线粉末衍射仪(XRD,BrukerD8 Advance,德国)、场发射扫描电子显微镜(FESEM,Hitachi S-4800,日本)、紫外可见分光光度计(Hitachi U-3010,日本)、荧光分光光度计(Hitachi F-4500,日本)和光催化反应仪(南京胥江XPA,中国).
1.2 Bi2S3/BiOCl复合材料的制备
通过水热法制备Bi2S3/BiOCl复合材料,首先通过水热反应制备出BiOCl纳米片.将0.486 g Bi(NO3)3·5H2O(1 mmol)溶解在25 mL 0.1 mol/L甘露醇溶液中,搅拌10 min.随后将5 mL饱和NaCl溶液缓慢滴入上述混合物中,得到均匀的白色悬浮液,继续搅拌30 min后转移至50 mL水热反应釜中,并在160◦C下反应3 h.所得产物用蒸馏水洗涤数次,离心、冷冻干燥后得到BiOCl纳米片.
取30 mg BiOCl纳米片,超声分散在20 mL的去离子水中得到悬浮液.随后,向上述悬浮液中加入15 mL 不同浓度的Na2S溶液,再将混合物转移至50 mL水热反应釜中,并在150◦C下反应8 h.所得产物用蒸馏水洗涤数次,离心、冷冻干燥后得到最终产物.当Na2S溶液的浓度为0.008 mol/L、0.016 mol/L、0.024 mol/L时,所得产物分别命名为S-1、S-2、S-3.
1.3 光催化实验
将10 mg的光催化剂添加到装有50 mL Cr(VI)溶液(10 mg L−1,基于K2Cr2O7中Cr的浓度)的石英管中.为了达到吸附脱附平衡,将悬浮液超声处理10 min,并在黑暗中磁力搅拌30 min.在光催化反应过程中,每隔10 min取出2 mL悬浮液,离心后获得上清液,上清液中Cr(VI)的浓度通过二苯碳酰二肼法(DPC)[3]进行测试.
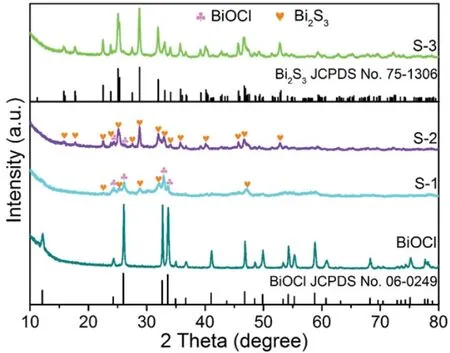
图1 添加不同浓度的Na2S溶液所得产物的XRD图Fig 1 XRD patterns of the as-synthesized products obtained by adding different concentrations of Na2S solution
2 结果与讨论
2.1 物相分析
利用XRD对样品的物相进行分析,测试结果如图1所示.在水热条件下制备的纯相BiOCl的衍射峰与四方晶系的BiOCl(JCPDS No.06-0249,a=3.891 °A,b=3.891 °A,c=7.369 °A,α=β=γ=90°)完全吻合.随后,将所制备的BiOCl在0.008 mol/L的Na2S溶液中进行水热反应,所得产物S-1在22.4°、25.0°、28.7°、31.9°和46.8°出现了新的XRD衍射峰,分别对应于正交晶系的Bi2S3(JCPDS No.75-1306,a=11.11 °A,b=11.25°A,c=3.97°A,α=β=γ=90°)的(220)、(130)、(211)、(221)和(501)晶面,说明产物为Bi2S3/BiOCl的复合材料.当Na2S溶液的浓度增大到0.016 mol/L后,所得产物S-2中的Bi2S3衍射峰更加明显,在24.1°和25.8°处两个弱衍射峰对应于四方晶系BiOCl的特征峰,表明S-2也为Bi2S3/BiOCl的复合材料.当Na2S溶液的浓度增加至0.024 mol/L时,产物S-3的衍射峰与正交晶系的Bi2S3完全一致,且未观察到BiOCl的衍射峰,说明S-3是纯相的Bi2S3.
2.2 形貌分析
从图2(a)的FESEM照片可以看出,纯相BiOCl为规则的矩形纳米片.加入0.008 mol/L的Na2S溶液后,产物S-1中的纳米片破碎变小(图2(b));当加入0.16 mol/L的Na2S溶液后,产物S-2(Bi2S3/BiOCl)的形貌变成了不规则的纳米颗粒,颗粒尺寸进一步变小(图2(c)).这种不规则纳米颗粒形成原因可能是由于Bi2S3(Ksp= 1.0×10−97)的溶解度远低于BiOCl(Ksp=1.8×10−31),因此当加入Na2S溶液后,BiOCl在热力学上更倾向于与S2−发生阴离子交换反应,从而破坏了BiOCl原有规则的片状形貌,最终形成了Bi2S3/BiO Cl复合材料.当加入过量的Na2S后,BiOCl被完全硫化后转变为Bi2S3,其颗粒尺寸变化较小,略有团聚(图2(d)).

图 2 不同Na2S浓度下所得产物的FESEM图:(a)BiOCl, (b)S-1, (c)S-2, (d)S-3Fig 2 FESEM images of the products obtained at different concentrations of Na2S: (a) BiOCl,(b) S-1, (c) S-2, (d) S-3
2.3 光谱特性分析
通过紫外可见漫反射光谱评价所得产物的光吸收性能.从图3(a)可以看出,纯相BiOCl仅在紫外光下有较强的吸收,吸收边带约在360 nm,几乎不能吸收可见光.当与Bi2S3复合后,所得Bi2S3/BiOCl复合材料对可见光的吸收明显增强.利用Tauc公式计算了纯相BiOCl和Bi2S3/BiOCl的带隙值.如图3(b)所示,纯相BiOCl的带隙值为3.46 eV,而Bi2S3/BiOCl的带隙值仅为1.68 eV,较小的带隙值有利于其对可见光的吸收.因此,通过与带隙较窄的Bi2S3复合,进而将紫外光响应的BiOCl调控为可见光响应的Bi2S3/BiOCl复合材料.
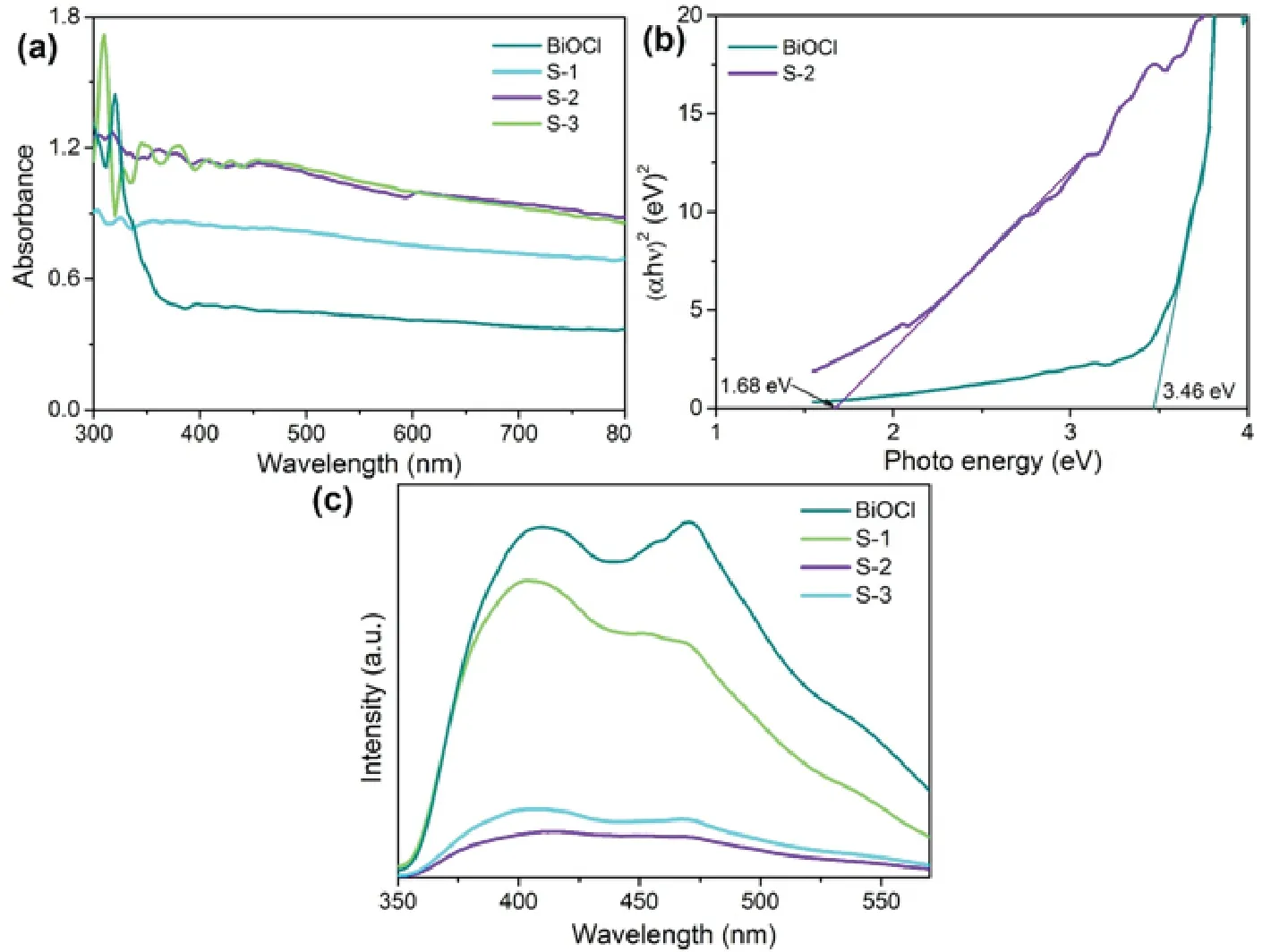
图3 不同制备条件下所得产物的(a)紫外可见漫反射光谱,(b)BiOCl和S-2的Tauc 图,(c)荧光光谱Fig 3 (a) UV-visible diffuse reflectance spectra of the products prepared under different preparation conditions,(b) Tauc plots of BiOCl and S-2, (c) PL spectra
利用荧光光谱探究光催化剂中光生电子和空穴的分离效率.从图3(c)可以看出,纯相BiOCl在四个样品中的荧光发射强度最高,说明其光生电子和空穴的复合几率较高;相比之下,Bi2S3/BiOCl复合材料的荧光发射强度大幅度降低,说明复合材料中光生载流子的分离效率有了明显提高,这有利于其光催化性能的提高.不同浓度的Na2S所得Bi2S3/BiOCl复合材料的发光强度差异明显,当Na2S的浓度为0.016 mol/L时所得产物S-2的发光强度最低,说明S-2中光生电子和空穴的复合几率最低,即分离效率最高.
2.4 光催化还原Cr(VI)的性能研究
图4(a)为不同样品在模拟可见光(350 W Xe灯,加420 nm滤光片)下对Cr(VI)的光催化还原曲线.从图4可以看出,随着光照时间的延长,Cr(VI)的浓度不断降低.定量分析表明,在光照60 min后,BiOCl、S-1、S-2和S-3分别能够将1.6%、43.1%、76.9%和59.3%的Cr(VI)还原为Cr(III),其中样品S-2的光催化性能最佳(图4(b)).对各样品的光催化还原曲线进行拟合,发现Cr(VI)的光催化还原过程符合准一级动力学方程:
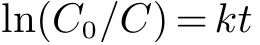
式中:C0为Cr(VI)的初始浓度;C为t时间下Cr(VI)的浓度;k为光催化反应的表观速率常数;t为光催化还原时间.如图4(c)和图4(d)所示,样品S-2的表观速率常数k最大(1.3×10−2min−1),该值分别是纯相BiOCl、S-1、S-3的43倍、2.9倍和1.6倍,说明Bi2S3/BiOCl复合材料能够有效的拓展BiOCl的光吸收能力,并提高光生载流子的分离效率,进而明显提高复合材料光催化还原Cr(VI)的能力.
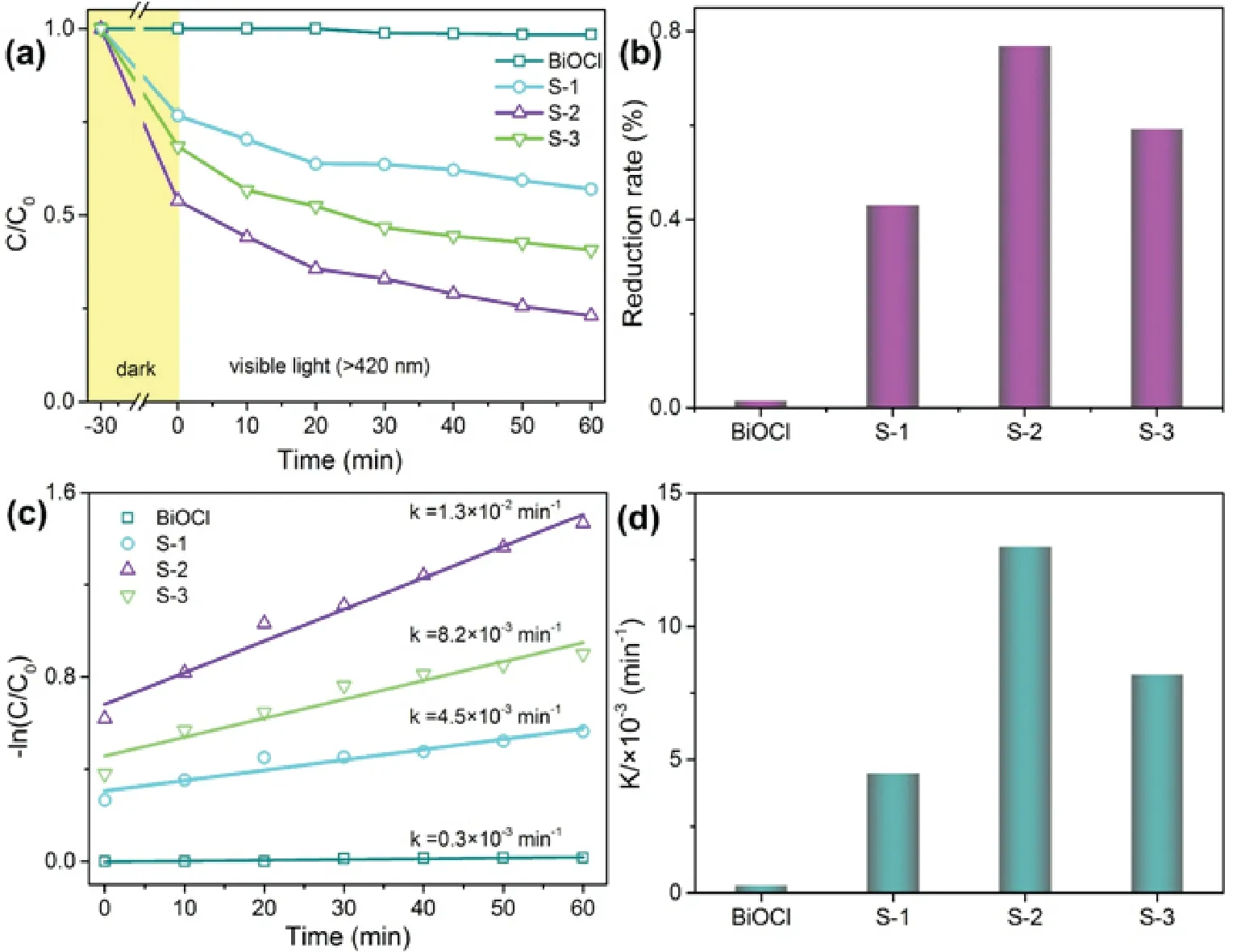
图4 (a)可见光下不同产物对Cr(VI)的还原曲线;(b)光照60 min后样品对Cr(VI)的光催化还原效率;(c)准一级动力学拟合曲线;(d)样品光催化反应的表观速率常数Fig 4 (a) Photocatalytic reduction curves of Cr(VI) by the different products under visible light, (b) Photoreduction efficiency of Cr(VI) for samples after illumination for 60 min, (c) pseudo-first-order kinetics fitting curves,(d) the apparent rate constant of the photocatalytic reduction process
3 结论
本文首先通过水热法制备出纯相BiOCl纳米片,然后以Na2S为硫源,再通过水热反应得到Bi2S3/BiOCl复合材料.利用XRD、FESEM、紫外可见漫反射光谱、荧光光谱对所得样品的物相、形貌、光吸收特性和光生载流子分离效率进行了研究.与仅对紫外光有响应的BiOCl相比,Bi2S3/BiOCl复合材料的光谱吸收范围从紫外扩展到可见光区,且对光生电子和空穴有较高的分离效率.在可见光照射下评价了不同条件下所得样品对重金属Cr(VI)的光催化还原性能,研究发现Bi2S3/BiOCl复合材料具有最佳的光催化性能,在光照60 min后能够将76.9%的Cr(VI)还原为Cr(III).研究结果表明,通过制备Bi2S3/BiOCl复合材料可以有效扩展单相BiOCl的光谱吸收范围,且提高了复合材料光生载流子的分离能力,从而有效改善了复合材料的光催化性能,为制备高效的可见光催化剂提供了新思路.

