miR-199a-5p对心脏缺血再灌注细胞模型细胞活力和细胞凋亡的影响及可能机制探究
郭玉冰,王 皓,谷云飞
(洛阳市中心医院,河南 洛阳 471000)
心肌细胞凋亡在诸多类型心血管疾病发生及演变过程中发挥推进作用,该过程所需时间极为短暂,复杂程度极高又易被忽略,且其启动和演变过程涉及诸多基因调节,故揭示心肌细胞凋亡相关因素及其调节机制有利于为疾病早期评估及治疗提供新靶点[1-2]。微小RNA (microRNA, miRNA)具有基因调控功能,可参与各种心脏疾病病理生理环节[3]。相关报道[4-5]显示,许多类型miRNA在正常成熟心脏组织中的表达水平较其他组织显著增加,如miR-1、miR-133、miR-208等,若以上miRNA表达水平出现异常可导致其下游相关调节基因表达水平发生变化,进而在诸多病理过程介导下引发相关疾病。既往研究[6]已证实,miRNA可作用于细胞增殖、凋亡、血管生成等诸多生理病理过程并扮演重要角色。微小RNA-199a-5(microRNA-199a-5p,miR-199a-5p)属于miRNA家族成员,其在缺氧环境下表达量明显减少,可解除对其靶基因缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)表达的抑制,导致HIF-1α表达水平升高进而降低细胞凋亡[7]。另有报道[8]显示,上调miR-199a-5p表达后可成功诱导心肌细胞肥大。miR-199a-5p在心肌细胞凋亡中的作用和机制还尚未见报道。诸多研究报道证实,心肌细胞凋亡可导致正常心肌细胞损失,这是引发心力衰竭产生的重要机制,而miRNA可广泛参与细胞凋亡[9]。故本次研究旨在探究miR-199a-5p对心脏缺血再灌注细胞模型细胞活力和细胞凋亡的影响及可能机制。
1 材料与方法
1.1 实验材料 H9C2细胞株购于深圳市豪地华拓生物科技有限公司。
1.2 主要试剂与仪器
1.2.1 试剂:实时荧光定量PCR试剂盒购于北京鼎国昌盛生物技术有限责任公司;TUNEL试剂盒购于武汉纯度生物科技有限公司;Trizol购于哈尔滨新海基因检测有限公司;MTS试剂盒购于上海哈灵生物科技有限公司;胎牛血清购于武汉普诺赛生命科技有限公司;胰酶购于滁州仕诺达生物科技有限公司;兔抗HIF-1α、GSK3β、p-GSK3β抗体购于南京赛泓瑞生物科技有限公司。
1.2.2 仪器:超净工作台购于广州浩翰仪器有限公司;低速离心机购于南京贝登医疗股份有限公司;-80 ℃超低温冰箱购于北京祥生兴业科技有限公司;实时荧光定量PCR扩增仪购于广州辉骏生物科技股份有限公司。
1.3 方法 (1)利用H9C2细胞株建立氧糖剥夺再灌注模型,模拟心肌细胞缺血再灌注。利用miR-199a-5p inhibitor抑制H9C2细胞中miR-199a-5p的表达,细胞分组为空白对照组、模型组、miR-199a-5p inhibitor组。采用实时荧光定量PCR(qRT-PCR)法检测空白对照组、模型组H9C2细胞中miR-199a-5p的表达水平。(2)采用MTT法检测各组H9C2细胞活力。将生长状态良好的H9C2细胞株按1×104/孔植于96孔板中,每孔均更换100 μL无血清DMEM培养基,并加入20 μL MTS,然后将其放入避光处孵育1 h,酶标仪于OD值4 890 nm处测定每孔吸光度值。(3)应用TUNEL细胞凋亡原位检测法分析各组H9C2细胞凋亡能力,取细胞进行复灌,然后采用PBS液冲洗3 次,每孔中注入300 μL 4%多聚甲醛,并于室温下固定20 min,再次采用PBS液冲洗3 次,每孔中注入1% 200 μL Triton X-100溶液,并置于室温下5 min,促进其渗透,采用PBS液冲洗3 次,取提前配置好的50 μL TdT酶反应液注入每孔,放入37 ℃恒温箱中避光孵育1 h,采用PBS液冲洗3 次,取Streptavidin-Fluorescein反应液注入每孔,放入37 ℃恒温箱中避光孵育30 min,采用PBS液冲洗3 次,取DAPI染色液复染细胞核7 min,采用PBS液冲洗3 次,最后应用90%甘油封片,并置于倒置显微镜下观察。每组H9C2细胞凋亡率以绿色荧光细胞核占蓝色荧光细胞核百分比表示。(4)应用Western blot检测各组H9C2细胞中HIF-1α、糖原合成激酶3β(Glycogen synthesis kinase 3β,GSK3β)、p-GSK3β蛋白表达水平。吸弃管内的培养液,加入冷PBS液冲洗细胞2 次;将贴壁细胞、转移细胞混合液置于离心机,以1 000 r/min离心10 min,加入PBS液冲洗,置于离心机,以1 000 r/min离心5 min;加入5 μL磷酸酶抑制剂、1 μL蛋白酶抑制剂混匀,置于冰上数分钟备用;将细胞冲洗后置于预冷的离心管,加入Lysis Buffer混合液后,置于摇床上震荡30 s,置于冰上数分钟,置于离心机以14 000 r/min离心5 min等待检测。
1.4 统计学方法 所有数据分析应用SPSS 18.0处理,各组H9C2细胞OD值、凋亡率等计量资料采用(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差或student's-t分析,P<0.05视为差异具有统计学意义。各实验均重复3 次。
2 结果
2.1 各组H9C2细胞中miR-199a-5p表达水平比较 利用H9C2细胞株建立氧糖剥夺再灌注模型,模拟心肌细胞缺血再灌注。qRT-PCR检测发现模型组H9C2细胞中miR-199a-5p的表达水平显著高于空白对照组(P<0.05)。(表1)
表1 各组H9C2细胞中miR-199a-5p表达水平比较(±s,n=9)

表1 各组H9C2细胞中miR-199a-5p表达水平比较(±s,n=9)
分组 miR-199a-5p空白对照组 1.00±0.01模型组 4.98±0.42 t 29.958 P<0.001
2.2 敲低miR-199a-5p对各组H9C2细胞活力及凋亡的作用 采用MTT法和TUNEL染色分别检测各组H9C2细胞活力,研究发现模型组H9C2细胞OD值显著低于空白对照组,凋亡率显著高于空白对照组(P<0.05)。miR-199a-5p inhibitor组H9C2细胞OD值显著高于模型组,凋亡率显著低于模型组(P<0.05)。(表2,图1)
表2 各组H9C2细胞OD值、凋亡率比较(±s,n=9)

表2 各组H9C2细胞OD值、凋亡率比较(±s,n=9)
注:与空白对照组相比,*P<0.05;与模型组相比,#P<0.05。
分组 OD值 凋亡率(%)空白对照组 1.05±0.05 4.23±0.12模型组 0.69±0.15* 38.12±4.15*miR-199a-5p inhibitor组 0.98±0.09# 12.45±2.05#

图1 各组H9C2细胞凋亡能力比较
2.3 敲低miR-199a-5p对各组H9C2细胞HIF-1α、p-GSK3β、GSK3β蛋白表达水平的作用 应用Western blot检测各组H9C2细胞中HIF-1α、GSK3β、p-GSK3β蛋白表达水平。研究发现模型组H9C2细胞HIF-1α、p-GSK3β蛋白表达水平均显著低于空白对照组。miR-199a-5p inhibitor组H9C2细胞HIF-1α、p-GSK3β蛋白表达水平均显著高于模型组(P<0.05)。(表3,图2)
表3 各组H9C2细胞HIF-1α、p-GSK3β/GSK3β蛋白表达水平比较(±s,n=9)

表3 各组H9C2细胞HIF-1α、p-GSK3β/GSK3β蛋白表达水平比较(±s,n=9)
注:与空白对照组相比,*P<0.05;与模型组相比,#P<0.05。
分组 HIF-1α p-GSK3β/GSK3β空白对照组 1.00±0.02 1.12±0.05模型组 0.69±0.05* 0.64±0.03*miR-199a-5p inhibitor组 0.82±0.02# 0.91±0.06#
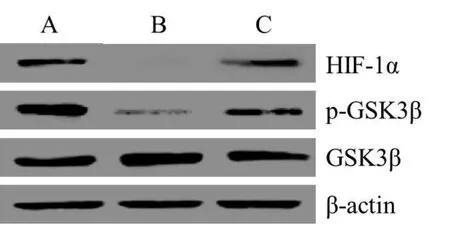
图2 各组H9C2细胞HIF-1α、p-GSK3β/GSK3β蛋白表达水平比较
3 讨论
虽然当前社会医疗水平高速发展,且人们对疾病预防及早期评估日益重视,然而心血管疾病仍是引发人们死亡的主要原因之一[10]。相关数据显示,心血管疾病导致人类死亡总数占全球人类死亡总数的30%左右,而出现急性心肌梗死的患者经溶栓治疗或冠脉介入治疗后导致的心肌缺血再灌注损伤是临床尚未解决的难题之一。临床文献[11]显示,氧自由基、心肌细胞凋亡等因素均可诱发心肌缺血再灌注损伤,然而其具体作用机制并未完全阐释。随着研究的不断深入,已有多项报道显示miRNAs可用于评估心血管疾病。临床研究[12]显示,miRNAs可通过其相关靶基因调节相关信号通路,参与相关生物学行为。另有报道[13]显示,miRNAs组织特异性明显,其不仅可参与心血管系统病理生理状态,亦与血管性疾病联系紧密。miR-199a-5p可参与阿托伐他汀干预心肌缺血再灌注损伤相关环节并发挥关键作用。临床研究[14]显示,在低氧环境下miR-199a表达水平减少,HIF-1及血管生长因子表达水平增加,最终达到缓解心肌组织血供及氧供的目的。HIF作为一种转录因子,其与氧联系紧密,可参与机体对低氧环境适应过程及脑卒中等疾病病理相关环节[15]。HIF-1由α、β两种亚基构成,其中α在整个过程中的作用更为重要。相关文献显示,HIF-α在正常环境下不易被检测到,仅少量可进入胞核并结合HIF-1β进而产生HIF-1复合物而发挥重要作用。临床研究报道,HIF-1α可通过激活诸多类型基因表达进而作用于糖酵解、葡萄糖摄取等过程。除此之外,HIF-1α对缺氧心肌作用亦具有双重性,其过度被活化可导致心肌恶化。GSK-3β活化后可加速细胞凋亡,失活可阻断细胞凋亡。临床研究显示,相关上游信号通路活化后可阻断GSK-3β活性,进而阻断1-甲基-4-苯基-1,2,3,6-四氢吡啶开放,最终达到缓解心肌缺血再灌注损伤的目的。本研究结果显示,模型组H9C2细胞中miR-199a-5p的表达水平显著高于空白对照组(P<0.05)。miR-199a-5p inhibitor组H9C2细胞OD值显著高于模型组,凋亡率显著低于模型组(P<0.05)。说明敲低miR-199a-5p表达水平后可明显缓解H9C2细胞糖氧剥夺复氧复糖损伤所导致的细胞活力减少,此外亦具有阻断细胞凋亡的作用。miR-199a-5p inhibitor组H9C2细胞HIF-1α、p-GSK3β蛋白表达水平均显著高于模型组(P<0.05)。说明miR-199a-5p可通过调控HIF-1α、p-GSK3β表达水平以达到改善心脏缺血再灌注损伤的目的。
综上所述,miR-199a-5p在心脏缺血再灌注细胞模型中的表达水平增加,敲低其表达水平后可抑制细胞活力并促进细胞凋亡,其作用机制可能是通过上调HIF-1α、p-GSK3β表达水平实现的。

