微卫星不稳定、Her-2在结直肠癌中的表达及临床意义
权秋颖,郭凌川,黄 山,何晓顺,陈 志,郭 霞,曹 磊
(1.苏州大学附属第一医院病理科,江苏 苏州 215006;2.苏州大学附属第一医院临床免疫学研究所,江苏 苏州 215006)
结直肠癌(colorectal cancer, CRC)是消化系统常见的恶性肿瘤,死亡率占全世界癌症死亡率的第四位,其致病危险因素如高能量饮食,肥胖,吸烟,缺乏锻炼等增加了CRC的发病风险[1];而遗传易感因素如APC基因的缺失,RAS基因家族如KRAS和NRAS突变或P53基因的失活等在CRC的发生发展中也起着重要作用[2-3]。其中,错配修复蛋白的失活(dMMP)导致的微卫星不稳定(microsatellite instability, MSI)和人类表皮生长因子受体2(Her-2)的过表达也在肿瘤的发生中扮演特定角色。
微卫星(microsatellite),是指存在于基因组中小片段核苷酸重复序列,包括编码和非编码区,而MSI是由于错配修复蛋白或基因的失活导致无法纠正DNA复制过程中产生的错误,从而导致基因组不稳定性增加,进而发展为肿瘤。研究[2]表明,在转移性CRC患者中,15%的病例可检测到MSI,其中3%与林奇综合征(Lynch syndrome)的发生相关,12%的散发病例与MLH1高甲基化相关,50%的患者同时具有BRAFV600E活化突变。而相对于微卫星稳定(microsatellite stable, MSS)的CRC,存在MSI的CRC多具有较独特的发生部位和组织学表型及治疗方法。
Her-2作为酪氨酸激酶家族的一员,位于17号染色体,编码185 kD的跨膜蛋白,表达在正常细胞,其激活可以启动如MAPK和PI3K/AKT等一系列信号通路,从而对细胞的增殖及分化产生重要作用,研究[4]表明Her-2可在多种恶性肿瘤包括CRC中过表达。在5%的转移性CRC中可检测到Her-2扩增,其在乳腺癌及胃癌中是重要的生物标志物,但在CRC中的作用尚不完全清楚。有研究者[5-6]认为,Her-2的过表达与肿瘤的浸润深度、淋巴结转移、远处转移等相关,且在直肠的发生率最高。但Her-2与微卫星状态之间的关系在CRC中尚未阐明,因此,探讨MSI和Her-2在CRC的表达及与临床病理特征的关系具有重要意义。
本研究通过免疫组化方法探讨CRC中错配修复蛋白MLH1、PMS2、MSH2、MSH6和Her-2的表达,旨在为CRC病人的精准治疗提供一定的理论依据,对临床选择合适的病人亚群采用合适的治疗方法提供一定的参考价值。
1 材料与方法
1.1 临床资料 收集2019年1月1日—12月31日苏州大学附属第一医院手术切除的CRC标本共493 例,所有患者术前均未行放化疗或其他治疗,术后经两位高年资病理医师诊断均为腺癌。其中男性共284例,女性共209 例;年龄范围21~91 岁,中位年龄66 岁;左半结肠156 例,右半结肠184 例,直肠153例;423 例为中+高分化,70 例为低分化;病理分期标准参照美国癌症联合委员会(AJCC)第八版TNM分期标准。
1.2 免疫组化 所有标本固定后均经脱水、石蜡包埋,3~4 μm厚切片,采用全自动免疫组化染色仪,抗体MLH1(Clone ES05)、PMS2(Clone EP51)、MSH2(Clone FE11)和MSH6(Clone EP49)均购自Dako公司,即用型;Her-2(Clone 4B5),购自VENTANA公司。
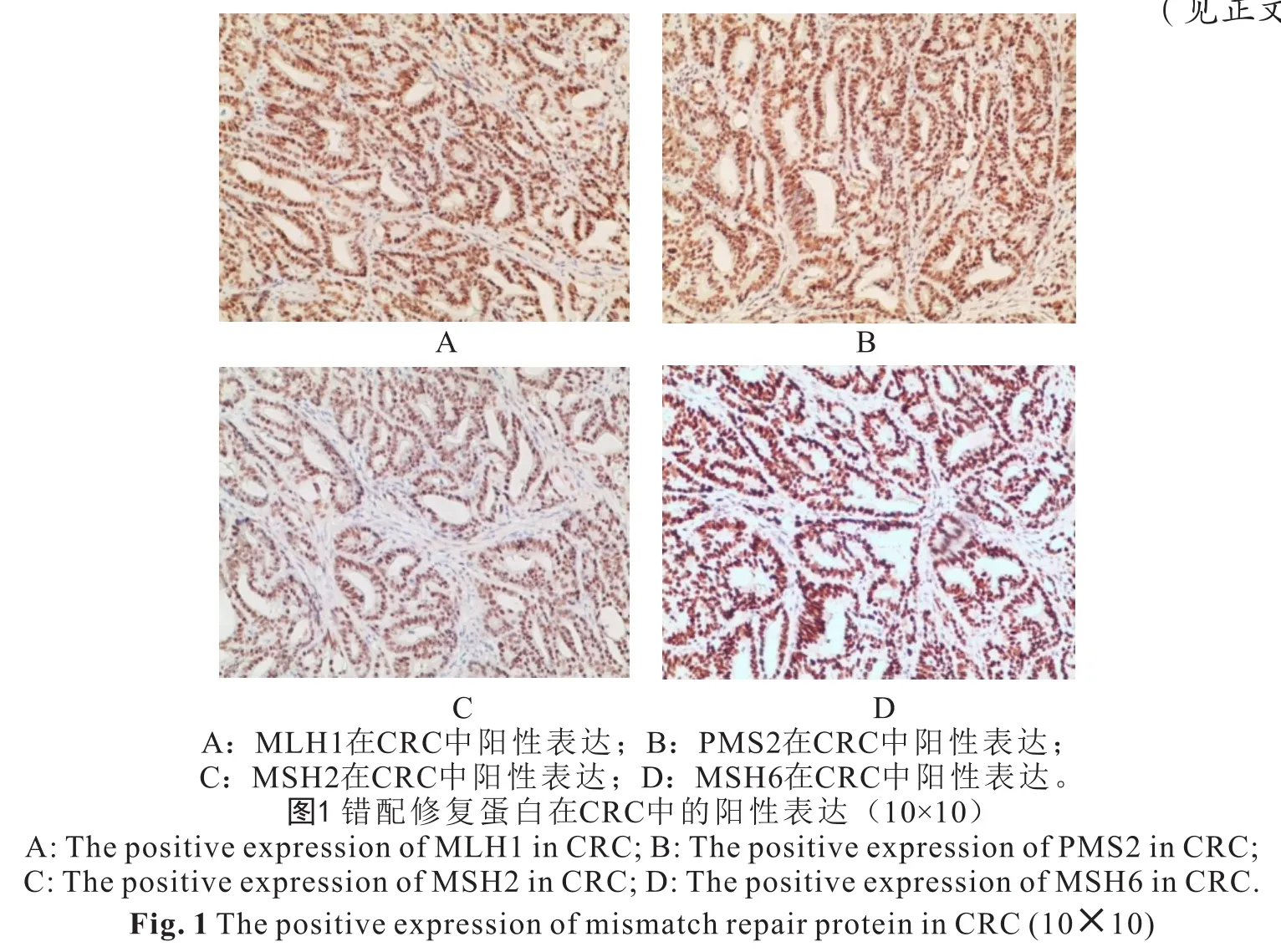
1.3 结果判读 经两位高年资病理科医师双盲读片,MLH1、PMS2、MSH2、MSH6阳性染色定位于肿瘤细胞细胞核,染色呈棕黄或棕褐色(图1,见封二),胞核不着色为表达缺失(图2,见封二);存在2个或2个以上蛋白表达缺失定义为微卫星高度不稳定(microsatellite instability-High, MSI-H),存在1个蛋白缺失或无缺失者定义为微卫星低度不稳定(microsatellite instability-Low, MSI-L)或MSS;Her-2表达在肿瘤细胞膜上,染色呈浅黄或棕黄色,其评判标准如下:无反应或<10%肿瘤细胞膜染色判为Her-2(-),≥10%肿瘤细胞微弱可见膜染色判为Her-2(1+),≥10%肿瘤细胞有弱到中等的基底侧膜、侧膜或完全性膜染色判为Her-2(2+),≥10%肿瘤细胞基底侧膜、侧膜或完全性膜强染色判为Her-2(3+)(图3)。

A:Her-2 (-);B:Her-2 (1+);C:Her-2 (2+);D:Her-2 (3+)。图3 Her-2在CRC中的免疫组化表达(10×10)A: Her-2 (-); B: Her-2 (1+); C: Her-2 (2+); D: Her-2 (3+).Fig.3 The Immunohistochemical expression of Her-2 in CRC (10×10)
1.4 统计学处理 采用统计软件SPSS 19.0进行统计学分析,两组间率的比较采用卡方检验或Fisher确切概率法,P<0.05认为两组之间差异有统计学意义。
2 结果
2.1 MSI和Her-2在CRC中的表达与临床病理特征关系 与正常肠黏膜相比,493 例CRC手术标本中,MSI-H病例数共43 例,发生率为8.7%,MSI-L与MSS两组在性别、年龄、TNM分期、分化程度、淋巴结转移、远处转移等临床病理特征之间差异无统计学意义(P>0.05),故将MSI-L与MSS归为一组进行研究,MSI-L/MSS共450 例,发生率为91.3%;与MSI-L/MSS相比,MSI-H的CRC患者肿瘤好发于右半结肠(P<0.001),浸润较深(P=0.024),低分化(P<0.001),瘤体较大(P=0.001),组织学类型多为黏液腺癌(P<0.001),与其他指标如性别、年龄、浸润深度、淋巴结转移、远处转移、TNM分期方面无统计学相关性(P>0.05)(表1);Her-2在CRC中高表达状态多见于低分化者(P<0.05),亦与肿瘤发生部位相关,直肠多见(P<0.05)(表2)。
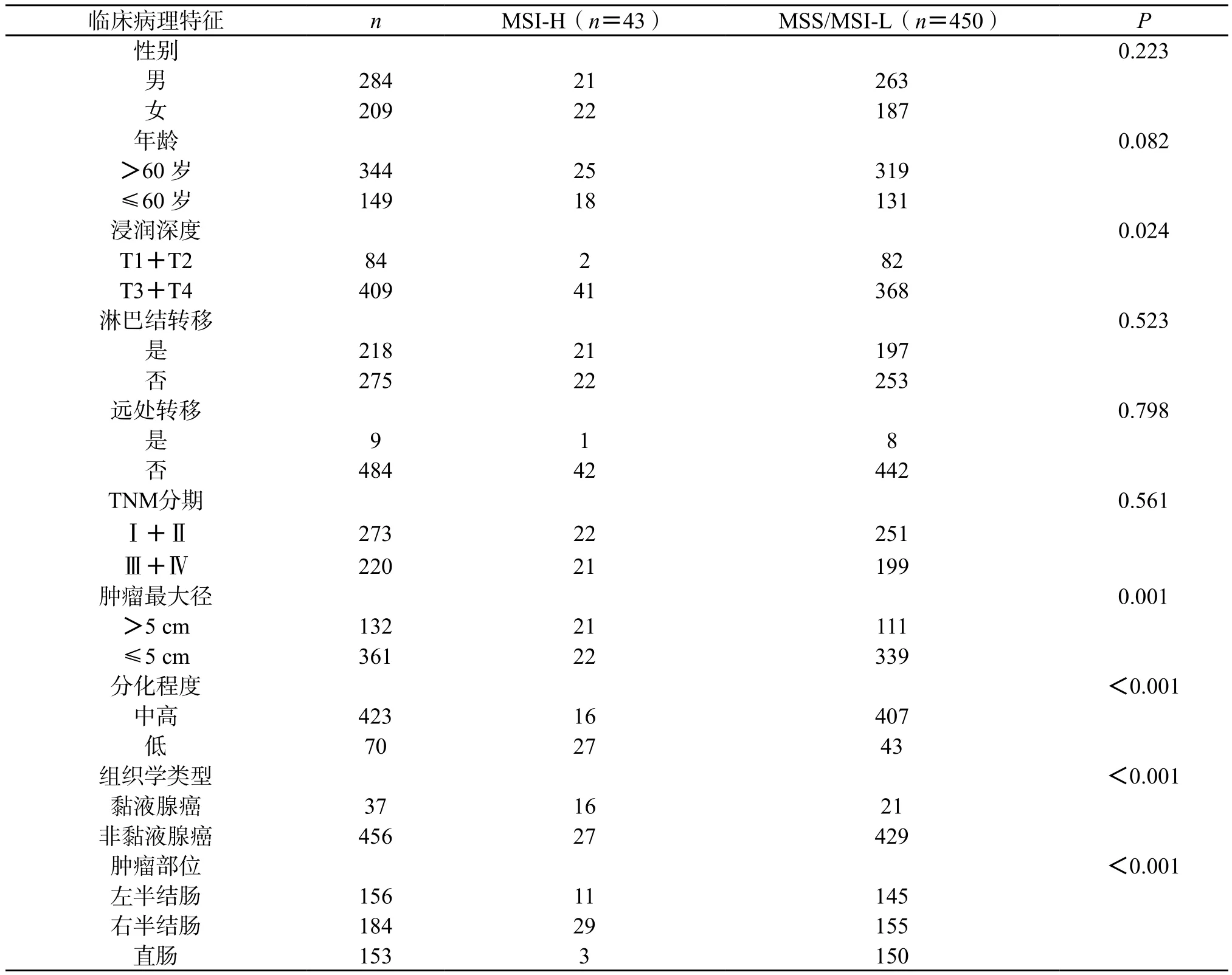
表1 MSI-H与MSS/MSI-L的表达与临床病理特征的关系(例)Tab.1 Relationship between the expression of MSI-H and MSS/MSI-L and clinicopathological features

表2 Her-2的表达与临床病理特征的关系(例)Tab.2 Relationship between the expression of Her-2 and clinicopathological features
2.2 MSI与Her-2表达的相关性 MSI与Her-2的表达呈正相关(P=0.021,r=0.140)(表3)。

表3 MSI与Her-2表达的相关性Tab.3 The correlation between MSI and Her-2 expression
3 讨论
CRC的发生发展与一系列基因突变累积相关,具有多遗传模型,每年约占新诊断癌症病例的10%,MSI被认为是导致CRC发生的主要原因之一,它代表了遗传性非息肉病性结直肠癌(HNPCC),即林奇综合征的分子表型,通常与胚系突变有关,同时也可在散发性病例中检测到,多与MLH1表观遗传失活相关[7]。检测微卫星状态至关重要,它可作为筛查林奇综合征的工具,同时也可为评估患者的预后,对化疗药物及免疫治疗的应用提供参考和帮助。目前主要有两种方法检测MSI,包括PCR和免疫组织化学,二者对dMMR和MSI的检测均敏感且特异,一致率大于95%[8]。
本研究通过免疫组织化学方法检测微卫星状态,结果表明,MSI-H患者共43 例,既往研究[7]表明,MSI-H的患者肿瘤发生具有独特的临床病理特点,如右半结肠多见,浸润较深,组织学类型多为黏液或印戒样表型,分化差,而MSI-L和MSS两组之间无明显差异,这与本研究结果一致,可能与近端和远端结肠的不同胚胎学起源有关。同时,研究发现,MSI-H/dMMR的患者,由于肿瘤突变多,具有广泛的免疫源性,肿瘤区域淋巴细胞浸润明显,免疫疗法效果显著,但对氟尿嘧啶类单药治疗不敏感。目前,PD-1免疫卡控点抑制剂如nivolumab或pembrolizumab已批准用于dMMR或MSI-H的患者[9-10],同时,联合免疫治疗(nivolumab和ipilimumab)也得到了美国食品和药物管理局(FDA)的批准[11],其效果显著,肿瘤消退明显,生存时间较MSI-L/MSS患者延长,预后较好[12]。
Her-2作为肿瘤重要的驱动因子,在乳腺癌和胃癌中已作为公认的治疗靶点,然而其在CRC的预测作用尚未明确。有报道[6]认为,发生于远端CRC尤其是直肠的患者更容易检测到Her-2或表皮生长因子受体(EGFR)扩增,这与本研究结果一致。同时,本研究还发现Her-2表达与肿瘤的分化程度相关,低分化腺癌中Her-2过表达多见,表明其在评估肿瘤的恶性程度方面存在一定价值。多组报道[13-14]认为,相对于Her-2检测阴性的患者,伴有Her-2扩增的病人对抗EGFR治疗如西妥昔单抗存在抵抗和耐药,中位生存期和总生存期明显缩短,是预测患者预后的负性因子。同时也有研究发现,在单独使用西妥昔单抗或帕尼妥单抗或联合化疗治疗KRAS野生型转移性CRC的患者时,其生存均受Her-2基因拷贝数的影响,当然,也有研究认为,其扩增与否与患者的预后之间不存在相关性。然而,在小鼠实验中发现,联合使用曲妥珠单抗(trastuzumab)和来那替尼(neratinib)或拉帕替尼(lapatinib)即双重Her-2靶向药治疗可产生持久的肿瘤消退[15]。因此,检测CRC患者中Her-2蛋白的表达对选择治疗方法及评估预后具有重要意义。
有研究[16]表明,MSI和PIK3CA突变与ERBB2/ERBB3突变相关。最近一项报道[17]也发现,36.8%的MSI-H患者携带Her-2突变,且携带Her-2突变的MSI-H患者采用免疫治疗PD-1抑制剂的中位PFS显著低于无Her-2突变的患者。本研究结果显示,MSI与Her-2的表达存在相关性,有研究者认为这可能是由于错配修复导致突变发生率较高所致,具体机制尚需更深入的研究。此外,对同时存在Her-2突变与MSI的体外结直肠癌细胞系的研究发现,其对不可逆EGFR抑制剂来那替尼效果更好[18]。综上,联合检测MSI和Her-2在CRC中的表达可更好地评估肿瘤风险和预后,为临床分子靶向治疗的选择提供参考方向。

