消融前刺激性甲状腺球蛋白对分化型甲状腺癌合并结节性甲状腺肿复发或转移的诊断价值
柴红,黄琴,陈泽泉,杨佳欢,余永利
上海交通大学附属第六人民医院核医学科,上海201306
近年来,全世界范围内甲状腺癌的检出率显著上升[1-4],大多数新发现的病例都是在无症状的初始阶段或偶然发现的;但瘤体较大的肿瘤及晚期肿瘤的发病率也有所上升[3]。分化型甲状腺癌(differentiated thyroid carcinoma,DTC)的随访目的是早期发现复发或转移性病灶,因为其对预后有很大影响。因此,在初始阶段需要一个预后参数来确定肿瘤复发的风险。在术后早期,碘消融前促甲状腺素(thyroid stimulating hormone,TSH)刺激性甲状腺球蛋白(preablative stimulated thyroglobulin,ps-Tg)水平可作为早期预后评估指标,对评估术后疾病状态有重要作用;但目前尚未建立可靠的、普遍接受的精确标准来指导术后疾病状况的正确评估[5]。
结节性甲状腺肿(nodular goitre,NG)常见于成年女性。成人这种疾病的病因与碘营养状况、自身免疫功能紊乱和局部放射治疗有关。讨论NG合并甲状腺癌的发生率、病因的文献较多[6-8];但有关这类疾病复发或转移,以及治疗和预后的研究相对较少。在DTC合并NG的患者中,对于ps-Tg预测疾病复发或转移的截断值,目前尚未见相关研究报道。因此,本研究回顾了268例DTC合并NG的病例资料,分析患者的临床病理特征、实验室指标和随访情况,评估ps-Tg在患者术后早期阶段对于复发或转移的预测意义及其截断值。
1 资料与方法
1.1 病例资料
收集2010—2018年在上海市第六人民医院核医学科接受131I治疗的2 031例DTC患者的临床资料进行回顾性分析。其中,DTC合并NG的患者287例,将病例及随访资料完整的268例纳入研究。纳入标准:①手术切除标本的组织病理学检查结果证实为DTC合并NG。②具有详细的病例资料,如肿瘤大小、淋巴结转移情况、131I治疗后的随访情况等。③甲状腺全切除或近全切除术后患者。④随访期超过6个月。⑤血清甲状腺球蛋白抗体(antithyroglobulin antibody,TgAb)、Tg水平均采用电化学发光免疫法检测;血清TgAb>40 mIU/L表示阳性。⑥刺激后的血清Tg水平通过停用左旋甲状腺素(LT4)3~4周(内源性促甲状腺素刺激)测定。排除标准:缺少实验室检测数据或消融时TSH浓度<30 U/L,无碘扫描结果。
1.2 复发或转移的诊断标准
甲状腺癌局部或远处转移的诊断基于病理诊断,临床症状,血清刺激性Tg和TgAb水平,131I治疗后全身扫描(131I-WBS)、131I-SPECT/CT、全身骨扫描(99mTc-MDP),正电子发射型计算机断层显像(18FDG-PET),颈部超声,X线片,CT或磁共振成像(MRI)检查,手术以及细针穿刺活检等临床常规检测手段。
关于DTC患者复发或转移的诊断,可依据以下3个方面:①病理诊断报告提示复发或转移。②131I-WBS证实甲状腺床外的摄碘灶,至少1项影像学检查结果(X线、CT或MRI等)提示复发或转移,以及血清Tg水平升高。③131I-WBS阴性,但怀疑复发或转移;如果其他影像学检查结果阳性并伴有血清Tg水平升高,则考虑复发或转移。
1.3 统计学方法
使用SPSS 20.0和MedCalc 19.0进行统计分析和图像制作。定性资料用频数(百分率)表示,定量资料用x±s表示。均数的比较采用单因素方差分析。率的比较采用χ2检验。采用Logistic回归分析预测术后早期阶段远处转移的危险因素。采用受试者操作特征(receiver operating characteristic,ROC)曲线判断术后早期阶段ps-Tg对甲状腺癌复发或转移的诊断价值,计算曲线下面积(area under the ROC curve,AUC)。采用MedCalc计算ps-Tg的敏感度、特异度以及ps-Tg的截断值。P<0.05表示差异有统计学意义。
2 结果
2.1 临床病理特征
共纳入268例DTC合并NG患者(男性80例,女性188例)。平均随访(12.5±3.7)个月,总复发率为30.22%(81例),其中局部转移36例、远处转移45例。直径<1 cm的微小癌占19.03%(51例)。TgAb阳性者68例(25.37%)。将 患 者 分 为NG合 并 乳 头 状 癌(papillary thyroid carcinoma,PTC)组和NG合并其他类型DTC组。NG合并PTC组230例(男性66例,女性164例),平均年龄(46.02±13.45)岁;NG合并其他类型DTC组38例(男性14例,女性24例),平均年龄(47.08±15.3)岁。NG合并其他类型DTC组中,滤泡状癌(follicular thyroid carcinoma,FTC)23例,滤泡型乳头状癌12例,混合癌(FTC和PTC)3例。2个亚组患者临床特征的比较见表1。结果显示:NG合并PTC患者的颈部淋巴结转移率明显高于NG合并其他类型DTC患者(Pearsonχ2=18.458,P=0.000);NG合并PTC患者的远处转移率明显低于NG合并其他类型DTC患者(Pearsonχ2=6.930,P=0.017);比较2组的性别比、TNM分期和风险分层,差异均无统计学意义。
2.2 Logistic回归分析预测术后早期阶段远处转移的风险因子
对所有患者的基线特征,包括性别、诊断年龄、T分期、包膜外侵犯、是否多灶、病理类型、TSH、TgAb、ps-Tg水平以及颈部淋巴结转移情况(是否N1b)进行Logistic回归分析。结果显示:ps-Tg(OR=1.002,P=0.005)、N1b(OR=0.235,P=0.001)和组织病理类型(OR=0.263,P=0.012)与肿瘤远处转移显著相关;而其他因素与肿瘤远处转移无相关性(表2)。
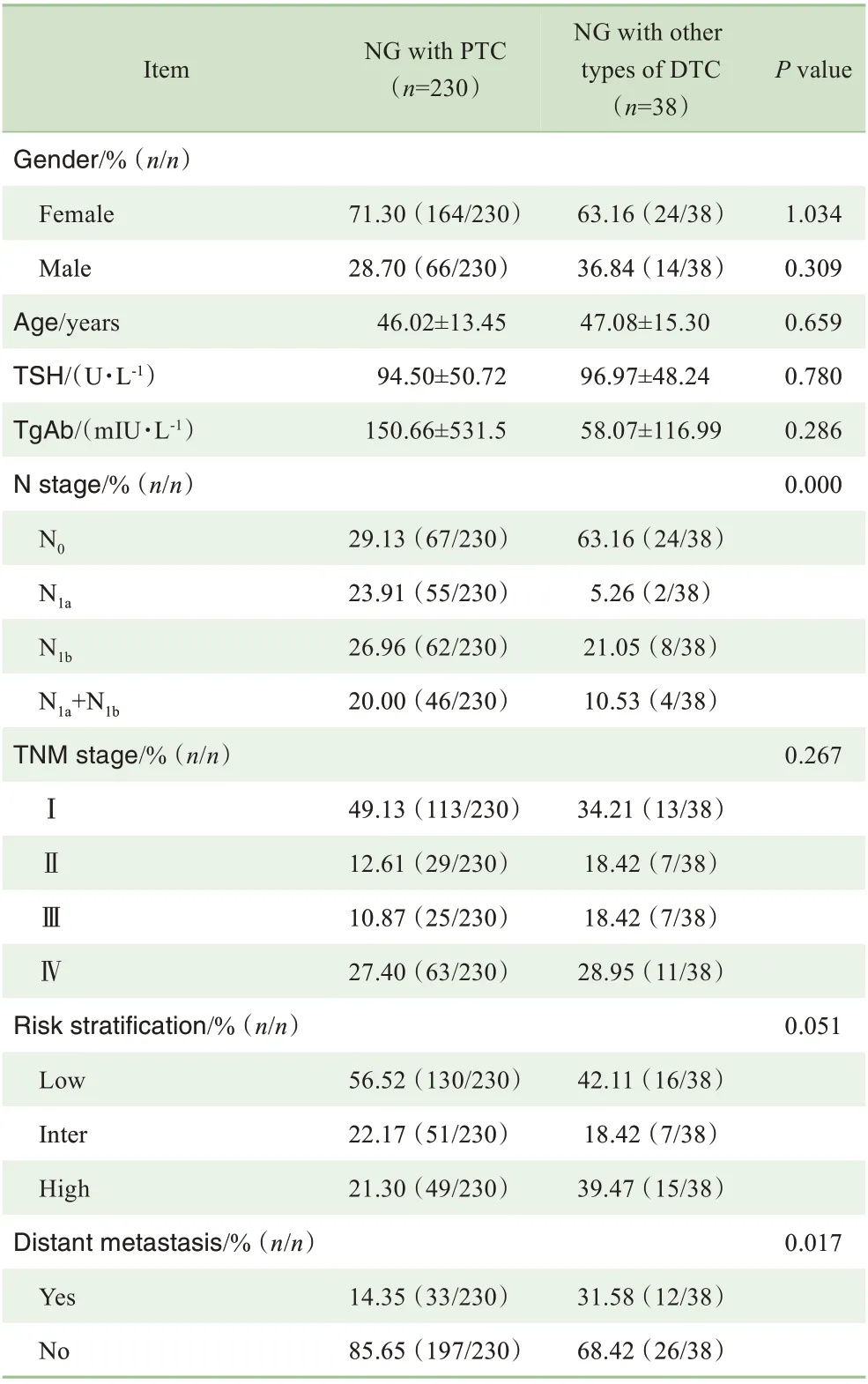
表1 NG合并不同类型DTC患者临床病理特征的比较Tab 1 Comparison of clinicopathological features of NG patients with different types of DTC
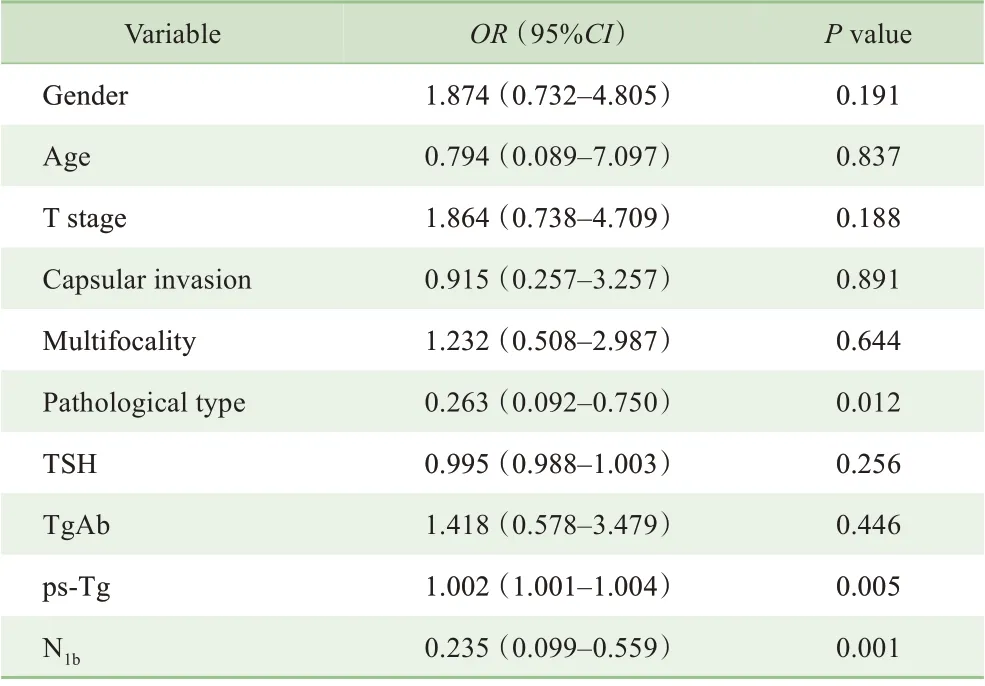
表2 Logistic回归分析预测早期转移的风险因子Tab 2 Logistic regression analysis in predicting risk factors of early metastasis
2.3 DTC合并NG患者中ps-Tg的ROC曲线分析
为了评估ps-Tg对DTC合并NG患者术后早期阶段肿瘤复发或转移的预测意义,采用ROC曲线分析来确定敏感度和特异度最优的诊断截断值。结果显示(图1):在DTC合并NG患者中,ps-Tg最优的诊断截断值为26.97 ng/mL(敏感度66.7%,特异度83.3%),曲线下面积为0.795(95%CI 0.742-0.842)。
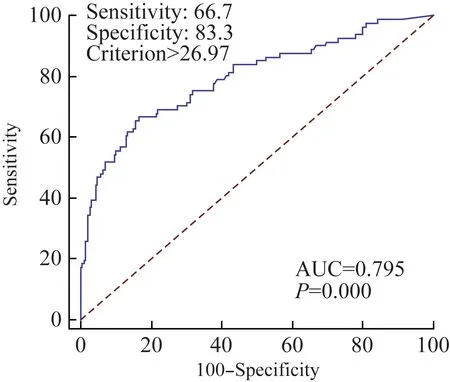
图1 Ps-Tg水平预测术后早期复发或转移的ROC曲线Fig 1 ROC curve of ps-Tg values in predicting early postoperative recurrence or metastasis
2.4 合并其他疾病的情况
在268例DTC合并NG患者中,同时合并桥本甲状腺炎者11例,其中有1例同时合并腺瘤。11例患者中,2例FTC,9例PTC。此外,268例患者中,同时合并腺瘤者27例;27例患者中,6例FTC,19例PTC,2例为滤泡型乳头状癌。
2.5 TgAb阳性与阴性患者比较
在268例DTC合并NG患者中,TgAb阳性患者的N1b淋巴结转移比例为42.7%(29/68),低于TgAb阴性患者的45.5%(91/200),但2组差异无统计学意义(P=0.683)。TgAb阳性患者Ⅲ~Ⅳ期的比例为39.7%(27/68),低于TgAb阴性患者的51.5%(103/200),差异无统计学意义(P=0.093)。TgAb阳性患者远处转移的比例为23.5%(16/68),高于TgAb阴性患者的14.5%(29/200),差异也无统计学意义(P=0.085)。
3 讨论
本研究显示,在DTC合并NG患者中,ps-Tg水平预测肿瘤复发或转移的最佳截断值为26.97 ng/mL。该结果表明,对于ps-Tg水平升高的患者,尤其是ps-Tg≥26.97 ng/mL者,在甲状腺术后的初步评估中,可能需要更严格和更频繁地评估Tg、TgAb和颈部超声。当怀疑有远处转移时,需要对这些患者进行早期远处转移的评估,如进行胸部CT检查。
Tg的半衰期为65 h,这意味着理论上,在甲状腺全切除术后约1个月,无局部残留病灶或转移患者的血清Tg水平应检测不到[9]。一些研究[5,10]表明,在术后碘消融前内源性TSH刺激Tg水平具有预后评估价值。但是,因为每项研究所选的患者人群不同,具体的ps-Tg预测预后的截断值有很大差异。此外,Tg受到许多因素的影响,如Tg分析方法、确定Tg截断值的统计学方法(ROC曲线或者经验性截断值)、患者复发性疾病的检查方法或定义,以及手术方式。因此,目前关于ps-Tg预测预后的具体截断值,尚未确定[5]。有研究报道,高ps-Tg值与不良临床结果相关,低ps-Tg值与病情缓解相关。如Kim等[11]报道,ps-Tg>5.22 ng/mL与肿瘤的持续/复发相关。Baudin等[12]报道,血清ps-Tg>10 ng/mL的患者强烈提示持续/复发性疾病的可能性,但该研究所选的人群仅在甲状腺床显示摄碘,排除甲状腺外摄碘的患者。Hall等[13]研究了213例TNMⅠ~Ⅳ期的DTC患者,平均随访47个月,发现术后Tg>20 ng/mL是疾病复发的独立预测因子。Piccardo等[14]报道,在243例高危DTC患者中,ps-Tg≥50 ng/mL是疾病持续/复发的一个有价值的初始预测因子。Ronga等[15]对334例DTC患者(249例PTC,85例FTC)随访18个月,发现79例复发;ROC曲线分析显示,当ps-Tg≥69.7 ng/mL时,有90%的病例存在转移。据Ciappuccini等[16]报道,对308例DTC患者ps-Tg水平进行测定,其中185例采用停用LT4方法,结果显示预测持续/复发性疾病的最佳Tg临界值是28 ng/mL。本研究结果与Ciappuccini等[16]的研究结果一致,但Ciappuccini等的研究排除了TgAb阳性患者,而本研究中包含了TgAb阳性患者;因此,本研究结果可能会受到TgAb的影响,低于真正的截断值。
另一方面,低水平ps-Tg可作为持续性疾病的负预测因子,是DTC患者疾病缓解或无病状态的敏感指标。据报道[17],通过ROC曲线分析得出基线ps-Tg<8.55 ng/mL可以早期评估患者初次治疗后18~24个月的无病状态,避免过度治疗。在一项3 947例患者的meta分析中,Webb等[18]发现ps-Tg预测无病状态的最佳截断值也是10 ng/mL,即ps-Tg<10 ng/mL被认为是DTC患者的有利因素。据报道[19],ps-Tg是一个可靠的高阴性预测值标志物,其检测持续性疾病的最佳临界值为3.65 ng/mL。Heemstra等[20]报道,当ps-Tg<27.5 ng/mL时,治愈率约为98%。其他相关研究[21-22]也证实了低水平ps-Tg可预测甲状腺癌患者疾病缓解或无病状态。
我们采用Logistic回归分析评估了患者的临床病理特征和实验室指标在术后碘消融时对DTC肿瘤远处转移的预测价值。结果显示,N1b淋巴结转移、ps-Tg水平和组织病理类型与肿瘤远处转移显著相关。N1b淋巴结转移的存在是远处转移的一个预测因素,证实在术后初始阶段对淋巴结转移和ps-Tg进行准确评估对预后极为重要。N1b疾病的存在会对患者的结局产生不利影响,因为即使在充分的颈部淋巴结清扫术后也不能排除颈部微小转移灶的存在[23]。而且,Melo等[24]报道,在单变量分析中,N1b与术后1年持续或复发性疾病显著相关。
虽然甲状腺结节和甲状腺肿均与甲状腺癌风险增加密切相关,但也有研究[25]认为甲状腺肿是甲状腺癌的保护因素。目前,关于DTC合并NG患者的临床病理特征和预后方面的研究报道较少,NG对甲状腺癌的作用和影响尚不清楚。据报道[26],甲状腺髓样癌合并NG患者的生存率接近100%,预后明显好于单纯甲状腺髓样癌患者。这可能表明,无NG的甲状腺髓样癌是一种更具侵略性的疾病,反映出合并NG的甲状腺髓样癌患者疾病进展相对缓慢。Filipović等[27]报道了50例DTC合并良性甲状腺疾病(毒性弥漫性甲状腺肿、桥本甲状腺炎和NG)患者的临床研究,发现合并桥本甲状腺炎和NG患者的预后较好,而合并毒性弥漫性甲状腺肿患者的预后较差。然而,本研究最初6个月的随访评估发现81例(30.22%)复发或转移,虽然随访时间相对较短,但复发或转移率并不低。
此外,一些研究甚至认为甲状腺肿患者中抗体水平的增高对肿瘤的生长产生了影响。目前,功能性甲状腺疾病(如甲状腺功能亢进和甲状腺功能减退)和甲状腺自身免疫在甲状腺癌发展中的作用尚不清楚[28]。据报道[29],与同时存在抗体的PTC相比,无甲状腺过氧化物酶抗体(TPOAb)的患者有6%(4/67)为TNMⅣ期,抗体的存在可能反映了更好的预后。Heemstra等[20]的研究结果显示,TgAb的存在对无病缓解或死亡没有显著的影响。不同甲状腺癌患者血清TgAb的阳性率在10.8%~30%之间[7,13,15,20]。本研究中的268例DTC合并NG的患者中,尽管没有对患者的TPOAb进行检测,但68例(25.37%)患者TgAb阳性。与TgAb阴性患者相比,TgAb阳性患者伴有远处转移的比例较高,但差异无统计学意义,可能是因为本研究中病例数较少。此外,2组患者N1b淋巴结转移的比例以及T分期也未见显著差异。
本研究有一定局限性,没有评估ps-Tg预测疾病缓解的截断值,且随访时间相对较短。由于甲状腺癌的惰性生长方式,缺乏对患者的长期随访研究,以及碘消融后Tg预测复发或转移的截断值。这也是我们下一步的研究方向。
综上所述,尽管术后存在残余甲状腺,消融后Tg的特异性高于单纯手术后,但术后消融前ps-Tg测量为转移或复发性疾病提供了一个早期有价值的诊断指标。在本研究的268例DTC合并NG患者中,对于ps-Tg>26.97 ng/mL的复发风险高的患者,能在术后初期即碘消融时被识别。
参·考·文·献
[1]Wiltshire JJ,Drake TM,Uttley L,et al.Systematic review of trends in the incidence rates of thyroid cancer[J].Thyroid,2016,26(11):1541-1552.
[2]Miller KD,Goding Sauer A,Ortiz AP,et al.Cancer statistics for hispanics/latinos,2018[J].CA Cancer J Clin,2018,68(6):425-445.
[3]Lim H,Devesa SS,Sosa JA,et al.Trends in thyroid cancer incidence and mortality in the United States,1974-2013[J].JAMA,2017,317(13):1338-1348.
[4]Raposo L,Morais S,Oliveira MJ,et al.Trends in thyroid cancer incidence and mortality in Portugal[J].Eur J Cancer Prev,2017,26(2):135-143.
[5]Haugen BR,Alexander EK,Bible KC,et al.2015 American thyroid association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer:the American thyroid association guidelines task force on thyroid nodules and differentiated thyroid cancer[J].Thyroid,2016,26(1):1-133.
[6]Iqbal M,Mehmood Z,Rasul S,et al.Carcinoma thyroid in multi and uninodular goiter[J].J Coll Physicians Surg Pak,2010,20(5):310-312.
[7]Edino ST,Mohammed AZ,Ochicha O,et al.Thyroid cancers in nodular goiters in Kano,Nigeria[J].Niger J Clin Pract,2010,13(3):298-300.
[8]Karalus M,Tamatea JA,Conaglen HM,et al.Rates of unsuspected thyroid cancer in multinodular thyroid disease[J].N Z Med J,2018,131(1468):69-74.
[9]Indrasena BSH.Use of thyroglobulin as a tumour marker[J].World J Biol Chem,2017,8(1):81-85.
[10]Mutsuddy P,Jeon S,Yoo SW,et al.Optimization of serum thyroglobulin measured at different time points for prognostic evaluation in differentiated thyroid carcinoma patients[J].Medicine,2020,99(14):e19652.
[11]Kim MH,Ko SH,Bae JS,et al.Combination of initial stimulation thyroglobulins and staging system by revised ATA guidelines can elaborately discriminate prognosis of patients with differentiated thyroid carcinoma after high-dose remnant ablation[J].Clin Nucl Med,2012,37(11):1069-1074.
[12]Baudin E,Do Cao C,Cailleux AF,et al.Positive predictive value of serum thyroglobulin levels,measured during the first year of follow-up after thyroid hormone withdrawal,in thyroid cancer patients[J].J Clin Endocrinol Metab,2003,88(3):1107-1111.
[13]Hall FT,Beasley NJ,Eski SJ,et al.Predictive value of serum thyroglobulin after surgery for thyroid carcinoma[J].Laryngoscope,2003,113(1):77-81.
[14]Piccardo A,Arecco F,Puntoni M,et al.Focus on high-risk DTC patients:high postoperative serum thyroglobulin level is a strong predictor of disease persistence and is associated to progression-free survival and overall survival[J].Clin Nucl Med,2013,38(1):18-24.
[15]Ronga G,Filesi M,Ventroni G,et al.Value of the first serum thyroglobulin level after total thyroidectomy for the diagnosis of metastases from differentiated thyroid carcinoma[J].Eur J Nucl Med,1999,26(11):1448-1452.
[16]Ciappuccini R,Hardouin J,Heutte N,et al.Stimulated thyroglobulin level at ablation in differentiated thyroid cancer:the impact of treatment preparation modalities and tumor burden[J].Eur J Endocrinol,2014,171(2):247-252.
[17]González C,Aulinas A,Colom C,et al.Thyroglobulin as early prognostic marker to predict remission at 18-24 months in differentiated thyroid carcinoma[J].Clin Endocrinol(Oxf),2014,80(2):301-306.
[18]Webb RC,Howard RS,Stojadinovic A,et al.The utility of serum thyroglobulin measurement at the time of remnant ablation for predicting disease-free status in patients with differentiated thyroid cancer:a metaanalysis involving 3 947 patients[J].J Clin Endocrinol Metab,2012,97(8):2754-2763.
[19]Prior-Sánchez I,Barrera Martín A,Moreno Ortega E,et al.Is a second recombinant human thyrotropin stimulation test useful?The value of postsurgical undetectable stimulated thyroglobulin level at the time of remnant ablation on clinical outcome[J].Clin Endocrinol(Oxf),2017,86(1):97-107.
[20]Heemstra KA,Liu YY,Stokkel M,et al.Serum thyroglobulin concentrations predict disease-free remission and death in differentiated thyroid carcinoma[J].Clin Endocrinol(Oxf),2007,66(1):58-64.
[21]刘新峰,李娇,赵腾,等.刺激性甲状腺球蛋白<10 ng/ml的分化型甲状腺癌131I治疗后的临床转归[J].中国医学科学院学报,2016,38(1):88-92.
[22]Orlov S,Salari F,Kashat L,et al.Post-operative stimulated thyroglobulin and neck ultrasound as personalized criteria for risk stratification and radioactive iodine selection in low-and intermediate-risk papillary thyroid cancer[J].Endocrine,2015,50(1):130-137.
[23]Verkooijen RBT,Verburg FA,van Isselt JW,et al.The success rate of I-131 ablation in differentiated thyroid cancer:comparison of uptake-related and fixed-dose strategies[J].Eur J Endocrinol,2008,159(3):301-307.
[24]Melo M,Costa G,Ribeiro C,et al.Stimulated thyroglobulin at recombinant human TSH-aided ablation predicts disease-free status one year later[J].J Clin Endocrinol Metab,2013,98(11):4364-4372.
[25]Corrales EP,Príncipe RM,Muro SL,et al.Incidental differentiated thyroid carcinoma is less prevalent in Graves'disease than in multinodular goiter[J].Endocrinol Nutr,2012,59(3):169-173.
[26]Xu L,Wang WB,Zhao YP,et al.Medullary thyroid carcinoma with nodular goiter carries an excellent prognosis[J].J Surg Oncol,2012,106(2):169-173.
[27]FilipovićA,PaunovićI.Characteristics of thyroid carcinoma in Grave's disease Hashimoto's thyroiditis and nodular goiter[J].Acta Chir Iugosl,2003,50(3):135-139.
[28]Kitahara CM,Farkas DKR,Jørgensen JOL,et al.Benign thyroid diseases and risk of thyroid cancer:a nationwide cohort study[J].J Clin Endocrinol Metab,2018,103(6):2216-2224.
[29]Veit F,Graf D,Momberger S,et al.Papillary thyroid cancer and coexisting autoimmune thyroiditis[J].Horm Metab Res,2017,49(11):869-872.

