生物信息学方法筛选胰腺癌进展相关的核心基因
杨鹿笛,王高明,胡仁豪,蒋小华,崔然
1.上海交通大学医学院附属瑞金临床医学院,上海200025;2.同济大学附属东方医院普外科,上海200120
胰腺癌是一种顽固性恶性肿瘤,恶性程度较高。根据2018年全球肿瘤流行病统计数据[1],胰腺癌位列常见癌症排名第11位,2018年有458 918个新病例,432 242人因胰腺癌死亡(占所有癌症死亡人数的4.5%),5年生存率低于5%。在美国,癌症患者中胰腺癌已成为第三大死亡原因[2]。近年来发展中国家人们生活方式的改变,比如吸烟比例提高、高热量食物摄入增多、体育锻炼缺乏等,导致胰腺癌死亡率逐渐上升[3]。
胰腺癌起病隐匿,早期诊断困难,进展迅速,大多数患者在确诊时已丧失治疗的最佳时机;同时,胰腺癌手术切除率较低,并且对常规放射治疗和化学治疗不敏感,故预后极差[1]。胰腺癌具有快速增殖能力和高度侵袭转移倾向,发病机制复杂,目前尚缺乏有效的系统治疗手段。高通量测序技术和系统生物学的不断发展,有助于更好地了解胰腺癌潜在的分子机制,寻找新的分子靶标和靶向疗法,从而延长患者的生存时间。
随着生命科学和计算机科学的迅猛发展,以计算机为工具对生物信息进行储存、检索和分析的生物信息科学,成为分析基因组学和蛋白质组学的一种重要方法。本研究旨在通过生物信息学的分析方法,筛选与胰腺癌发生和发展相关的核心基因与通路,探究核心基因对胰腺癌患者预后的影响,以期为胰腺癌患者的精准治疗提供新的干预靶点。
1 材料与方法
1.1 基因芯片数据来源
利用美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)平 台 下 的GEO(Gene Expression Omnibus)数据库检索含有人源胰腺癌及癌旁组织样本的芯片数据集GSE28735。该数据集共包含90例组织样本数据,其中45例为癌组织,45例为癌旁正常组织。
1.2 差异表达基因的筛选
通过GEO2R在线分析工具提取癌组织及癌旁组织的基因。为了提高筛选效率,首先利用RStudio软件,以P值大小为参考标准,筛选出差异表达最显著的250个基因;然后通过RStudio软件的limma数据包进一步筛选胰腺癌组织样本和癌旁正常组织样本的差异表达基因(differentially expressed genes,DEGs),筛选标准为P<0.05且|log2FC|>1[FC为差异倍数(fold change)]。利用pheatmap、ggplot2数据包对其进行可视化处理。
1.3 DEGs的富集分析
在基因功能注释在线工具DAVID(Database for Annotation,Visualization and Integrated Discovery)中,根据基因本体(Gene Ontology,GO)数据库和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路数据库对差异表达显著的基因进行生物学富集分析。在RStudio软件中,以P<0.05为入选标准对富集结果进行筛选,利用ggplot2数据包对富集分析的结果进行可视化处理。
1.4 蛋白质-蛋白质相互作用网络的构建
通过交互基因检索工具STRING(Search Tool for the Retrieval of Interacting Genes)对差异表达显著的基因在线绘制蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络,以结合分数>0.4为阈值条件。在Cytoscape软件中对PPI网络进行可视化处理,使用CytoHubba网络分析插件筛选PPI网络的核心基因。
1.5 核心基因表达水平的生存分析和病理阶段分析
基因表达谱分析数据库GEPIA(Gene Expression Profiling Interactive Analysis)纳入了179例胰腺癌患者的临床和病理信息以及基因表达数据,验证5个核心基因在179例胰腺癌组织和171例正常组织中的表达差异;利用基因表达水平中位数将患者分为基因高表达组(89例)和基因低表达组(89例),并绘制Kaplan-Meier生存曲线,采用Log-rank检验进行生存分析,探究核心基因表达水平的高低与患者总生存期(overall survival,OS)和无病生存期(disease free survival,DFS)的关联;通过GEPIA在线分析和单因素方差分析对不同病理阶段的基因表达水平进行可视化处理及统计分析。P<0.05表示差异有统计学意义。
2 结果
2.1 DEGs的筛选
为了提高筛选效率,我们将GEO2R在线分析结果根据P值大小升序排列,选取其中的前250个基因。在R语言limma包中设置差异基因筛选条件为P<0.05且|log2FC|>1,共得到131个DEGs,其中与癌旁正常组织相比表达上调的基因115个,表达下调的基因16个。利用R的ggplot2和pheatmap数据包分别对前250个基因和筛选出来的131个DEGs进行可视化处理,见图1。
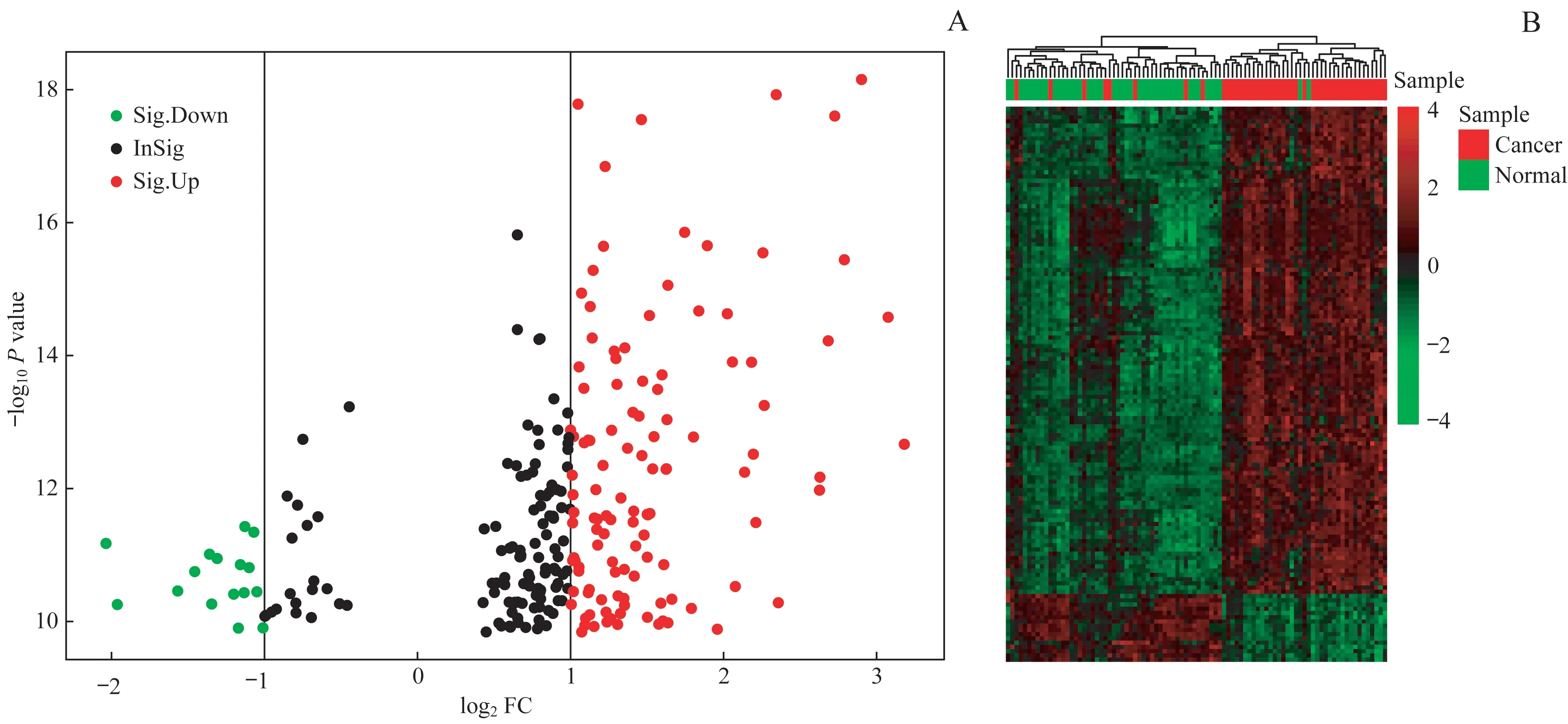
图1胰腺癌组织及癌旁组织中DEGs的可视化分析Fig 1 Visual analysis of the DEGs in pancreatic cancer and adjacent tissues
2.2 DEGs的富集分析结果
对筛选得到的DEGs进行GO功能富集分析和KEGG通路富集分析。结果表明DEGs主要在细胞黏附、质膜、蛋白质结合中富集;主要富集的通路为磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋 白 激 酶B(protein kinase B,AKT)信号通路。对DEGs的富集结果进行可视化处理,见图2。
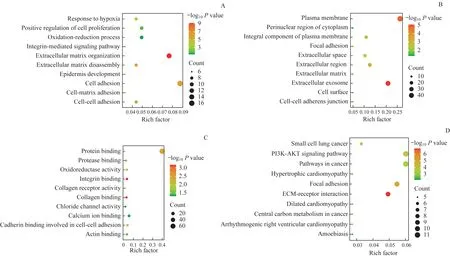
图2 DEGs的GO功能富集和KEGG通路富集分析Fig 2 Enrichment analysis of GO function and KEGG pathway of DEGs
2.3 PPI的构建与核心基因的筛选
利用STRING在线分析DEGs对应蛋白的PPI网络,通过Cytoscape软件进行整合后构建PPI的可视化结果,获得DEGs对应蛋白的PPI网络(图3)。通过使用CytoHubba网络分析插件筛选PPI中相互作用程度最高的前5个DEGs的对应蛋白,分别为纤维连接蛋白(fibronectin1,FN1)、间质表皮转化因子(mesenchymal to epithelial transition factor,MET)、层 粘 连 蛋 白β3(polyclonal antibody to lamininβ3,LAMB3)、层粘连蛋白α3(laminin subunitα3,LAMA3)、整合素亚单位α3(integrin subunitα3,ITGA3)。其生物学功能及节点度值(degree)具体见表1。

图3 DEGs对应蛋白的PPI网络图Fig 3 PPI network diagram of DEGs corresponding proteins
2.4 DEGs表达水平与患者生存及肿瘤分期的关系
利用GEPIA在线工具分析5个DEGs在胰腺癌患者癌组织和癌旁正常组织样本中的表达情况,结果显示其在癌组织中的表达水平均高于正常组织,差异均存在统计学意义(P<0.01),见图4。
5个DEGs中,MET(P=0.000,HR=2.2)、LAMA3(P=0.000,HR=2.1)、LAMB3(P=0.002,HR=1.9)和ITGA3(P=0.007,HR=1.8)的表达水平与胰腺癌患者OS有关,且基因低表达组(n=89)的预后明显优于基因高表达组(n=89);而FN1(P=0.160,HR=1.3)的表达水平与胰腺癌患者的OS无关联(图5A-E)。DEGs表达水平与胰腺癌患者DFS的关联分析显示,MET(P=0.000,HR=2.2)、LAMB3(P=0.023,HR=1.7)和ITGA3(P=0.000,HR=2.4)的表达水平与胰腺癌患者DFS有关(图5G、I、J),而FN1(P=0.140,HR=1.4)和LAMA3(P=0.067,HR=1.5)的表达水平对胰腺癌患者的DFS并无显著影响(图5F、H)。

表1 PPI网络中5个DEGs的生物学特点Tab 1 Biological characteristics of the five DEGs in PPI network
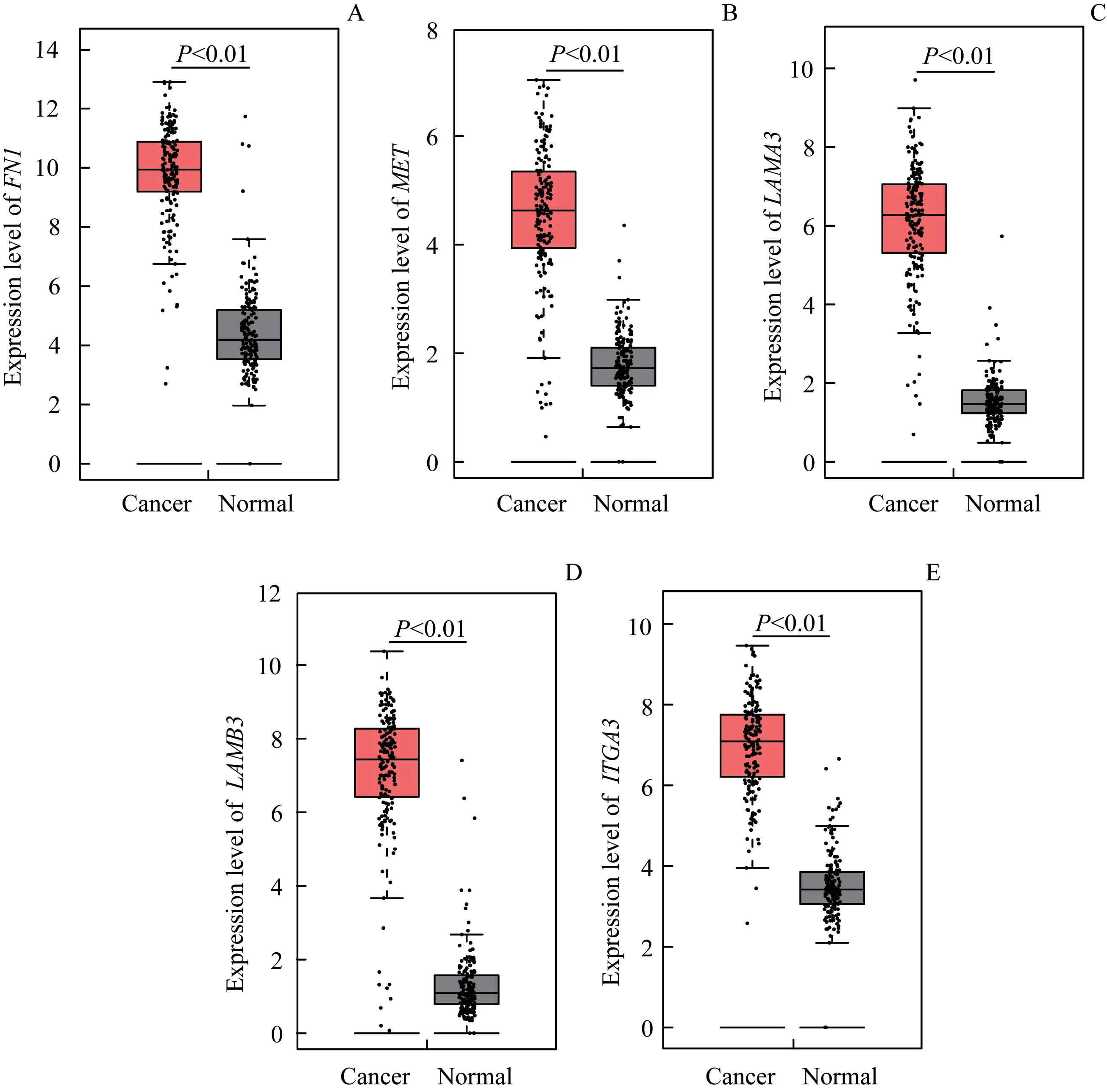
图4 5个DEGs在179例胰腺癌组织和171例正常组织中的表达Fig 4 Expression of the five DEGs in 179 cases of pancreatic cancer tissues and 171 cases of adjacent normal tissues
进一步探究DEGs表达水平与胰腺癌分期进展的关系,结果显示在Ⅰ、Ⅱ、Ⅲ、Ⅳ期胰腺癌组织中,FN1(P=0.048)、MET(P=0.010)、LAMA3(P=0.004)和LAMB3(P=0.000)的表达水平差异均存在统计学意义,而ITGA3(P=0.127)在不同分期胰腺癌组织中的表达水平差异无统计学意义(图6)。
3 讨论
胰腺癌是一种遗传性或获得性致癌基因突变导致的疾病。由于其具有起病隐匿、早期诊断困难、远处转移、化学治疗抵抗等特点,患者在发现时往往已进展至晚期或已失去手术治疗的机会,因此预后较差[4]。目前,关于胰腺癌的发病机制尚未阐明。因此,深入了解胰腺发生发展过程中失调的分子是改善胰腺癌患者预后的重要途径之一。本研究基于GEO数据库,以生物信息学的方法对癌组织和癌旁正常组织的DEGs进行分析、筛选、整合,对胰腺癌进展的潜在机制进行挖掘。
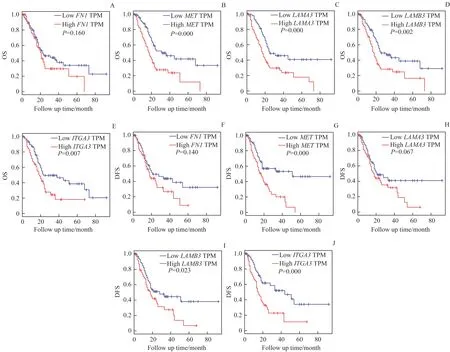
图5 Kaplan-Meier曲线分析评估5个DEGs对胰腺癌患者预后的意义Fig 5 Prognostic significance of the five DEGs for pancreatic cancer patients assessed via Kaplan-Meier analysis
在GSE28735基因芯片数据集中,共筛选出115个在胰腺癌中表达上调的基因和16个表达下调的基因。GO功能富集分析结果提示DEGs主要在细胞黏附、质膜、蛋白质结合中富集。KEGG通路富集主要表现在PI3K/AKT信号通路。综合富集结果,可以推测细胞黏附功能相关基因的高表达与胰腺癌的发生发展有关。细胞黏附分子参与细胞的识别、活化、信号转导、增殖与分化、伸展与移动过程,是免疫应答、炎症发生、凝血、肿瘤转移以及创伤愈合等一系列重要生理和病理过程的分子基础[5]。在肿瘤细胞中经常观察到细胞黏附状态改变直接促进了癌症的发展[6]。Bergmann等[7]在一项包含胰腺癌前病变、原发胰腺导管腺癌以及胰腺癌肝转移组织的大样本队列试验中发现,原发胰腺导管腺癌中L1细胞黏附分子的免疫组织化学阳性率达92.7%,淋巴结转移率达80.0%,肝转移率达100%,提示L1细胞黏附分子的表达与胰腺癌的恶性生物学行为密切相关。另有研究[8]表明,L1细胞黏附分子可以通过转化生长因子β1(transforming growth factorβ1,TGF-β1)等途径在胰腺癌的侵袭转移中起作用。由此可见,细胞黏附分子在胰腺癌组织与正常组织中的表达水平存在差异,且细胞黏附分子与胰腺癌的发生发展及转移有关。
PI3K/AKT信号通路主要调控细胞的增殖、分化、凋亡以及迁移等[9]。该通路活性异常不仅能导致细胞恶性转化,而且与肿瘤细胞的迁移、黏附、肿瘤血管生成以及细胞外基质的降解等相关[10]。已有研究[11]表明,PI3K/AKT信号通路在胰腺癌发生发展中占有重要地位。通过研究阻断PI3K/AKT通路产生的信号转导作用的分子机制可以为新型抗肿瘤药物开发提供新靶点和新思路,进而增强化学治疗药物对胰腺癌的敏感性,使特异性抗癌新药的研发成为可能[12]。本研究KEGG富集结果发现PI3K/AKT信号通路参与胰腺癌的发生发展过程,该结果为寻找胰腺癌新的治疗靶点提供了方向。
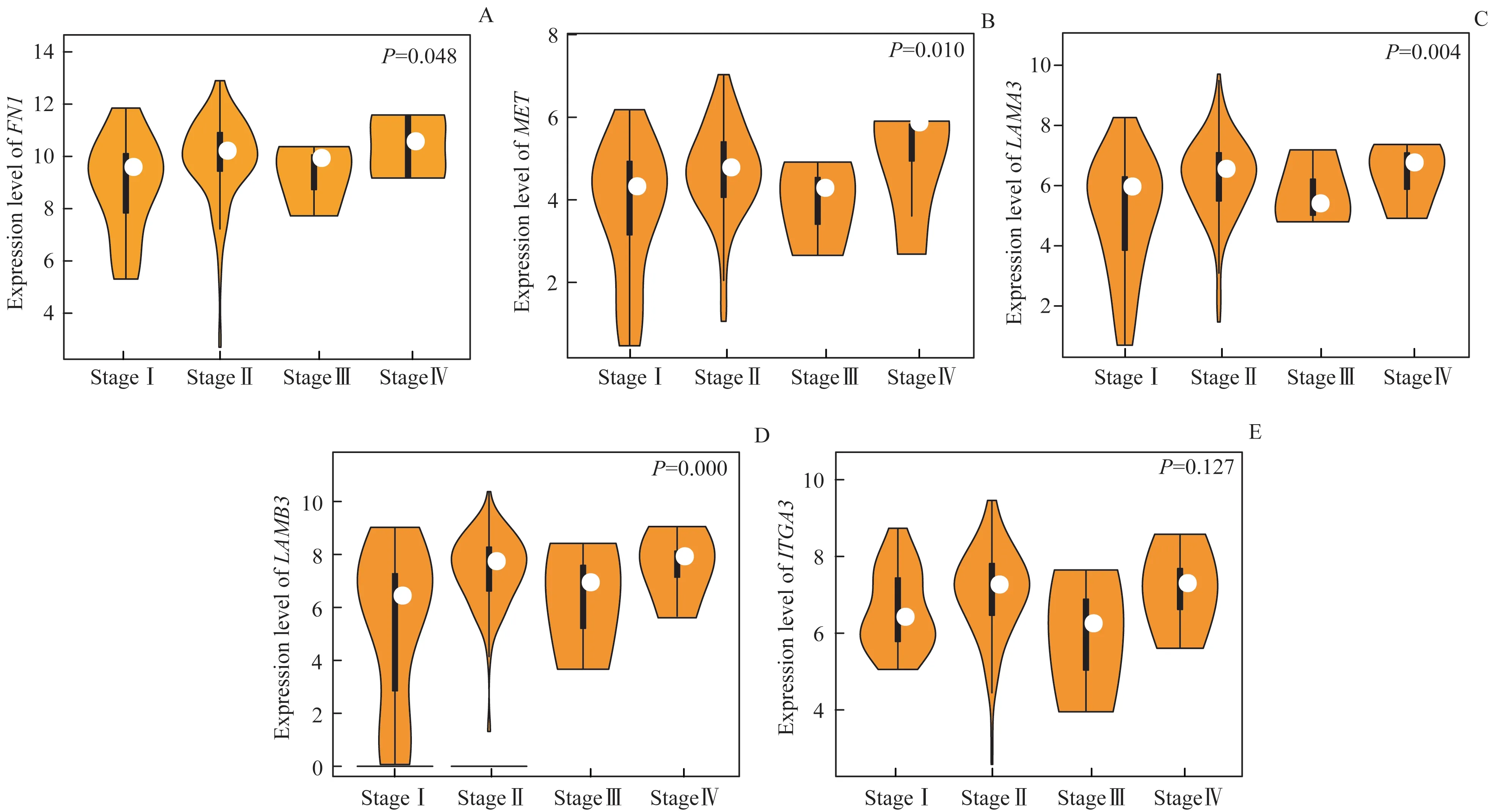
图6 5个DEGs在不同病理分期胰腺癌中的表达Fig 6 Expression of the five DEGs in pancreatic carcinoma with different pathological stages
通过构建PPI网络,探究DEGs表达的蛋白之间的相互作用。运用CytoHubba插件筛选出节点度值最高的5个DEGs。MET、LAMA3、LAMB3对患者的OS或DFS有显著影响并且在不同病理阶段的表达水平差异有统计学意义,推测MET、LAMA3、LAMB3可能成为胰腺癌预后评价、诊断、靶向治疗的潜在靶标。
MET是一种原癌基因,编码肝细胞生长因子的异二聚体跨膜受体酪氨酸激酶,可作为肝细胞生长因子(hepatocyte growth factor,HGF)的受体。HGF与MET蛋白结合可触发PI3K/AKT信号通路、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路、Wnt/β-catenin信号通路和信号转导及转录激活蛋白(signal transducer and activator of transcription,STAT)信号通路[13]。这些通路的激活可以驱动与癌症有关的各种生物学过程,例如细胞增殖、迁移、侵袭、凋亡抑制、上皮向间充质转化以及血管生成等[13-14]。据报道,在人类几种恶性肿瘤中均发现了MET蛋白的失调和扩增,其中包括胃癌[15]、结直肠癌[16]、乳腺癌[17]和非小细胞肺癌[18]。已有研究[19]证实受体酪氨酸激酶c-Met与胰腺癌的发病机制之间存在关联。Neuzillet等[20]研究表明,胰腺癌组织中c-Met表达的增加伴随着复发率的提高和生存时间的缩短。有文献[21]表明,MET可通过激活PI3K/AKT信号通路来介导癌症的发展。这与我们分析得到的结果一致。
LAMA3和LAMB3属于层粘连蛋白家族,是常见的基底膜蛋白家族之一[22]。其广泛参与许多生物过程,例如附着、迁移以及与其他细胞外基质成分的相互作用,并且在调节细胞迁移和机械信号转导中起着重要作用[22-24]。研究[25]发现,LAMA3的表达水平与胃癌的发生有关,其高表达可以抑制胃癌的发生。Svoboda等[26]发现LAMA3基因在肝癌组织中表达水平较癌旁正常组织上调。同样,LAMB3的高表达在甲状腺乳头状癌、肝细胞癌的发生和发展中起着重要作用[27-29]。也有研究[30]表明LAMB3在胰腺癌中异常过表达,并且与胰腺癌患者的OS密切相关。Zhang等[31]还发现,LAMB3可能通过PI3K/AKT信号转导途径介导胰腺导管腺癌的侵袭和迁移。本研究发现胰腺癌组织中LAMA3、LAMB3的表达水平与正常胰腺组织相比明显升高,且LAMA3、LAMB3高表达组患者预后较差,其在胰腺癌不同病理阶段的表达水平的差异也存在统计学意义,提示这2个基因可能在胰腺癌进展中发挥重要的作用。
综上所述,本研究利用数据库分析获得5个在胰腺癌组织异常表达的DEGs,其可能通过PI3K/AKT信号通路介导胰腺癌的进展。其中MET、LAMA3和LAMB3的表达升高与患者的不良预后有关。然而,目前对MET、LAMA3、LAMB3的上下游调控关系及蛋白之间的相互作用关系尚不明晰,其作为胰腺癌预后评判和分子治疗靶标的价值仍有待于进一步研究。
参·考·文·献
[1]Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68(6):394-424.
[2]Ferlay J,Partensky C,Bray F.More deaths from pancreatic cancer than breast cancer in the EU by 2017[J].Acta Oncol,2016,55(9/10):1158-1160.
[3]Lin QJ,Yang F,Jin C,et al.Current status and progress of pancreatic cancer in China[J].World J Gastroenterol,2015,21(26):7988-8003.
[4]Mayo SC,Nathan H,Cameron JL,et al.Conditional survival in patients with pancreatic ductal adenocarcinoma resected with curative intent[J].Cancer,2012,118(10):2674-2681.
[5]de SáMC,Simão ANC,de Medeiros FA,et al.Cell adhesion molecules and plasminogen activator inhibitor type-1(PAI-1)in patients with rheumatoid arthritis:influence of metabolic syndrome[J].Clin Exp Med,2018,18(4):495-504.
[6]Bendas G,Borsig L.Heparanase in cancer metastasis:heparin as a potential inhibitor of cell adhesion molecules[J].Adv Exp Med Biol,2020,1221:309-329.
[7]Bergmann F,Wandschneider F,Sipos B,et al.Elevated L1CAM expression in precursor lesions and primary and metastastic tissues of pancreatic ductal adenocarcinoma[J].Oncol Rep,2010,24(4):909-915.
[8]Geismann C,Morscheck M,Koch D,et al.Up-regulation of L1CAM in pancreatic duct cells is transforming growth factorβ1-and slug-dependent:role in malignant transformation of pancreatic cancer[J].Cancer Res,2009,69(10):4517-4526.
[9]Mayer IA,Arteaga CL.The PI3K/AKT pathway as a target for cancer treatment[J].Annu Rev Med,2016,67:11-28.
[10]Liang H,Mokrani A,Chisomo-Kasiya H,et al.Dietary leucine affects glucose metabolism and lipogenesis involved in TOR/PI3K/Akt signaling pathway for juvenile blunt snout bream Megalobrama amblycephala[J].Fish Physiol Biochem,2019,45(2):719-732.
[11]Polivka J,Janku F.Molecular targets for cancer therapy in the PI3K/AKT/mTOR pathway[J].Pharmacol Ther,2014,142(2):164-175.
[12]Akinleye A,Avvaru P,Furqan M,et al.Phosphatidylinositol 3-kinase(PI3K)inhibitors as cancer therapeutics[J].J Hematol Oncol,2013,6(1):88.
[13]Sierra JR,Tsao MS.C-MET as a potential therapeutic target and biomarker in cancer[J].Ther Adv Med Oncol,2011,3(1 Suppl):S21-S35.
[14]Ou SH,Kwak EL,Siwak-Tapp C,et al.Activity of crizotinib(PF02341066),a dual mesenchymal-epithelial transition(MET)and anaplastic lymphoma kinase(ALK)inhibitor,in a non-small cell lung cancer patient with de novo MET amplification[J].J Thorac Oncol,2011,6(5):942-946.
[15]Li Y,Chen CQ,He YL,et al.Abnormal expression of E-cadherin in tumor cells is associated with poor prognosis of gastric carcinoma[J].J Surg Oncol,2012,106(3):304-310.
[16]di Renzo MF,Olivero M,Giacomini A,et al.Overexpression and amplification of the met/HGF receptor gene during the progression of colorectal cancer[J].Clin Cancer Res,1995,1(2):147-154.
[17]Garcia S,Dalès JP,Jacquemier J,et al.C-Met overexpression in inflammatory breast carcinomas:automated quantification on tissue microarrays[J].Br J Cancer,2007,96(2):329-335.
[18]Radaeva S,Ferreira-Gonzalez A,Sirica AE.Overexpression of C-NEU and C-MET during rat liver cholangiocarcinogenesis:a link between biliary intestinal Metaplasia and mucin-producing cholangiocarcinoma[J].Hepatology,1999,29(5):1453-1462.
[19]di Renzo MF,Poulsom R,Olivero M,et al.Expression of the Met/hepatocyte growth factor receptor in human pancreatic cancer[J].Cancer Res,1995,55(5):1129-1138.
[20]Neuzillet C,Couvelard A,Tijeras-Raballand A,et al.High c-Met expression in stageⅠ-Ⅱpancreatic adenocarcinoma:proposal for an immunostaining scoring method and correlation with poor prognosis[J].Histopathology,2015,67(5):664-676.
[21]Hervieu A,Kermorgant S.The role of PI3K in Met driven cancer:a recap[J].Front Mol Biosci,2018,5:86.
[22]Marinkovich MP.Tumour microenvironment:laminin 332 in squamous-cell carcinoma[J].Nat Rev Cancer,2007,7(5):370-380.
[23]Stemmler S,Parwez Q,Petrasch-Parwez E,et al.Association of variation in the LAMA3 gene,encoding theα-chain of laminin 5,with atopic dermatitis in a German case-control cohort[J].BMC Dermatol,2014,14:17.
[24]Castro BGR,Dos Reis R,Cintra GF,et al.Predictive factors for surgical morbidities and adjuvant chemotherapy delay for advanced ovarian cancer patients treated by primary debulking surgery or interval debulking surgery[J].Int J Gynecol Cancer,2018,28(8):1520-1528.
[25]Lincoln V,Cogan J,Hou Y,et al.Gentamicin induces LAMB3 nonsense mutation readthrough and restores functional laminin 332 in junctional epidermolysis bullosa[J].PNAS,2018,115(28):E6536-E6545.
[26]Svoboda M,HlobilováM,MarešováM,et al.Comparison of suction blistering and tape stripping for analysis of epidermal genes,proteins and lipids[J].Arch Dermatol Res,2017,309(9):757-765.
[27]Wang YH,Jin YX,Bhandari A,et al.Upregulated LAMB3 increases proliferation and metastasis in thyroid cancer[J].Onco Targets Ther,2018,11:37-46.
[28]Pan ZF,Li L,Fang QL,et al.Analysis of dynamic molecular networks for pancreatic ductal adenocarcinoma progression[J].Cancer Cell Int,2018,18:214.
[29]Jung SN,Lim HS,Liu LH,et al.LAMB3 mediates metastatic tumor behavior in papillary thyroid cancer by regulating c-MET/Akt signals[J].Sci Rep,2018,8(1):2718.
[30]Huang WJ,Gu JY,Tao T,et al.MiR-24-3p inhibits the progression of pancreatic ductal adenocarcinoma through LAMB3 downregulation[J].Front Oncol,2019,9:1499.
[31]Zhang H,Pan YZ,Cheung M,et al.LAMB3 mediates apoptotic,proliferative,invasive,and metastatic behaviors in pancreatic cancer by regulating the PI3K/Akt signaling pathway[J].Cell Death Dis,2019,10(3):230.

