冬凌草甲素上调PLK1对Jurkat细胞细胞周期的影响
赫玮,左勇
上海交通大学基础医学院生物化学与分子细胞生物学系,上海200025
Polo样蛋白激酶1(Polo-like kinase 1,PLK1)是一种高度保守的丝氨酸/苏氨酸蛋白激酶,其蛋白水平具有严格的细胞周期依赖性。激活PLK1可通过诱导细胞周期蛋白-细胞周期素依赖蛋白激酶B(CDK1-cyclin B)复合物去磷酸化、磷酸化细胞质接头蛋白170(cytoplasmic linker protein-170,Clip-170)调节其与微管的结合[1],磷酸化并激活后期促进复合物/环体(anaphase-promoting complex/cyclosome,APC/C)[2]等机制促进细胞G2/M期转换、有丝分裂以及胞质分裂。由于PLK1参与多种关键的细胞周期事件,因此成为癌症治疗药物研发的靶标之一。
急性T淋巴细胞白血病(acute T-1ymphocytic leukemia,T-ALL)是T淋巴母细胞增殖异常导致的一种血液疾病,临床发病率达1.7/10万[3]。T-ALL患者主要表现为血原始细胞计数较高、纵隔肿块及中枢神经浸润。T-ALL细胞具有高侵袭性,其恶性行为与细胞增殖失控等原因密不可分[4]。目前,中医药治疗白血病的研究不断发展。与传统化学治疗药物相比,中药天然产物的毒副反应较小,且不易出现耐药性。冬凌草甲素(oridonin)是一种贝壳杉烯二萜,体外实验发现可通过不同机制明显抑制白血病等多种肿瘤的细胞生长[5]。研究发现,冬凌草甲能通过Fas/Fasl通路调控细胞色素C的释放,从而诱导U937细胞凋亡[5];能选择性剪切t(8;21)M2b白血病细胞的原癌蛋白AML-ETO而发挥治疗作用[6]。Jurkat细胞目前常被用于T-ALL的体外研究,我们以Jurkat细胞为模型,研究冬凌草甲素对T-ALL的抑制作用及机制,为冬凌草甲素应用于靶向治疗T-ALL提供依据。
1 材料与方法
1.1 材料
1.1.1主要细胞与质粒人急性T淋巴细胞白血病Jurkat细胞和人肾皮质上皮细胞293T(上海交通大学医学院附属第九人民医院北部实验中心保存)。pCMV-flag-PLK1质粒(北京义翘神州生物技术有限公司),psPAX2、pMD2.G质粒、pCMV-Δ8.91(上海交通大学基础医学院病理生理学教研室惠赠)。
1.1.2主要试剂RPMI 1640培养基、DMEM培养基(上海富衡生物科技有限公司),胎牛血清、0.25%胰蛋白酶(Gibco,美 国),Lipofectamine 3000转 染 试 剂(Invitrogen,美国),冬凌草甲素(辰光生物科技有限公司),细胞凋亡检测试剂盒、细胞周期检测试剂盒、高保真DNA聚合酶(上海翊圣生物科技有限公司),瑞士吉姆萨染色液(珠海贝索生物技术有限公司),CCK-8试剂盒(Dojindo,日本),BCA蛋白定量试剂盒(上海碧云天生物技术有限公司),PLK1抗体、WEE1抗体(Santa Cruz,美国),GAPDH抗体(上海康城生物工程有限公司),BubR1抗体、Bub1抗体、Aurora A抗体、Aurora B抗体、HSP90抗体、CDC25c抗体、CDC27抗体(Abcam,英国),Ub抗体(Cell Signaling Technology,美国),Anti-FLAG M2 Magnetic Beads(Sigma,美国),辣根过氧化物酶标记的抗兔/抗鼠二抗(Jackson ImmunoResearch,美国),化学发光试剂盒(Millipore,美国),Cocktail(Biotool,瑞士),MG132(Selleck,美国)。
1.2 方法
1.2.1细胞培养Jurkat细胞和293T细胞于37℃、5%CO2条件下用含有10%胎牛血清和1%青链霉素的培养基培养,待细胞融合度达80%左右时进行传代培养,取对数生长期细胞进行实验。
1.2.2流式细胞术检测细胞周期收集待测细胞,用预冷磷酸缓冲液(phosphate butter saline,PBS)洗涤3遍,重悬细胞于1 mL PBS中,边振荡边逐滴加入3 mL无水乙醇,-20℃固定过夜。次日离心后弃上清液,每个样品中加入0.5 mL配置好的碘化丙啶(propidium iodide,PI)染液,37℃避光孵育30 min,用流式细胞仪检测细胞周期。
1.2.3流式细胞术检测细胞凋亡情况收集待测细胞,用预冷PBS洗涤3次,弃上清。用100μL 1×binding buffer重悬细胞,加入5μL Annexin V-Alexa Fluor488和10μL PI,避 光、室 温 孵 育15 min后 加 入400μL 1×binding buffer,用流式细胞仪检测细胞凋亡情况。
1.2.4蛋白质印迹法检测各蛋白表达收集待测细胞,用预冷PBS洗涤3次,加入SDS细胞裂解液提取细胞总蛋白,收集上清后用聚氰基丙烯酸正丁酯(bicinchonininc acid,BCA)法测定蛋白浓度。各样品加入上样缓冲液后取40μg进行SDS-聚丙烯酰胺凝胶电泳,电泳后将蛋白转移至PVDF膜,5%脱脂牛奶封闭1 h,加入稀释后的一抗4℃孵育过夜。TBST洗膜,加入辣根过氧化物酶标记的二抗室温孵育1 h,再次用TBST洗膜,用化学发光成像系统扫膜成像,定量分析目的蛋白。
1.2.5瑞士吉姆萨染色收集待测细胞,用预冷PBS洗涤后充分吹打混匀,制作细胞涂片。加入50μL瑞士吉姆萨染色A液等待1 min,加入100μL瑞士吉姆萨染色B液等待10 min,用自来水从玻片一端轻轻冲洗干净后晾干,光学显微镜下观察细胞形态。
1.2.6 CCK-8检测细胞增殖情况待测细胞接种于96孔板中,接种浓度为每孔细胞2×105/100μL,分别加入终浓度为0、1、5、10、20、40μmol/L的冬凌草甲素(每个浓度设3个复孔)。将96孔板转移至37℃恒温、含5%CO2的培养箱中培养24 h。每孔加入10μL CCK-8试剂,37℃孵育2 h,酶标仪测定每孔吸光度值(D)。生长率(%)=(处理孔D值-空白孔D值)/(对照孔D值-空白孔D值)×100%。
1.2.7免疫沉淀收集待测细胞,用预冷PBS洗涤3次,加入含蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液,裂解细胞后收集的上清液取1/20用于对照input,其余用于免疫沉淀。清洗磁珠,在清洗后的磁珠中加500μL稀释后的样本,4℃翻转孵育过夜。过夜后的样品用RIPA裂解液洗涤3次,加入1×SDS裂解液,100℃煮样10 min,EP管中的上清可用于Western blotting分析。
1.2.8细胞热力学迁移实验收集待测细胞,用预冷PBS洗涤3次,用PBS重悬细胞沉淀,按1∶100比例加入Cocktail,用液氮反复冻融裂解细胞。在细胞裂解液中加入DMSO或终浓度为100μmol/L的冬凌草甲素,温度梯度孵育后收集蛋白样品用于Western blotting分析。
重复以上步骤裂解待测细胞,在细胞裂解液中加入不同终浓度的冬凌草甲素,孵育后收集蛋白样品用于Western blotting分析。
1.2.9分子对接在Swiss-TargetPrediction(http://www.swisstargetprediction.ch/)网站绘制冬凌草甲素的3D结构,对接前用AUTODOCK(4.2版)软件预处理冬凌草甲素3D结构并设置为对接配体,预处理PLK1蛋白质分子3D结构并设置为接的大分子。设置对接参数后将两者对接,用PyMOL软件进行分析对接结果。
1.2.10构建PLK1突变质粒设计PLK1蛋白Cys67或Cys133位点突变引物(表1),由上海生工生物工程有限公司合成。以pCMV-flag-PLK1质粒为模板进行反应及重组,转化并测序后获得Cys67位点突变质粒pCMVflag-PLK1-M1与Cys133位点突变质粒pCMV-flag-PLK1-M2。
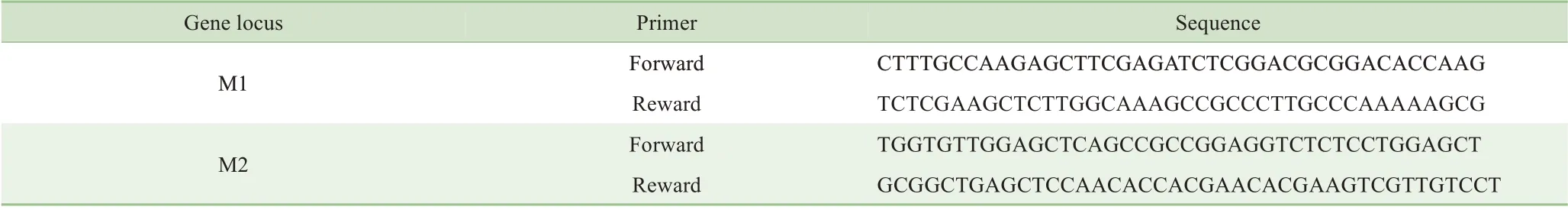
表1 PLK1蛋白Cys67位点(M1)及Cys133位点(M2)突变引物序列(5′→3′)Tab 1 Cys67(M1)and Cys133(M2)mutation primers of PLK1 protein sequence(5′→3′)
1.3 统计学分析
用GraphPad Prism 8.0.2软件对数据进行作图与统计分析,各组间数据使用t检验,符合正态分布的定量资料用x±s表示,P<0.05为差异有统计学意义。
2 结果
2.1 冬凌草甲素抑制Jurkat细胞增殖
CCK-8法检测冬凌草甲素对Jurkat细胞增殖情况的影响,观察到10μmol/L浓度冬凌草甲素即可显著抑制Jurkat细胞增殖(图1A)。我们选择低浓度冬凌草甲素处理Jurkat细胞24 h,用流式细胞术检测Jurkat细胞凋亡情况,发现低剂量冬凌草甲素不诱导Jurkat细胞发生凋亡(图1B)。以上结果显示冬凌草甲素可抑制Jurkat细胞增殖,且低剂量冬凌草甲素不诱导Jurkat细胞凋亡。
2.2 冬凌草甲素诱导Jurkat细胞G2/M期阻滞
用冬凌草甲素处理Jurkat细胞24 h,细胞经PI染色后用流式细胞术检测细胞周期,结果显示当冬凌草甲素浓度达6μmol/L和8μmol/L时,处于G2/M期的Jurkat细胞显著增多(图2A、B);用6μmol/L冬凌草甲素处理Jurkat细胞,发现6μmol/L冬凌草甲素作用12 h后,G2/M期Jurkat细胞数即开始增加并持续至加药后48 h(图2C、D)。上述结果表明冬凌草甲素可诱导Jurkat细胞发生G2/M期阻滞。
为深入观察冬凌草甲素对Jurkat细胞有丝分裂的影响,我们用浓度为6μmol/L的冬凌草甲素处理Jurkat细胞24 h,瑞士吉姆萨染色结果显示冬凌草甲素处理后,有丝分裂期的细胞数量显著增加,表现为细胞核体积增大,染色质浓缩为染色体,染色单体分离(图2E)。在Jurkat细胞加入浓度为6μmol/L冬凌草甲素,0、12、24 h分别提取总蛋白并用Western blotting方法检测cyclin B蛋白表达情况,发现冬凌草甲素可使cyclin B表达升高(图2F)。以上实验结果均表明冬凌草甲素可诱导Jurkat细胞发生G2/M期阻滞。
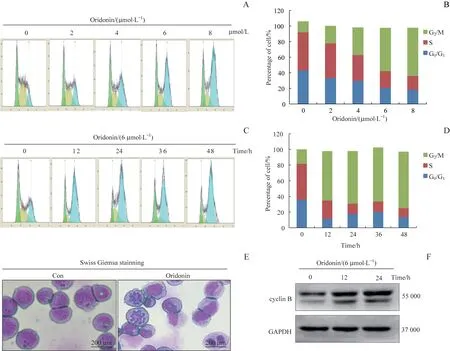
图2低剂量冬凌草甲素处理Jurkat细胞后对细胞周期的影响Fig 2 Effect of low concentration oridonin on the cell cycle in Jurkat cells
2.3 冬凌草甲素上调Jurkat细胞PLK1蛋白水平
细胞周期事件的发生受到细胞周期蛋白的调控,许多蛋白激酶在细胞周期的不同阶段催化不同的细胞周期蛋白发生磷酸化,促发细胞周期进程。我们以“mitosis”为关键词检索Genecards数据库获取与有丝分裂相关的基因信息,检索结果显示有7 690个基因可能参与调控有丝分裂,我们选取排名靠前的5个蛋白激酶BuBR1、BuB1、PLK1、Aurora A、Aurora B展开研究(表2)。用浓度为6μmol/L的冬凌草甲素处理Jurkat细胞12和24 h后,检测细胞中BuBR1、BuB1、PLK1、Aurora A、Aurora B蛋白的表达情况。Western blotting结果显示冬凌草甲素处理后,PLK1蛋白表达显著增加,而其他4种蛋白的表达量未发生明显变化(图3)。鉴于PLK1蛋白和细胞周期调控的密切关系,我们推测冬凌草甲素通过上调PLK1诱导Jurkat细胞发生有丝分裂阻滞。
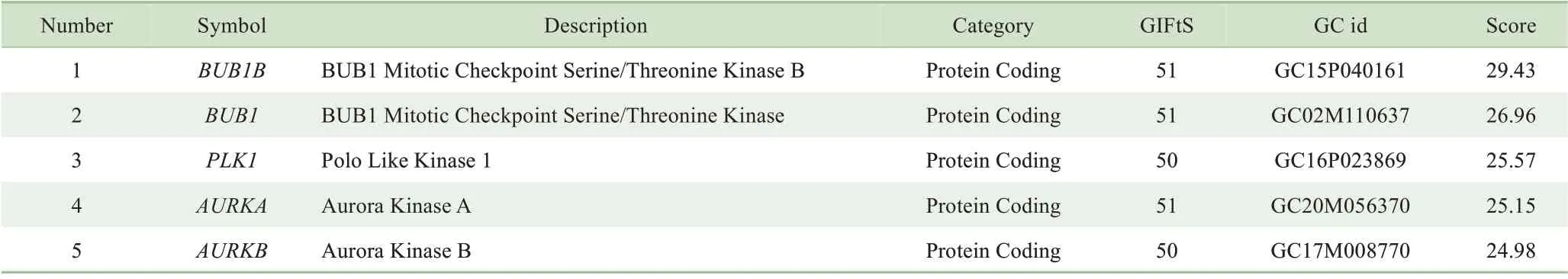
表2 Genecards数据库中检索与有丝分裂相关的基因信息Tab 2 Searching the Genecards database with"mitosis"as key word
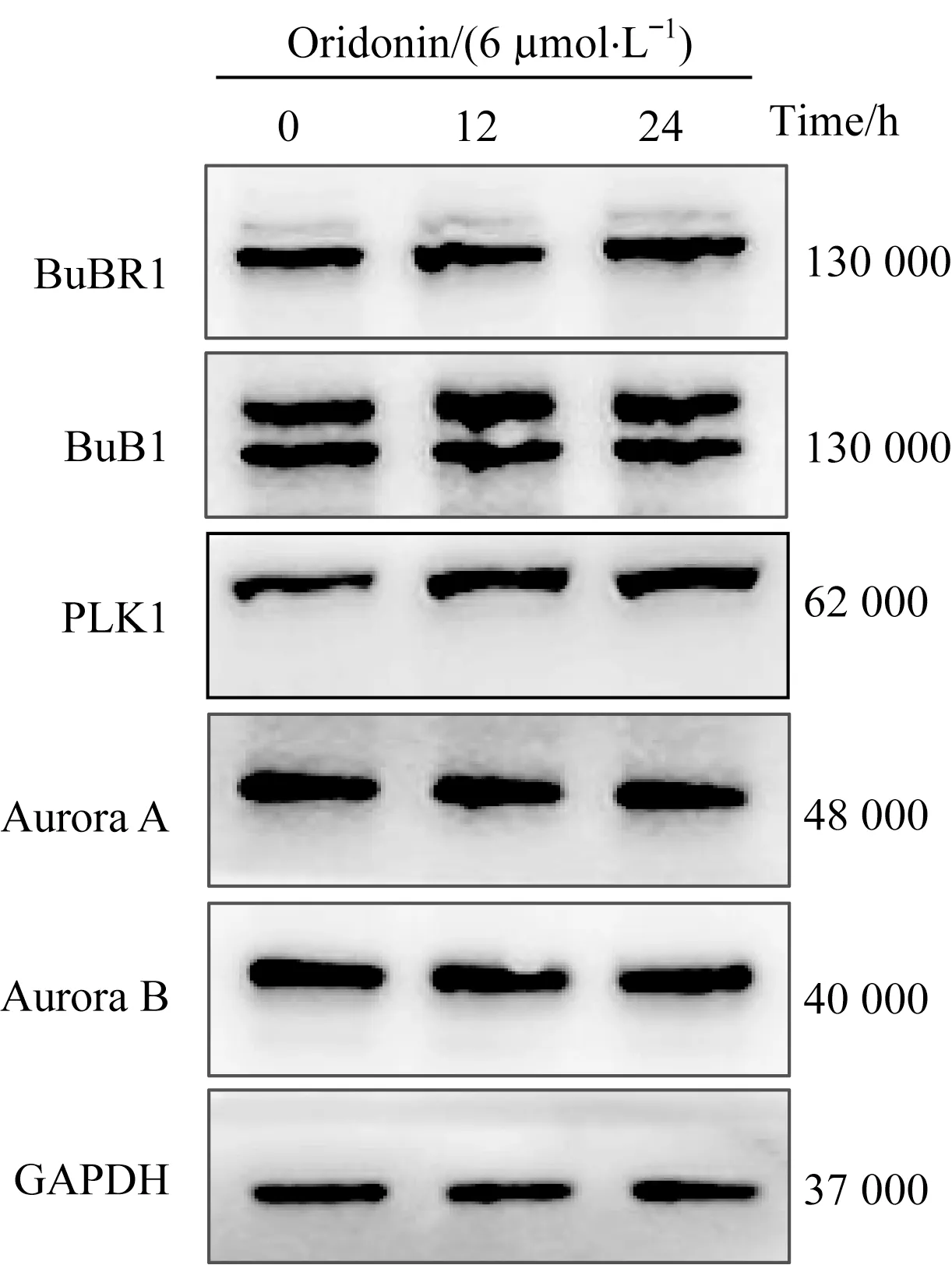
图3低剂量冬凌草甲素对有丝分裂相关蛋白激酶表达的影响Fig 3 Effect of low concentration oridonin on the expression of mitosis-related kinase
2.4 冬凌草甲素促进PLK1下游蛋白磷酸化
细胞周期蛋白BuBR1、CDC25c、CDC27的磷酸化和活性受PLK1调控,我们通过检测这些蛋白的磷酸化水平来反映PLK1的活性。分别用6μmol/L冬凌草甲素和274 ng/mL的PLK1激动剂Noc处理Jurkat细胞,于0、6、12、18、24 h提取细胞总蛋白,用Western blotting方法检测PLK1下游蛋白BuBR1、CDC25c、CDC27的磷酸化情况。因为BuBR1、CDC25c、CDC27的磷酸化抗体效果不佳,我们选用以上激酶的总蛋白抗体进行检测。结果显示:用Noc处理Jurkat细胞后,PLK1下游蛋白的磷酸化水平随药物处理时间的增加而加强;6μmol/L冬凌草甲素诱导PLK1下游蛋白磷酸化水平在12 h达高峰,之后随时间延长其磷酸化水平略有降低,但始终高于未加入冬凌草甲素的对照组(图4A)。此结果表明冬凌草甲素可上调PLK1蛋白激酶活性。
WEE1是细胞周期依赖性激酶CDK1的抑制性激酶,WEE1被PLK1磷酸化后经泛素化修饰降解。我们也检测了WEE1的蛋白含量,结果显示WEE1蛋白含量在冬凌草甲素处理12 h后显著减少(图4B),表明冬凌草甲素上调PLK1活性。
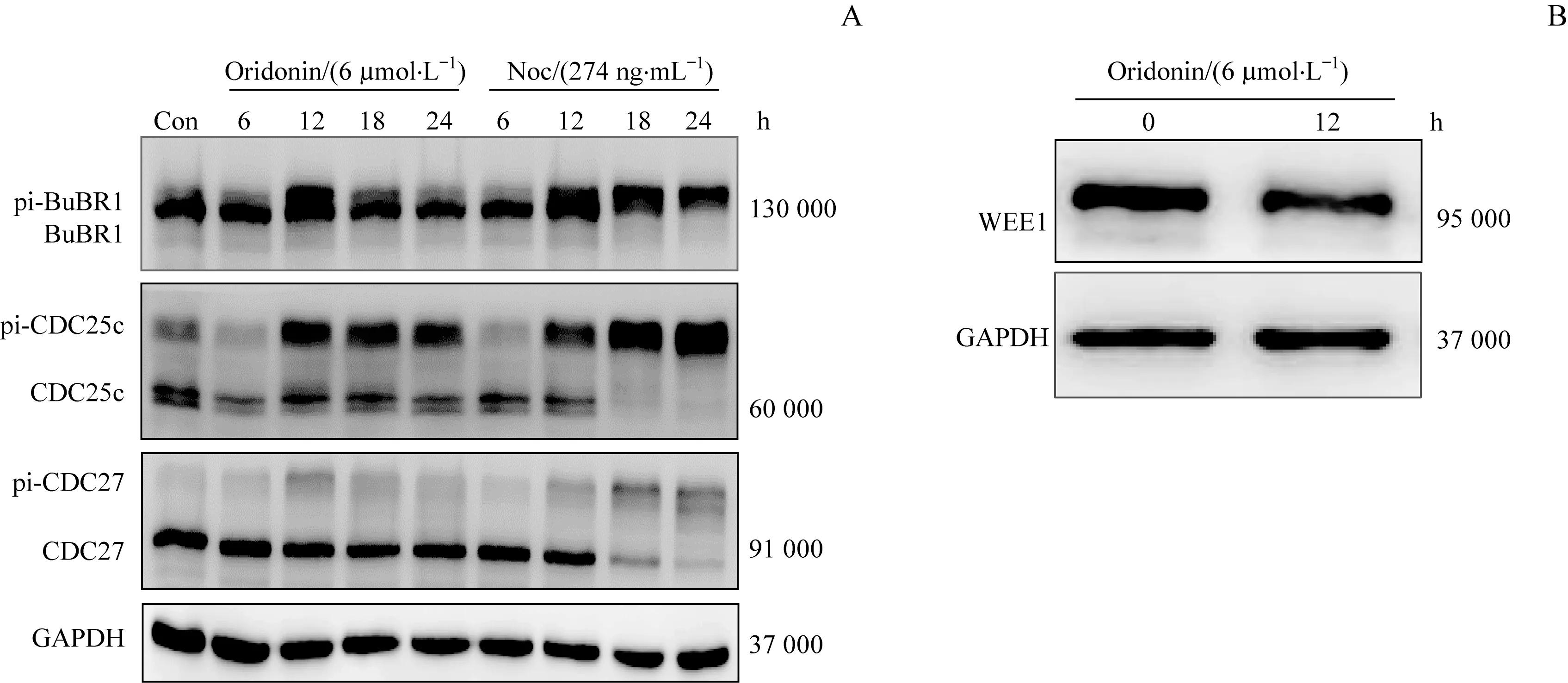
图4冬凌草甲素对PLK1下游蛋白磷酸化水平的影响Fig 4 Effect of oridonin on the phosphorylation level of PLK1 downstream protein
2.5 冬凌草甲素抑制PLK1蛋白发生泛素化修饰和蛋白酶体途径降解
研究表明PLK1在细胞有丝分裂完成后通过泛素化修饰和蛋白酶体途径降解,我们进一步对冬凌草甲素是否通过抑制PLK1蛋白的泛素化修饰和蛋白酶体途径降解来维持蛋白的稳定性进行探讨。
我们在PLK1过表达的293T细胞中分别加入浓度为0、10、20、50μmol/L的冬凌草甲素,处理24 h后通过免疫共沉淀实验获得外源性表达的Flag-PLK1蛋白,通过Western blotting方法检测PLK1泛素化修饰水平的改变。结果显示冬凌草甲素抑制了Flag-PLK1蛋白的泛素化修饰,并呈现浓度依赖效应(图5)。
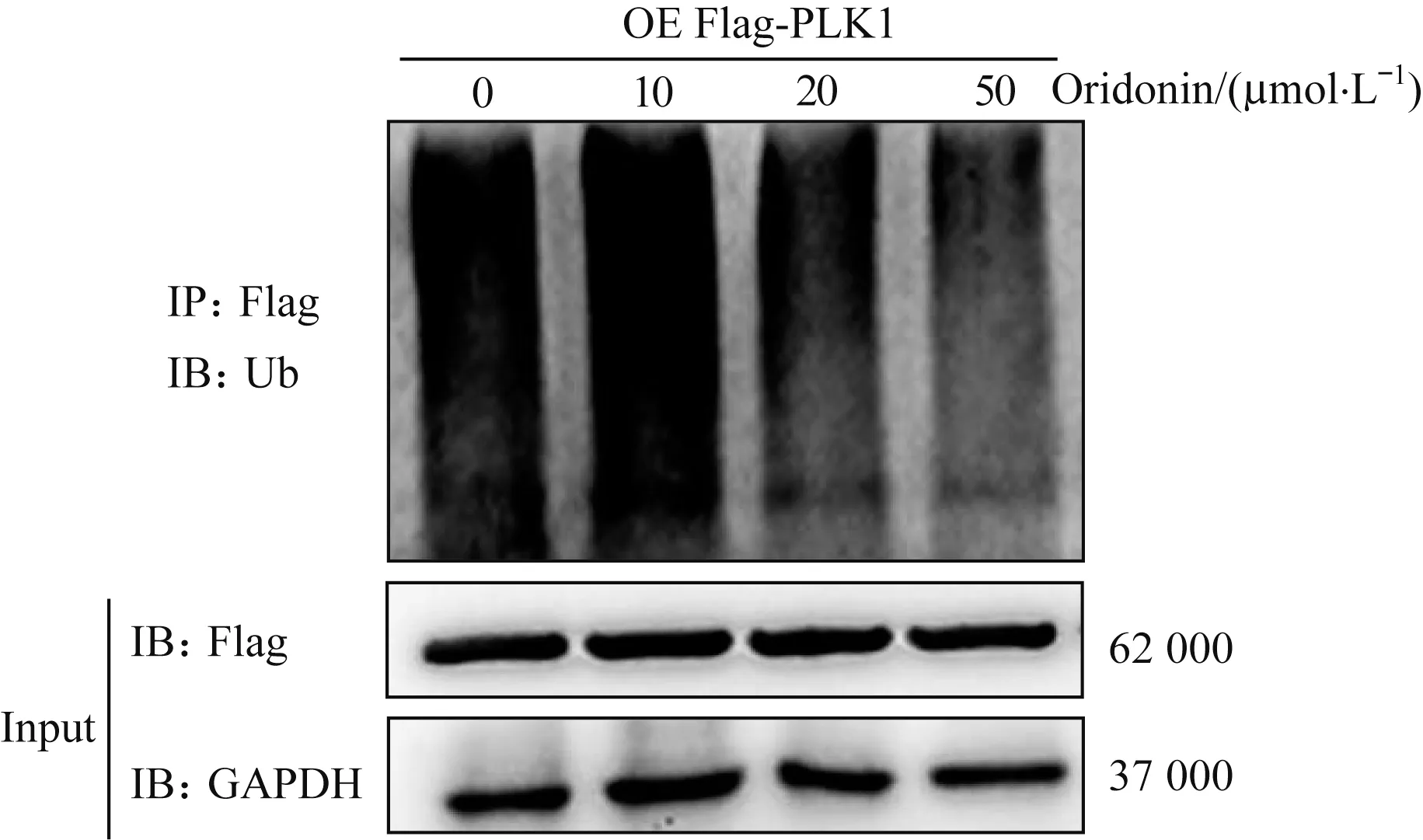
图5冬凌草甲素对PLK1蛋白泛素化修饰水平的影响Fig 5 Effect of oridonin on the level of ubiquitination modification for PLK1 protein
2.6 冬凌草甲素可直接与PLK1蛋白结合
我们运用细胞热力学迁移实验检测冬凌草甲素对PLK1蛋白的热稳定性的影响,以推断冬凌草甲素是否与PLK1形成复合物。我们在Jurkat细胞裂解液中加入DMSO或终浓度为100μmol/L的冬凌草甲素室温孵育30 min,分别在45.0、46.7、49.3、52.5、56.9、60.2℃孵育3 min后,Western blotting检测不同温度条件下冬凌草甲素对PLK1的蛋白量的影响。发现在45.0、46.7、49.3、52.5、56.9、60.2℃处理温度下,PLK1蛋白量减少,说明冬凌草甲素能通过与PLK1形成复合物而降低PLK1的热稳定性(图6A、B)。
由于46.7℃孵育后冬凌草甲素对PLK1蛋白的稳定性影响最大,我们进一步用46.7℃进行热处理,探讨不同浓度冬凌草甲素对PLK1蛋白稳定性的影响,验证冬凌草甲素是否与PLK1蛋白直接结合。在Jurkat细胞裂解液中加入DMSO或终浓度为12.5、25.0、50.0、100.0、200.0μmol/L的冬凌草甲素,46.7℃孵育后Western blotting检测PLK1蛋白含量。结果显示,与加入DMSO的对照组相比,PLK1蛋白稳定性与冬凌草甲素浓度负相关(图6C、D)。以上结果证明冬凌草甲素可与PLK1蛋白直接结合。
2.7 冬凌草甲素与PLK1蛋白质分子对接

图6不同温度或浓度条件下冬凌草甲素对PLK1稳定性的影响Fig 6 Effect of oridonin on the stability of PLK1 under different temperatures or concentration
通过检索蛋白质数据库(Protein Data Bank,PDB),我们获得PLK1蛋白与其ATP竞争型抑制剂BI2536的复合物 结 构(PDB编 号:2RKU,图7A)。我 们 使 用AUTODOCK软件(4.2版)模拟冬凌草甲素与PLK1蛋白(PDB编号:2RKU)的对接情况(图7B),经PyMOL软件分析对接结果,发现冬凌草甲素与PLK1复合物的对接能量为-31.1 J/mol,在对接口袋中PLK1蛋白有2个半胱氨酸残基(Cys67和Cys133)与冬凌草甲素相距较近,可能会形成共价键。由此推测,PLK1蛋白Cys67或Cys133位点对PLK1与冬凌草甲素直接结合发挥重要作用。
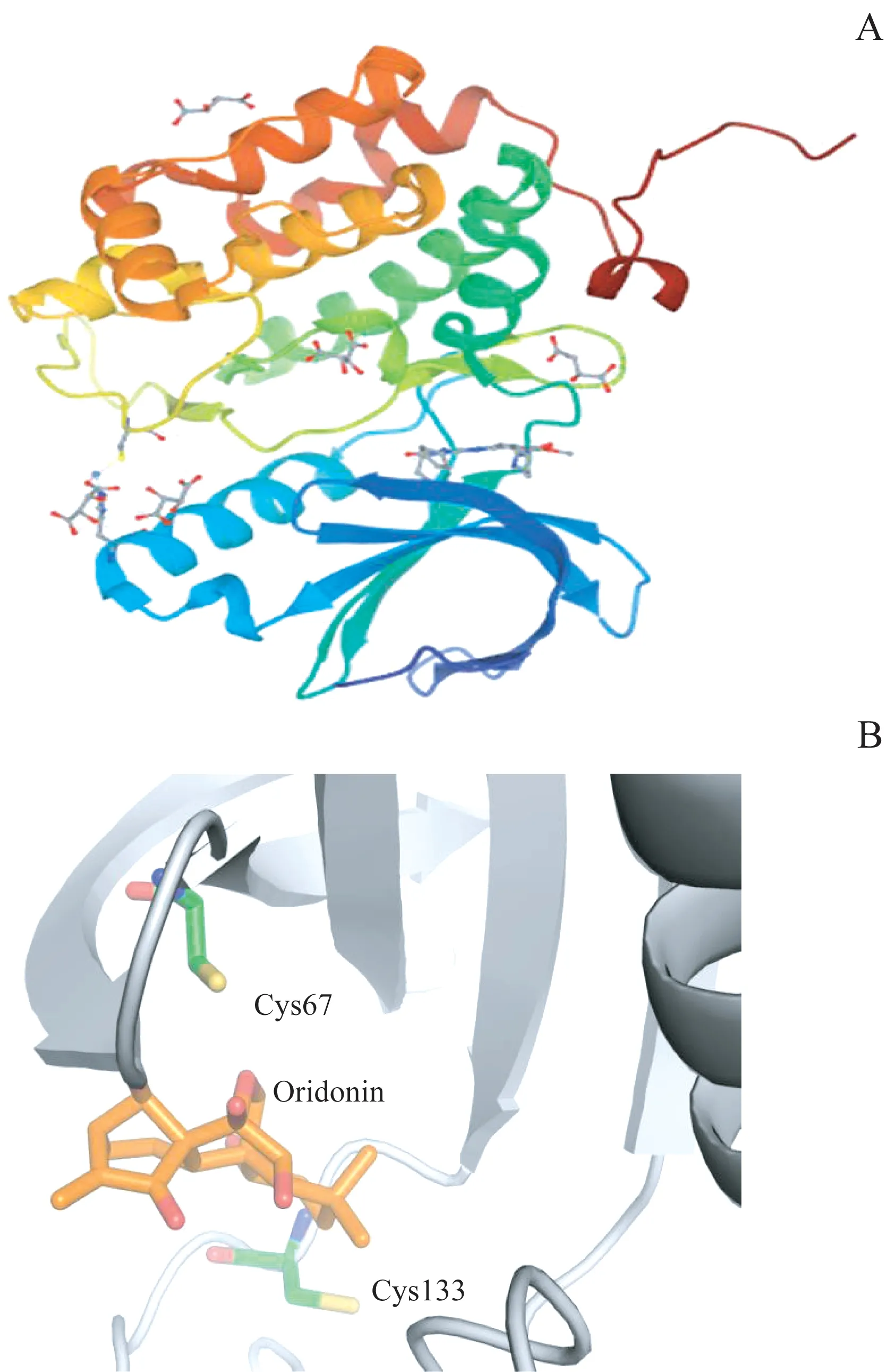
图7冬凌草甲素与PLK1对接位点预测Fig 7 Prediction of the docking site of oridonin and PLK1
2.8 PLK1蛋白上Cys67或Cys133位点参与冬凌草甲素与PLK1蛋白直接结合且上调PLK1蛋白稳定性
通过分析冬凌草甲素与PLK1蛋白质分子对接模型,我们推测PLK1蛋白氨基酸残基Cys67或Cys133可能对PLK1与冬凌草甲素直接结合发挥重要作用,故通过定点突变的方法构建Cys67、Cys133位点突变为色氨酸的突变质粒。分别在转染pCMV-flag-PLK1、pCMV-flag-PLK1-M1、pCMV-flag-PLK1-M2质粒的239T细胞裂解液中加入DMSO或浓度为200μmol/L的冬凌草甲素,经46.7℃孵育后Western blotting检测结果显示突变后每组Flag-PLK1蛋白的表达量无明显变化(图8A、B),即PLK1蛋白分子的氨基酸残基Cys67或Cys133突变后,冬凌草甲素不再诱导PLK1蛋白稳定性发生变化,提示冬凌草甲素不再与PLK1蛋白直接结合。
我们在转染野生型及突变型质粒的293T细胞中分别加入浓度为0或50μmol/L的冬凌草甲素,24 h后收集蛋白裂解液经免疫沉淀获得外源性表达的PLK1蛋白,通过Western blotting方法检测冬凌草甲素对其泛素化修饰水平的影响。结果显示Cys67位点或Cys133位点突变后,冬凌草甲素对PLK1泛素化修饰的抑制显著减弱(图8C),提示PLK1蛋白上Cys67或Cys133位点参与冬凌草甲素上调PLK1蛋白稳定性。
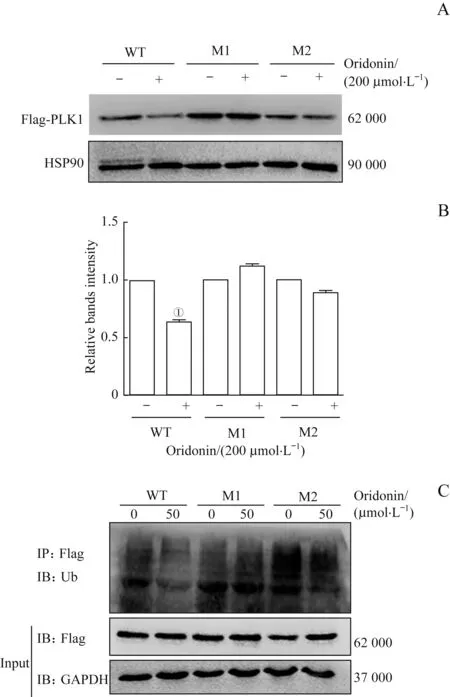
图8 PLK1蛋白突变后冬凌草甲素对PLK1稳定性的影响Fig 8 Effect of oridonin on the stability of PLK1 after mutation
3 讨论
近年来,用传统中药治疗T-ALL,对其有效天然产物进行验证并进行结构改造及增效,正逐渐引起广泛关注。来自中药的天然产物因其不良反应少、作用确切等诸多优势而成为抗肿瘤药物的研究热点[7]。冬凌草甲素是冬凌草的有效活性成分,分子中与环外亚甲基共轭的环戊酮结构是发挥药理作用的活性中心。冬凌草甲素对急性白血病、胰腺癌、乳腺癌等有抑制肿瘤细胞增殖和诱导细胞凋亡的作用[8-11],且其毒性低,对骨髓、肝、肾等无明显损伤[12],提示冬凌草甲素是较好的抗肿瘤候选药物之一。
有研究[13]报道冬凌草甲素可通过抑制NF-κB通路或下调Brg1抑制Jurkat细胞增殖。Dal Piaz等[14]用蛋白质组学方法研究发现,在Jurkat细胞中,冬凌草甲素可以直接与Hsp70-1A结合并使之结构发生改变而无法与下游靶标结合,最终产生抗肿瘤作用。我们的研究结果显示,冬凌草甲素可抑制Jurkat细胞增殖,且低剂量冬凌草甲素诱导Jurkat细胞发生G2/M期阻滞。
PLK1最早在黑腹果蝇的基因组中被发现,其蛋白水平和活性在细胞周期进程中受到精确调控,在G1期几乎检测不到PLK1蛋白,在S期PLK1蛋白开始累积,于G2末期达到峰值,M期维持高水平,分裂完成后急剧下降[15]。由于PLK1参与各种关键的细胞周期事件,因此被认为是有效的癌症治疗药物靶标之一。我们发现低剂量冬凌草甲素诱导Jurkat细胞阻滞在有丝分裂期,由此我们猜测冬凌草甲素可能直接调控了有丝分裂相关的激酶。Genecards数据库检索结果显示,BuBR1、BuB1、PLK1、Aurora A、Aurora B是评分最高的调控有丝分裂的蛋白激酶,且BuBR1、PLK1、Aurora A和Aurora B蛋白都能发生泛素化修饰降解,从而快速调控其在有丝分裂期中的蛋白量[16]。我们用冬凌草甲素处理Jurkat细胞,发现冬凌草甲素可上调PLKl蛋白量且上调其活性,而另4种蛋白激酶的含量无变化,提示PLK1可能是冬凌草甲素的另一个作用靶点。
泛素-蛋白酶体途径(ubiquitin proteasome pathway,UPP)可降解细胞内超过80%的正常或异常蛋白质,是一种具有高度特异性和选择性的蛋白质降解途径[17],泛素化过程与几乎所有细胞生理活动相关,泛素-蛋白酶体系统的异常调控会导致肿瘤等各种疾病的发生[18]。蛋白质通过泛素化途径降解或者通过抑制泛素化降解导致蛋白累积是快速调控蛋白水平的途径,也是细胞周期进程中调控细胞周期依赖性蛋白水平的重要方式。我们的研究不仅发现冬凌草甲素处理Jurkat细胞24 h后PLK1蛋白含量始终维持高水平,且揭示冬凌草甲素可抑制PLK1蛋白的泛素化修饰,这可能是提高PLK1蛋白稳定性的主要机制。
细胞裂解液中各不同靶蛋白都有各自独特的熔解曲线。Martinez Molina等[19]将临床药物作用于细胞裂解液,发现如药物可与靶蛋白结合,则可观察到靶蛋白的熔解曲线发生明显移动,由此设计细胞热力学迁移实验(celluar thermal shift assay,CETSA)。结合后形成的复合物会改变靶蛋白原来的热稳定性,使其在一定温度范围内更稳定或更容易降解,通过这种稳定性的差异,我们可以判断小分子化合物和靶蛋白能形成复合物[20-21]。CETSA的结果证明冬凌草甲素可与PLK1蛋白直接结合。虽然我们初步证实冬凌草甲素能和PLK1直接作用,但是我们也不排除冬凌草甲素通过抑制特异性泛素连接酶E3来抑制PLK1的泛素化修饰和降解。
为进一步验证冬凌草甲素可与PLK1蛋白结合,我们通过定点突变的方法分别构建PLK1蛋白氨基酸残基Cys67、Cys133位 点 突 变 的pCMV-flag-PLK1-M1和pCMV-flag-PLK1-M2质粒并转染293T细胞,获得外源性表达的突变型PLK1蛋白。CETSA结果显示冬凌草甲素不再诱导Cys67或Cys133位点突变后的PLK1蛋白含量发生变化,提示Cys67或Cys133位点在冬凌草甲素与PLK1直接结合中起核心作用。我们继续深入探索Cys67、Cys133位点对冬凌草甲素处理后PLK1蛋白稳定性的影响,发现以上位点突变后可逆转冬凌草甲素诱导的PLK1泛素化修饰水平下调,提示冬凌草甲素与PLK1的直接结合受抑制,证实Cys67和Cys133位点是PLK1与冬凌草甲素结合的关键位点。
综上所述,冬凌草甲素可诱导Jurkat细胞发生G2/M期阻滞以抑制细胞增殖。进一步探究其机制,发现冬凌草甲素可上调PLK1蛋白含量并通过直接与PLK1蛋白结合而抑制其泛素化降解,从而增强PLK1蛋白稳定性。经计算机模拟及体外实验验证,我们发现PLK1蛋白的Cys67和Cys133位点是PLK1蛋白与冬凌草甲素结合的关键位点。
参·考·文·献
[1]Whibley C,Pharoah PDP,Hollstein M.p53 polymorphisms:cancer implications[J].Nat Rev Cancer,2009,9(2):95-107.
[2]Nasmyth K.Segregating sister genomes:the molecular biology of chromosome separation[J].Science,2002,297(5581):559-565.
[3]Cao PF,Yu YL,Wang W,et al.Fluorescence in situ hybridization comparison of the prognostic factors in adult and pediatric acute lymphoblastic leukemia:a retrospective analysis of 282 cases[J].Exp Ther Med,2018,16(6):4674-4684.
[4]Han QG,Xu X,Li J,et al.GATA4 is highly expressed in childhood acute lymphoblastic leukemia,promotes cell proliferation and inhibits apoptosis by activating BCL2 and MDM2[J].Mol Med Rep,2017,16(5):6290-6298.
[5]郭勇,单卿卿,龚玉萍,等.冬凌草甲素抗Ph染色体阳性急性淋巴细胞白血病效应的实验研究[J].中华血液学杂志,2012,33(6):439-443.
[6]Zhen T,Wu CF,Liu P,et al.Targeting of AML1-ETO in t(8;21)leukemia by oridonin generates a tumor suppressor-like protein[J].Sci Transl Med,2012,4(127):127ra38.
[7]Moreau P,Attal M,Facon T.Frontline therapy of multiple myeloma[J].Blood,2015,125(20):3076-3084.
[8]Li FF,Yi S,Wen L,et al.Oridonin induces NPM mutant protein translocation and apoptosis in NPM1c+acute myeloid leukemia cells in vitro[J].Acta Pharmacol Sin,2014,35(6):806-813.
[9]Gui ZF,Luo F,Yang YY,et al.Oridonin inhibition and miR-200b-3p/ZEB1 axis in human pancreatic cancer[J].Int J Oncol,2017,50(1):111-120.
[10]Xu B,Shen W,Liu X,et al.Oridonin inhibits BxPC-3 cell growth through cell apoptosis[J].Acta Biochim Biophys Sin(Shanghai),2015,47(3):164-173.
[11]齐琦,张配,李其响,等.冬凌草甲素诱导三阴乳腺癌MDA-MB-231细胞凋亡及对细胞内活性氧水平的影响[J].中国中药杂志,2017,42(12):2361-2365.
[12]张覃沐.一种新的抗癌物质冬凌草素[J].科学通报,1978,23(1):53-54.
[13]叶珍珍,薛飞龙,丁文评,等.冬凌草甲素通过下调Brg1表达抑制Jurkat细胞生长[J].中国当代儿科杂志,2017,19(11):1208-1212.
[14]Dal Piaz F,Cotugno R,Lepore L,et al.Chemical proteomics reveals HSP70 1A as a target for the anticancer diterpene oridonin in Jurkat cells[J].J Proteomics,2013,82:14-26.
[15]Lee KS,Yuan YL,Kuriyama R,et al.Plk is an M-phase-specific protein kinase and interacts with a kinesin-like protein,CHO1/MKLP-1[J].Mol Cell Biol,1995,15(12):7143-7151.
[16]Park J,Kwon MS,Kim EE,et al.USP35 regulates mitotic progression by modulating the stability of Aurora B[J].Nat Commun,2018,9(1):688.
[17]Wang JS,Maldonado MA.The ubiquitin-proteasome system and its role in inflammatory and autoimmune diseases[J].Cell Mol Immunol,2006,3(4):255-261.
[18]俞卿,熊秀芳,孙毅.靶向Cullin-RING E3泛素连接酶的抗肿瘤策略及相关药物研发进展[J].浙江大学学报(医学版),2020,49(1):1-19.
[19]Martinez Molina D,Jafari R,Ignatushchenko M,et al.Monitoring drug target engagement in cells and tissues using the cellular thermal shift assay[J].Science,2013,341(6141):84-87.
[20]Almqvist H,Axelsson H,Jafari R,et al.CETSA screening identifies known and novel thymidylate synthase inhibitors and slow intracellular activation of 5-fluorouracil[J].Nat Commun,2016,7:11040.
[21]Martinez Molina D,Nordlund P.The cellular thermal shift assay:a novel biophysical assay for in situ drug target engagement and mechanistic biomarker studies[J].Annu Rev Pharmacol Toxicol,2016,56:141-161.

