小鼠射血分数保留心力衰竭模型的建立
陈骁楠,张俊峰,王长谦,张绘莉
上海交通大学医学院附属第九人民医院心内科,上海200011
美国心脏病学会(American Heart Association,AHA)和欧洲心脏病学会(European Society of Cardiology,ESC)的2016年临床指南按照射血分数<40%、41%~49%、>50%,将心力衰竭分为射血分数降低的心力衰竭、射血分数中间范围的心力衰竭、射血分数保留的心力衰竭(heart failure with preserved ejection fraction,HFpEF)[1-2]。HFpEF是一种复杂的异质性疾病,好发于老年人、肥胖者、女性,常伴有高血压、糖尿病、肾功能不全、心房颤动等基础疾病,约占心力衰竭患者住院人数的50%,临床上尚缺乏有效的治疗手段[3]。构建与临床发病特点类似的动物模型,对于进一步探索HFpEF的发生机制和防治方法具有重要的意义。本研究通过高脂饲养和Nω-硝基-L-精氨酸甲酯盐酸盐(Nω-nitro-L-arginine methyl ester hydrochloride,L-NAME)诱导建立了一种新型小鼠HFpEF动物模型,以期为HFpEF的病理生理机制研究提供帮助。
1 材料与方法
1.1 实验动物
8周龄的SPF级雄性和雌性C57BL/6J小鼠各16只,共32只,购于江苏集萃药康生物科技有限公司。实验动物生产许可证号为SCXK(苏)2018-0008,动物使用许可证号为SYXK(沪)2016-0016。实验动物饲养于上海交通大学医学院附属第九人民医院动物房,昼夜节律规律,以60%高脂饲料(江苏省协同医药生物工程有限责任公司)和含有0.5 g/L L-NAME的饮水饲养。研究符合上海交通大学医学院附属第九人民医院动物伦理委员会要求,批件号为SH9H-2019-A416-1。
1.2 试剂与仪器
L-NAME(德国Sigma),Masson三色染色试剂盒(北京索莱宝科技有限公司),异氟烷(深圳市瑞沃德生命科技有限公司),苏木精、伊红(碧云天生物技术有限公司),Vevo 3100小动物超声成像系统(加拿大VisualSonics),Eppendorf 5424小型离心机(德国Eppendorf),Visitech BP-2000动物血压计(美国Visitech System),AU5800全自动生化分析仪(美国Beckman Coulter),Axio Zoom.V16宏观变倍荧光显微镜(德国ZEISS)。
1.3 造模及分组
将雄性和雌性C57BL/6J小鼠随机分成对照组和模型组,每组8只。模型组每日予以充足的60%高脂饲料饲养,每周更换2次含有0.5 g/L L-NAME的饮水。对照组给予普通饲料以及普通饮水喂养,保证食物饮水充足。造模开始时及造模后第4、8、12、16周测定小鼠体质量。造模后第16周小鼠异氟烷气体麻醉后,经眼球取血,4℃、2 200×g离心15 min,取上层血清于-80℃冰箱保存。取血后颈椎脱臼法处死小鼠,分离心脏,电子天平上称量质量后,置于4%多聚甲醛溶液中固定。
1.4 小动物心脏超声检测
造模后每2周进行1次小动物心脏超声检测。小鼠异氟烷持续麻醉(0.3~0.5 L/min)后,取仰卧位,同步描记心电图。采用多普勒超声心动图,探头频率30 MHz,检测各组小鼠左心室舒张末期内径(left ventricular enddiastolic diameter,LVEDd)、舒张期左心室前壁厚度(left ventricle anterior wall thickness,LVAWd)、舒张期左心室后壁厚度(left ventricle posterior wall thickness,LVPWd)、左 室 射 血 分 数(left ventricular ejection fraction,LVEF)、二尖瓣口血流速度(mitral orifice flow velocity,MV)、二尖瓣舒张早期血流速度峰值与晚期血流速度峰值的比值(E/A比值)、二尖瓣舒张早期血流速度峰值与二尖瓣环舒张早期运动速度峰值的比值(E/E′比值)、左心室整体长轴应变(global longitudinal strain,GLS)。连续测定3个心动周期,取均值。
1.5 血压和血脂指标检测
按Visitech BP-2000动物血压计说明书操作,采用尾动脉测压法测量小鼠收缩压(systolic blood pressure,SBP)和舒张压(diastolic blood pressure,DBP),重复测量3次,取均值。
按AU5800全自动生化分析仪说明书操作,检测小鼠血清中三酰甘油(triacylglycerol,TAG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(highdensity lipoprotein cholesterol,HDL-Ch)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-Ch)。
1.6 心肌组织病理学检查
取小鼠心肌组织块,于4%多聚甲醛溶液中固定,常规梯度乙醇脱水,使用二甲苯渗透,石蜡固定包埋,制成厚度4μm的组织切片。常规脱蜡至水,梯度乙醇脱水,苏木精染色3 min,自来水冲洗。1%盐酸乙醇溶液分化10 s,0.2%氨水冲洗返蓝30 s,自来水冲洗,伊红复染3 min,使用梯度乙醇切片脱水,二甲苯透明,中性树胶封片。按Masson三色染色试剂盒说明书进行染色。使用Axio Zoom.V16宏观变倍荧光显微镜观察小鼠心肌组织切片病理变化。每个样本20倍镜下随机取5个视野,通过Image J软件进行定量分析。
1.7 统计学方法
数据采用GraphPad Prism 8.0软件处理。定量数据以x±s表示,2组间比较采用独立样本t检验,3组及以上组间比较采用单因素方差分析图基(tukey)事后检验法。P<0.05时认为差异具有统计学意义。
2 结果
2.1 模型小鼠的体质量变化
雄性小鼠自造模后第4周起体质量较同性别对照组明显上升(P<0.05);雌性模型组小鼠体质量增加缓慢,第8周起雌性模型组小鼠体质量才明显高于雌性对照组(P<0.05)。结果见表1。

表1 HFpEF模型小鼠体质量的变化情况Tab 1 Changes in body weight in the HFpEF mice
2.2 血脂水平的变化
造模后第16周时,与同性别对照组相比,模型组TAG、TC、HDL-Ch、LDL-Ch水平升高,差异有统计学意义(表2)。此外,雄性模型组小鼠的TC、HDL-Ch的水平高于雌性模型组,差异有统计学意义。
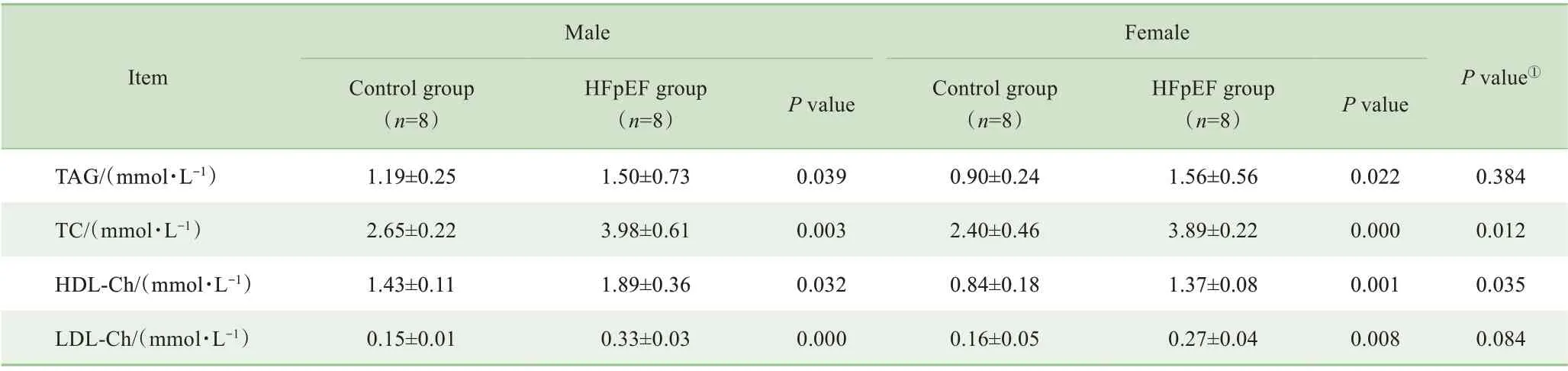
表2 HFpEF模型小鼠造模后第16周的血脂指标情况Tab 2 Changes in blood lipid profiles in the HFpEF mice at the 16th week after modeling
2.3 血压变化
造模后第16周测量小鼠SBP和DBP,发现与同性别对照组相比,模型组的SBP和DBP水平显著升高(表3)。雌性模型组小鼠的DBP水平高于雄性模型组。
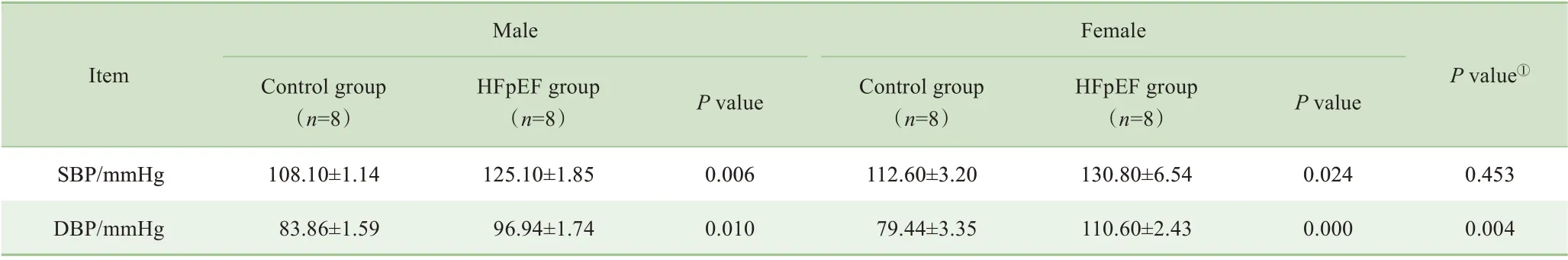
表3 HFpEF模型小鼠造模后第16周的血压情况Tab 3 Changes in blood pressure in the HFpEF mice at the 16th week after modeling
2.4 心脏质量的变化
造模后第16周时雄性小鼠与同性别对照组相比,心脏质量明显增加,但是心脏质量与体质量的比值出现了一定程度的降低(表4)。雌性模型组小鼠与同性别对照组相比,心脏质量和心脏质量与体质量的比值均出现了明显上升。
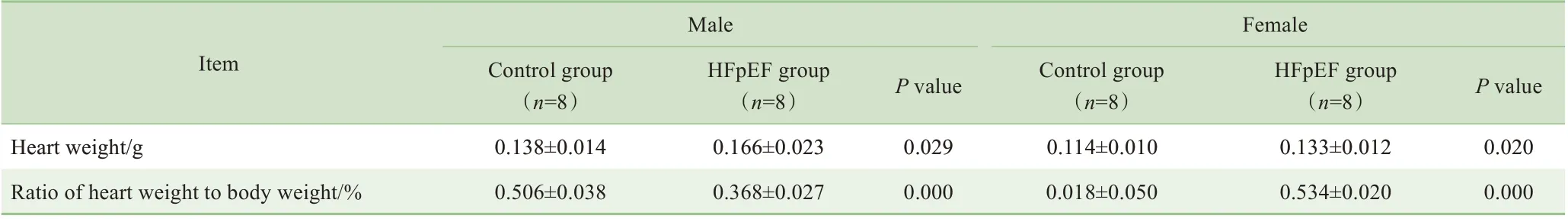
表4 HFpEF模型小鼠造模后第16周的心脏质量情况Tab 4 Changes in heart weight in the HFpEF mice at the 16th week after modeling
2.5 左心室舒张功能的变化
自造模后第8周起,多普勒超声心动图显示雌性或雄性模型组E/A比值、E/E′比值、GLS均较同性别对照组升高,提示左心室舒张功能明显降低,但LVEF始终保持稳定(图1)。第16周时仍可以观察到上述心脏超声检测指标的变化趋势。此外,与雌性模型组小鼠比较,雄性模型组小鼠的E/E′比值升高更加明显。

图1 HFpEF模型小鼠LVEF和左心室舒张功能的超声心动图改变Fig 1 Echocardiography changes in LVEF and left ventricular diastolic function in the HFpEF mice
2.6 左心室结构的变化
与同性别对照组相比,模型组小鼠的舒张期LVAWd明显增厚(P=0.002,P=0.000),但舒张期LVPWd以及LVEDd与同性别对照组差异无统计学意义(图2)。
2.7 心脏组织的病理改变
病理组织学结果显示:对照组心肌纤维形态结构正常,排列规则,分界清晰,间质未见明显异常,未见明显炎症细胞浸润;模型组小鼠心肌细胞呈现不同程度的变性和肥大,可见局灶性坏死,肌纤维间隙增加、纤维化增加(图3A、C),并有炎症细胞浸润(图3B、D)。
3 讨论
HFpEF的发生与年龄、高血压、糖尿病、血脂异常等多种危险因素和临床疾病相关,病理生理变化复杂多样,可能通过内皮功能障碍、心脏神经体液调节异常和系统性炎症等多个机制,影响左心室结构和舒张功能[4-5]。由于HFpEF的上述特殊性,目前缺乏公认的、能代表HFpEF临床特点的动物模型。
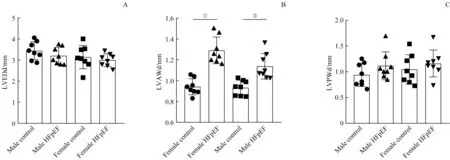
图2 HFpEF小鼠造模后第16周的左心室重构情况Fig 2 Left ventricular remodeling in the HFpEF mice at 16 weeks after modeling
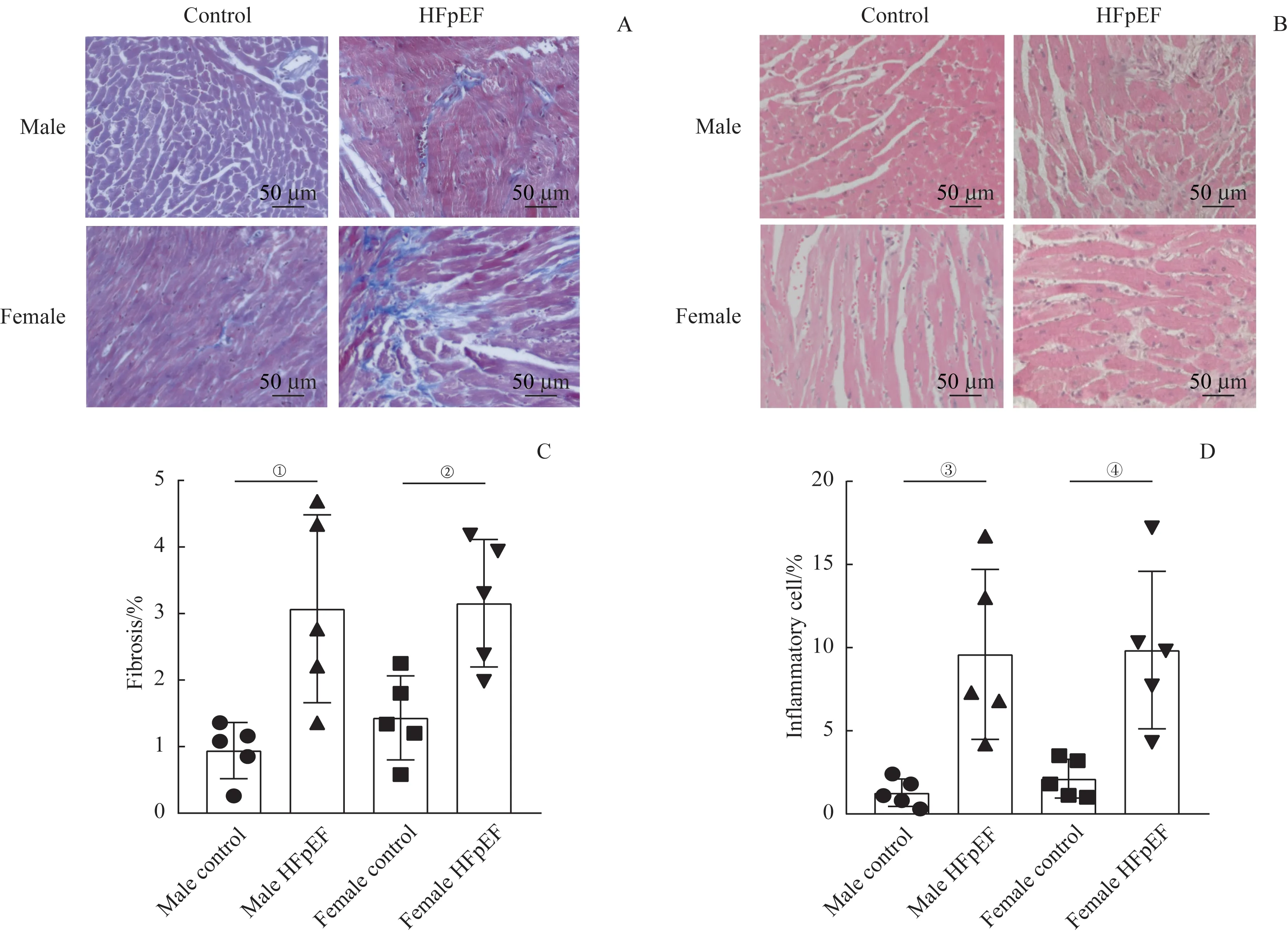
图3 HFpEF小鼠造模后第16周后心肌组织的病理组织学变化Fig 3 Pathological characteristics in cardiomyocytes of the HFpEF mice at 16 weeks after modeling
HFpEF研究中常用的动物模型主要有压力负荷型模型、缺血型模型和复合型模型。压力负荷型HFpEF模型主要通过主动脉缩窄手术、自发性高血压大鼠诱导、继发性高血压大鼠模型或盐敏感型大鼠诱导,使心脏后负荷增加,心肌细胞肥大、纤维化,导致心肌细胞舒张功能降低[6-8]。缺血型HFpEF模型主要通过冠状动脉外慢性收缩、冠状动脉内慢性狭窄和药物等方法造成心肌慢性缺血,模拟慢性心肌缺血引起的HFpEF[9-11]。复合型HFpEF模型则综合了高血压、血脂异常、糖尿病等多种病理机制。由于HFpEF往往和多种临床并发症并存,这种复合型模型更能模拟HFpEF的临床病理特点[12-13]。虽然,不同类型的HFpEF模型具有不同的发病机制和研究针对性,但是复合模型联合了2种以上临床因素,更贴近HFpEF的临床特征,可能更具有代表性和普适性,是HFpEF模型的主要发展方向。
本研究的HFpEF模型属于复合型,主要联合了LNAME和含60%脂肪的高脂饲料,诱导小鼠出现高血压、高血脂等症状,从而诱发HFpEF形成。已有研究[14]表明高糖和高脂饮食会对小鼠的心脏收缩和舒张功能产生损害,与心血管疾病的发生相关。L-NAME是一氧化氮合酶竞争性抑制剂,阻碍内皮舒张因子一氧化氮生成,是诱导高血压动物模型的经典药物。L-NAME采用腹腔内注射或溶于饮水中饲喂均可使实验动物血压升高,同时会伴有心脏指数、小动脉管径、心肌细胞直径、管壁厚度的明显改变[15-16]。我们将L-NAME(0.5 g/L)溶于饮水中,采用饲喂法,使小鼠稳定地受到刺激,保持血压持续稳定升高,同时结合高脂饲料饲喂造模。小鼠无论性别,均可在造模后第8周时出现左心室舒张功能降低;多普勒超声心动图示E/A比值、E/E′比值明显升高,且LVEF无明显变化。造模后第16周时,左心室舒张功能进一步降低,且出现了明显的左心室室壁肥厚、心肌细胞肥大和心肌间质纤维化,但未见LVEF和LVEDd明显变化。本模型不仅模拟了高血压、高血脂的疾病状况,而且成模时间为第8周,可稳定持续至第16周,基本符合高龄这一临床特点。除了病因模拟,第16周时小动物心脏超声和病理组织学结果均证实了左心室舒张功能障碍和心室重构的特点,且左心室收缩功能和LVEDd无明显变化,进一步证实了本模型的可靠性、稳定性和可持续性。
应用L-NAME和高脂双重刺激诱导HFpEF的造模过程中,雄性和雌性小鼠的成模时间趋势基本一致,但是,雄性和雌性小鼠对L-NAME和高脂的双重刺激的反应,具有一定的性别差异。雄性C57BL/6J小鼠高脂饮食后可引起快速的体质量增加,雌性C57BL/6J小鼠的体质量增加缓慢,不易产生明显的肥胖。血压方面,雌性模型组的DBP明显高于雄性模型组。这些提示在HFpEF的发生过程中,雄性和雌性的致病驱动因素可能存在着一定的性别差别。这一现象有助于研究者根据研究目的和侧重点不同,有针对性地选择雌性或雄性小鼠进行造模。
有学者[12]应用高脂饲料喂养自发高血压大鼠构建高血压和高血脂HFpEF大鼠模型,但该模型成模时间至少23周,历时较长,造模费用偏高。在高血压模型的基础上尾静脉注射链脲佐霉素(streptozocin,STZ),建立高血压糖尿病模型,或者高糖高脂饲料联合STZ注射,建立高血糖高血脂模型,均可产生HFpEF的病理特点[13-14]。但是上述2种模型HFpEF持续时间较短,易出现左心室扩大和射血分数降低,若用于HFpEF方面的研究,必须严格把握造模的条件和时间。
综上所述,采用高脂饮食和L-NAME双重干预的方法,可以在雄性和雌性小鼠中成功诱导HFpEF。模型稳定持续时间长,在研究HFpEF或者左心室舒张功能障碍方面具有良好的应用前景;而且雄性和雌性小鼠的HFpEF成模特点具有性别差异,有助于学者们根据研究目的和方向有针对性地进行模型选择。
参·考·文·献
[1]Writing committee members,ACC/AHA task force members.2016 ACC/AHA/HFSA Focused Update on New Pharmacological Therapy for Heart Failure:an update of the 2013 ACCF/AHA guideline for the management of heart failure.A report of the American College of Cardiology/American Heart Association task force on clinical practice guidelines and the Heart Failure Society of America[J].Circulation,2016,134(13):e282-e293.
[2]Ponikowski P,Voors AA,Anker SD,et al.2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure:the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology(ESC).Developed with the special contribution of the Heart Failure Association(HFA)of the ESC[J].Eur Heart J,2016,37(27):2129-2200.
[3]Dunlay SM,Roger VL,Redfield MM.Epidemiology of heart failure with preserved ejection fraction[J].Nat Rev Cardiol,2017,14(10):591-602.
[4]Lam CSP,Voors AA,de Boer RA,et al.Heart failure with preserved ejection fraction:from mechanisms to therapies[J].Eur Heart J,2018,39(30):2780-2792.
[5]林昊,潘建安,张俊峰,等.糖尿病、高血压和心房颤动不同治疗方案对射血分数保留心力衰竭发生的影响[J].上海交通大学学报(医学版),2020,40(10):1402-1407.
[6]Doris PA.Genetics of hypertension:an assessment of progress in the spontaneously hypertensive rat[J].Physiol Genomics,2017,49(11):601-617.
[7]Methawasin M,Strom JG,Slater RE,et al.Experimentally increasing the compliance of titin through RNA binding motif-20(RBM20)inhibition improves diastolic function in a mouse model of heart failure with preserved ejection fraction[J].Circulation,2016,134(15):1085-1099.
[8]Primessnig U,Schönleitner P,Höll A,et al.Novel pathomechanisms of cardiomyocyte dysfunction in a model of heart failure with preserved ejection fraction[J].Eur J Heart Fail,2016,18(8):987-997.
[9]Chilian WM,Mass HJ,Williams SE,et al.Microvascular occlusions promote coronary collateral growth[J].Am J Physiol,1990,258(4 Pt 2):H1103-H1111.
[10]傅发源,陈良龙.一种新的大鼠冠状动脉微栓塞模型[J].中国心血管病研究杂志,2004(4):296-299.
[11]沈成兴,梁春,陈良龙,等.经冠状动脉内注射月桂酸钠构建大鼠冠状动脉微栓塞模型[J].中国动脉硬化杂志,2005,13(4):447-450.
[12]赵胜楠,何黎黎,李自强,等.高血压合并高脂血症大鼠模型的实验研究[J].中国比较医学杂志,2018,28(2):33-39,89.
[13]Trachanas K,Sideris S,Aggeli C,et al.Diabetic cardiomyopathy:from pathophysiology to treatment[J].Hellenic J Cardiol,2014,55(5):411-421.
[14]Carbone S,Mauro AG,Mezzaroma E,et al.A high-sugar and high-fat diet impairs cardiac systolic and diastolic function in mice[J].Int J Cardiol,2015,198:66-69.
[15]Ocsan RJ,Lai YN,Prabhu KV,et al.Chronic NG-nitro-l-arginine methyl ester(L-NAME)administration in C57BL/6J mice induces a sustained decrease in c-kit positive cells during development of cardiac hypertrophy[J].J Physiol Pharmacol,2013,64(6):727-736.
[16]KopincováJ,PúzserováA,BernátováI.L-NAME in the cardiovascular system:nitric oxide synthase activator?[J].Pharmacol Rep,2012,64(3):511-520.

