细胞穿透肽Penetratin修饰的眼用脂质体的构建与体外评价
徐楠,张姝月,丁雪鹰
上海交通大学附属第一人民医院临床药学科,上海200080
眼内新生血管性疾病主要位于眼后段,如年龄相关性黄斑变性(age-related macular degeneration,AMD)和糖尿病视网膜病变(diabetic retinopathy,DR),被认为是导致不可逆视力丧失和失明的主要原因[1]。临床治疗眼底新生血管的主要方式是玻璃体腔注射生物药物,如血管内皮生长因子(vascular endothelial growth factor,VEGF)受体融合蛋白康柏西普(conbercept,Conb)[2]、阿柏西普[3]等,推荐疗程为初始3个月每月给药1次,之后每3个月给药1次。玻璃体腔注射是一种侵入性较强的给药方式,反复注射导致患者依从性差,且容易引发一些眼部并发症,如白内障形成、高眼压、视网膜脱离[4]、玻璃体出血和组织损伤等[5]。因此临床亟需一种安全有效、使用方便、患者依从性高的给药方案治疗眼底新生血管疾病。
现有相关文献[6-8]报道,滴眼给药可作为玻璃体腔注射治疗眼底疾病的替代方案。与小分子药物相比,生物药物分子量大,亲水性强,角膜上皮和泪膜等生物屏障阻碍了药物渗透,导致到达眼底的药物浓度很低。改善滴眼所给药物对眼部屏障的透过性是目前亟需攻克的难题。细胞穿透肽(cell-penetrating peptide,CPP)是由几个或十几个氨基酸残基组成的多肽,具有将多种大分子物质递送入细胞的能力,如树枝状聚合物[9]、脂质体(liposome)[10]、胶束[11]和蛋白质[12]等。Penetratin是一种源于果蝇触角基因同源结构域的CPP,可通过滴眼给药到达眼后部视网膜,其角膜穿透能力是对照肽的87.5倍,是其他CPP的16~31倍[13],在眼部渗透性和生物相容性方面表现出优异的性能。
脂质体由包裹在水相周围的磷脂双分子层组成,成分与细胞膜相似,可增强药物的角膜渗透能力。Cheng等[14]研究发现壳聚糖包衣脂质体滴眼液可有效穿透角膜治疗视网膜黄斑水肿,Lai等[15]发现脂质体滴眼给药后可有效改善大鼠光氧化性视网膜损伤。脂质体载药性能优良、生物相容性高、易于表面修饰、临床转化性强,是一种很有前景的眼部药物载体。目前尚未见Penetratin修饰的脂质体(Penetratin-modified liposome,Pen-Lip)滴眼给药治疗眼后部疾病的报道。本研究构建了一种眼用Pen-Lip,并对其理化性质和体外行为进行了表征及评价,以期实现非侵入性治疗眼底新生血管疾病。
1 材料和方法
1.1 主要试剂与仪器
Penetratin[(HS-)CRQIKIWFQNRRMKWKK]购自上海强耀生物科技有限公司,蛋黄卵磷脂(egg phosphatidylcholine,ePC)、胆固醇(cholesterol,chol)、二硬脂酰基磷脂酰乙醇胺-N-马来酰亚胺-聚乙二醇2000(DSPE-PEG2000-Mal)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(DSPE-PEG2000)购自上海艾伟特医药科技有限公司,Conb眼用注射液购自成都康弘药业集团股份有限公司,DMEM/F12培养基、MEM培养基、胎牛血清(fetal bovine serum,FBS)、青霉素-链霉素溶液(双抗)、非必需氨基酸(non-essential amino acidssolution,NEAA)购自美国Gibco公司,人IgG ELISA试剂盒购自武汉伊莱瑞特生物科技股份有限公司,CCK-8试剂盒购自上海翊圣生物科技有限公司。绿色荧光蛋白(green fluorescent protein,GFP)、尼罗红(Nile red,Nr)染料购自北京索莱宝科技有限公司。其他试剂均为分析纯。
旋转蒸发仪购自上海大研仪器有限公司,Zetasizer ZS90型纳米粒度电位仪购自英国Malvern公司,JEM-2010型 透 射 电 子 显 微 镜(transmission electron microscope,TEM)购自日本JEOL公司,低温高速冷冻离心机购自德国Eppendorf公司,DMIL荧光显微镜购自德国Leica公司,激光扫描共聚焦显微镜购自日本Olympus公司,超净工作台购自淀山湖净化设备仪器厂,MS-H-PRO磁力搅拌器购自大龙兴创实验仪器有限公司,MULTISKANMK3酶标仪购自美国Thermo公司。
1.2 细胞株与细胞培养
人源角膜上皮细胞(human corneal epithelial cell,HCEC)购自北京北纳创联生物技术研究院,人视网膜色素上皮细胞(human retinal pigment epithelium,ARPE-19)由上海市第一人民医院孙晓东课题组馈赠。
HCEC在含有15%FBS、1%双抗、1%NEAA的MEM培养基中培养,ARPE-19在含有10%FBS、1%双抗的DMEM/F12培养基中培养,均置于条件为37℃,5%CO2的培养箱中。定期在显微镜下观察细胞生长情况。待细胞生长融合度达80%时进行传代,传至第3~8代时进行细胞实验。
1.3 DSPE-PEG2000-Pen共聚物的合成
DSPE-PEG2000-Pen由DSPE-PEG2000-Mal的马来酰亚胺基团和Penetratin半胱氨酸残基上的巯基通过1,4加成反应所得[16]。将DSPE-PEG2000-Mal和Penetratin溶解于氯仿中,滴加三乙胺作为催化剂,轻轻振摇。该混合溶液在充氮条件下于室温避光反应24 h,然后进行过滤,所得滤液通过旋转蒸发仪进行蒸发得到固体结晶。固体结晶用氯仿重新溶解后过滤,再次通过旋转蒸发仪蒸发进行纯化操作。产物于-20℃下储存直至使用。合成原理如图1所示,碱催化剂夺取半胱氨酸巯基上的活泼氢,硫负离子进攻β不饱和酮的β位,经1,4共轭加成和酮式烯醇式互变异构过程,定量地生成C-S-C偶联产物。
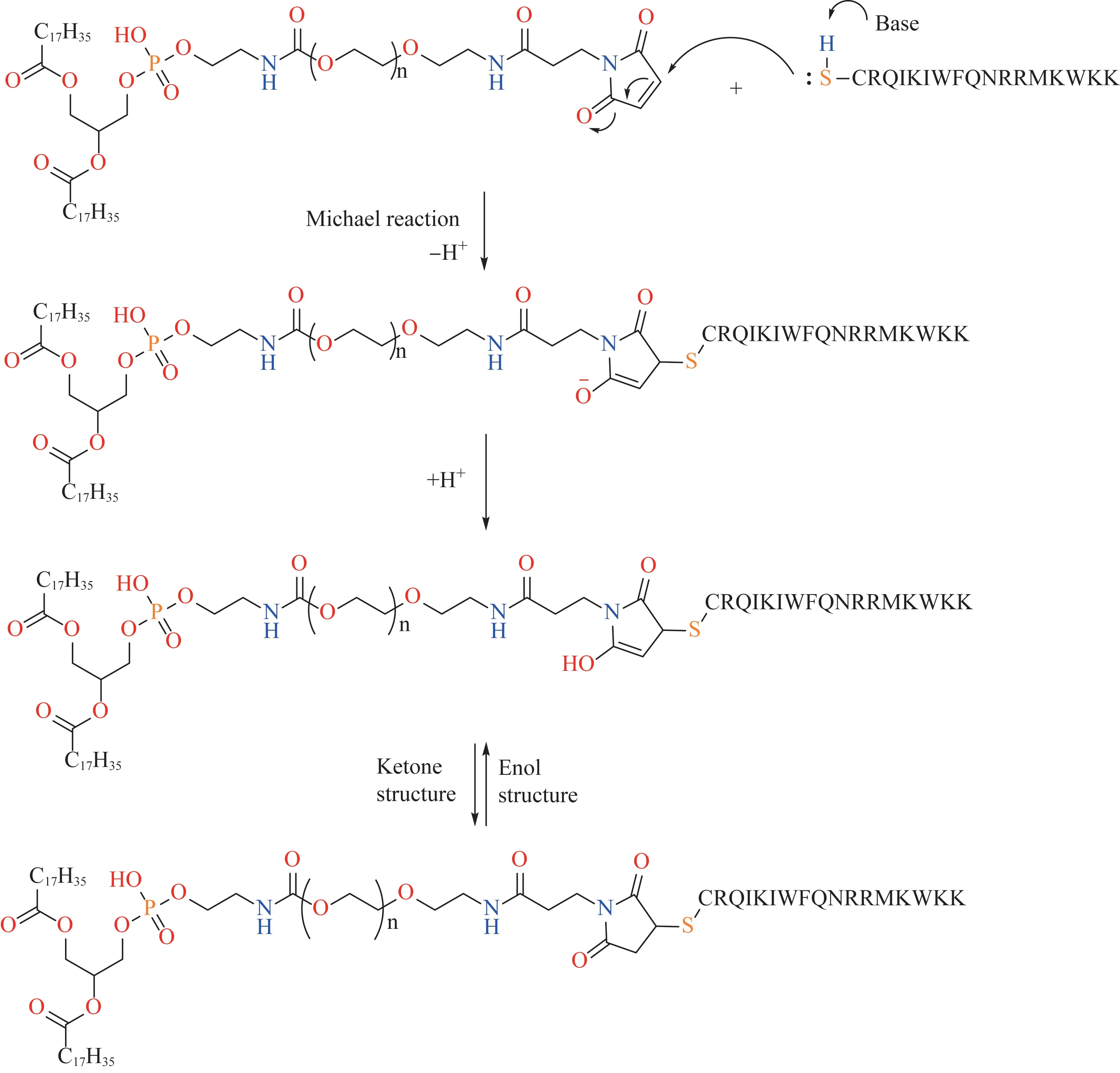
图1 DSPE-PEG2000-Pen共聚物的合成示意图Fig 1 Schematic diagram of synthesis of copolymer DSPE-PEG2000-Pen
1.4 脂质体的制备
空白脂质体(Lip)通过薄膜分散法制备[17]。称取10.0 mg ePC、2.5 mg Chol、3.0 mg DSPE-PEG2000溶解于装有二氯甲烷和甲醇(体积比为2∶1)混合溶液的试管里,并转移至茄型瓶中;使用旋转蒸发仪在35℃条件下进行减压蒸发除去有机溶剂,瓶壁上可形成一层均匀的脂质薄膜;继续真空干燥2 h除去残余的有机溶剂。将10 mL PBS溶液(0.1 mmol/L,pH 7.4)加入茄型瓶中,快速振荡,使PBS溶液与脂质薄膜发生水合作用;然后在冰上进行水浴超声使脂质薄膜从瓶壁上完全脱落,继续避光搅拌1h;得到的乳白色液体先后通过0.45μm、0.22μm微孔滤膜进行过滤,重复3次后获得粒径合适的Lip,4℃避光保存备用。
Pen-Lip制备方法同上,区别在于将DSPE-PEG2000替换 为DSPE-PEG2000-Pen。Lip/GFP、Pen-Lip/GFP、Lip/Conb、Pen-Lip/Conb的制备方法同上,区别在于将水合介质PBS溶液替换为含GFP或Conb的PBS溶液。Nr标记的脂质体制备方法同上,在旋转蒸发之前加入适量Nr于有机试剂中,重复后续步骤即得到Lip/Nr、Pen-Lip/Nr。上述脂质体制备完成后均于4℃避光保存备用。
1.5 Penetratin修饰比例的确定
通过细胞摄取实验来确定修饰脂质体的最佳Penetratin修饰比例[18]。将HCEC按2×105/孔的密度接种于12孔细胞培养板中,在培养箱中培养24 h后用PBS润洗2遍,将1%、3%、5%Pen(DSPE-PEG2000-Pen浓度分别1%、3%、5%)修饰的Pen-Lip/Nr溶液加入12孔板中。细胞与Pen-Lip/Nr孵育4 h后,用含1 000 IU/mL肝素的PBS于冰上洗涤3次,去除细胞外结合的Pen-Lip/Nr,将细胞浸泡在每孔1 mL的PBS中,并立即使用倒置荧光显微镜系统观察细胞对于Pen-Lip/Nr的摄取情况。用Image J软件对平均荧光强度进行半定量分析。
1.6 脂质体的表征检测
取100μL新鲜制备的Lip、Pen-Lip溶液,稀释10倍后放入测量池中,用动态光散射粒径分析仪分析测定平均粒径、Zeta电位和多分散系数(polydispersity index,PDI)。
用TEM观察Pen-Lip的形态。镊子小心夹着覆有碳支持膜的铜网,用吸管吸取新鲜制备的Pen-Lip溶液,滴1滴样品至铜网上;滴液后静置数分钟,无残留液体时滴加负染色液进行染色;吸去多余染料,待铜网自然干燥后即可置入电镜中观察,设加速电压为75 kV,观察并拍照。
采用离心法[17]间接测定包封率和载药量。将新鲜制备的Lip/Conb、Pen-Lip/Conb进行离心(4℃,11 250×g,20 min),上清液用0.45μm微孔滤膜过滤,通过ELISA试剂盒来测定上清液中Conb的浓度。根据以下公式计算包封率和载药量:

1.7 稳定性研究
为了考察脂质体在常规条件和生理条件下的稳定性,分别以PBS、含50%FBS的PBS为介质并测定不同时间点Lip、Pen-Lip的粒径大小。将新鲜制备的Lip、Pen-Lip分散在PBS溶液或含50%FBS的PBS溶液中,在预定的时间点(0 h、1 h、2 h、4 h、8 h、24 h、48 h)取样测定脂质体的平均粒径,并在48 h后取样拍摄电镜图。
1.8 细胞毒性考察
采用CCK-8法对Lip、Pen-Lip的细胞毒性进行考察。将HCEC、ARPE-19细胞按5×103/孔的密度接种于96孔细胞培养板中,在培养箱中培养24 h后将Lip、Pen-Lip用无血清培养基稀释成浓度为15、30、60、120、250、500μg/mL的溶液加入96孔板中。孵育24 h后用PBS洗涤3次,加入100μL含10% CCK-8试剂的培养基,放入培养箱中孵育1 h。用酶标仪测定各孔在450 nm处的吸光度值并计算各浓度处理下的细胞存活率。
1.9 细胞对脂质体摄取情况的检测
在24孔板中预先铺上无菌的圆形盖玻片,将ARPE-19细胞按5×104/孔的密度接种在盖玻片上,在培养箱中培养24 h后,换无血清培养液培养过夜。用PBS润洗2遍后,将含有Nr染料、Lip/Nr或Pen-Lip/Nr的无血清培养基加入24孔板中。37℃孵育3 h后,用含1 000 IU/mL肝素的PBS于冰上洗涤3次,去除细胞外结合的Nr染料、Lip/Nr或Pen-Lip/Nr。用预冷的4%多聚甲醛固定30 min,PBS洗涤3次。吸取10μL含DNA结合染料DAPI的抗荧光淬灭封片液滴在载玻片上,小心取出盖玻片,将有细胞的一面贴在滴有封片液的载玻片上,避光放置30 min。使用激光扫描共聚焦显微镜观察细胞对于脂质体的摄取情况。
1.10 离体渗透性和组织毒性检测
使用扩散池装置测定Pen-Lip/GFP通过离体兔角膜的渗透性。扩散孔的内径为10 mm,扩散面积为0.785 cm2。通过耳缘静脉注射致死剂量的戊巴比妥钠处死家兔,摘除眼球,小心地将角膜(连同周围约2 mm宽度的巩膜)从眼球中取出,用PBS轻轻冲洗。将角膜水平放置在供体室与受体室之间,使角膜上皮表面面向供体溶液,用夹子固定。扩散池中的溶液通过循环加热系统预热并保持在34℃,磁力搅拌速度为100 r/min。供体液分别为3 mL GFP、Lip/GFP、Pen-Lip/GFP(GFP浓度为5 mg/mL),受体液为等体积PBS溶液,排尽气泡使角膜组织与受体液充分接触。在4 h内,每隔0.5 h从受体室中吸取100μL样品,然后立即补充等量的PBS。使用酶标仪检测提取样品中GFP的浓度,并使用如下公式计算相应的表观渗透系数Papp(cm/s):
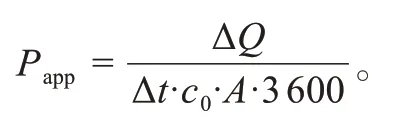
其中ΔQ/Δt是GFP浓度随时间的变化,由渗透曲线线性部分的斜率表示;c0表示GFP的初始浓度;A表示扩散装置的扩散面积;3 600为换算因子。
使用相同装置和方法检测Pen-Lip/Conb对离体角膜的渗透性,供体液分别为3 mL Conb、Lip/Conb、Pen-Lip/Conb(Conb浓度均为1 mg/mL),受体液为等体积PBS溶液,用ELISA试剂盒检测提取样品中Conb的浓度。在渗透性实验后通过角膜水合值(hydration value,ΔH)初步评价脂质体对角膜组织的毒性。从扩散装置中取出角膜,将周围的巩膜组织去除,精确称量每个角膜组织,质量记为m0,在65℃下烘干48 h后再次称量,质量记为m1,并按照如下公式计算水合值:
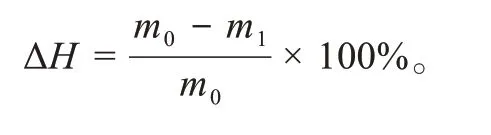
1.11 统计学分析
使用GraphPad Prism 7进行统计学分析。定量资料用x±s表示,组间比较采用单因素方差分析。P<0.05认为差异具有统计学意义。
2 结果
2.1 Penetratin修饰的最佳比例
为了确定脂质体修饰所需的最佳Penetratin比例,通过细胞摄取实验评估了不同比例Penetratin修饰的脂质体被细胞摄取效率,用平均荧光强度大小来表示摄取效率高低。如图2所示,3组的平均荧光强度分别为27.57±1.28、35.53±1.12、27.34±0.77,当用3%Pen修 饰脂质体时,平均荧光强度最高,与1%Pen、5%Pen修饰组差异有统计学意义(均P=0.000),表明该比例修饰组被细胞摄取效率最高。后续制备时均使用3%Pen修饰脂质体。
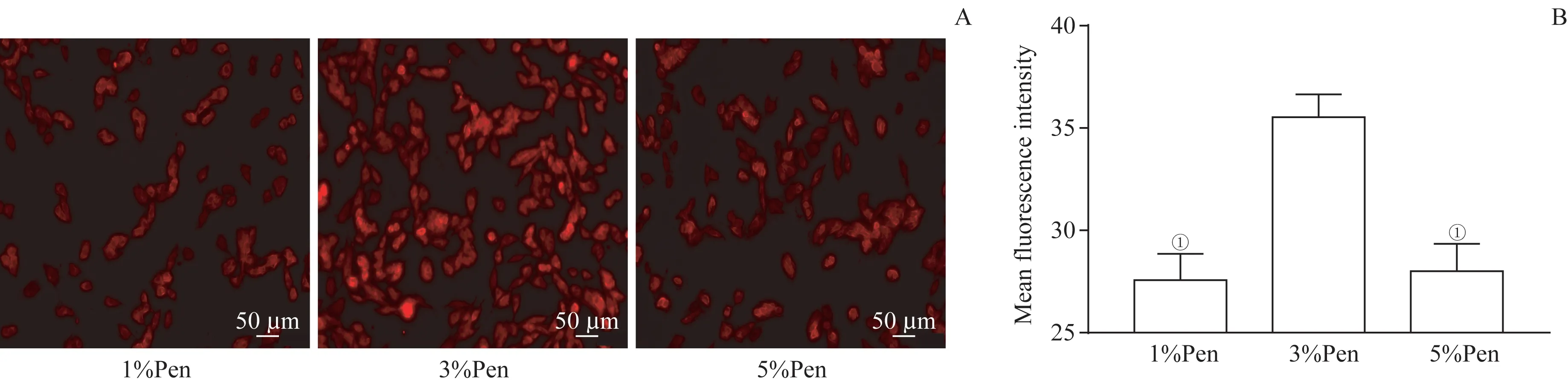
图2不同比例Penetratin修饰脂质体被细胞摄取情况的比较Fig 2 Comparison of cellular uptake of different proportions of Penetratin modified liposomes
2.2 脂质体的表征
Lip的平均粒径为(143.87±2.49)nm,PDI为0.241±0.021;Pen-Lip的平均粒径为(148.07±3.51)nm,PDI为0.227±0.045,呈正态均匀分布(图3A)。表明Lip表面修饰Penetratin对粒径大小没有显著影响,脂质体颗粒分散性良好。Lip和Pen-Lip的Zeta电位分别为-(3.17±0.55)mV和(5.66±0.91)mV。未修饰时Lip的Zeta电位为负值,对Lip进行表面修饰后,由于Penetratin带正电荷,Pen-Lip的Zeta电位变为正值。TEM拍摄结果如图3B所示,可以看出Pen-Lip呈外表光滑的球形结构。通过ELISA检测得到Lip的包封率为(40.47±3.46)%,载药量为(2.61±0.22)%;Pen-Lip的包封率为(44.06±3.70)%,载药量为(2.84±0.24)%,修饰前后包封率和载药量差异无统计学意义(P>0.05)。
2.3 脂质体的稳定性
图4A是不同时间点的脂质体粒径大小,可以看出Lip和Pen-Lip在PBS和含50%FBS的PBS溶液中静置48 h后,平均粒径变化不大,基本维持其原本粒径大小,TEM结果(图4B,C)显示Lip、Pen-Lip静置48 h后分散均匀,没有发生聚集,稳定性较好。
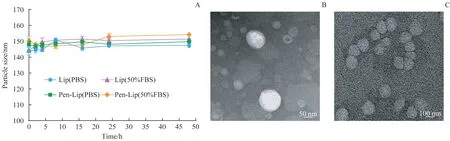
图4 Lip和Pen-Lip的稳定性Fig 4 Stability of Lip and Pen-Lip
2.4 脂质体的细胞毒性
使用角膜上皮细胞HCEC和人视网膜色素上皮细胞ARPE-19考察了Lip、Pen-Lip对细胞的毒性作用。图5A表示的是不同浓度的Lip、Pen-Lip处理之后的HCEC的存活率;图5B表示的是不同浓度的Lip、Pen-Lip处理之后的ARPE-19细胞的存活率。Lip、Pen-Lip浓度在15μg/mL和500μg/mL范围内时,角膜细胞和视网膜细胞均有90%以上的细胞存活率,2种细胞的生长未受明显影响;表明Lip、Pen-Lip对角膜细胞和视网膜细胞的毒性均较低,生物相容性较高。
2.5 细胞对脂质体的摄取情况
在ARPE-19细胞分别与Nr染料、Lip/Nr和Pen-Lip/Nr共孵育3 h后,利用激光扫描共聚焦显微镜观察细胞对于脂质体的摄取情况。如图6A所示,各组在ARPE-19细胞中均有荧光分布,Nr染料组仅有微弱的红色荧光,Lip/Nr组有少量的红色荧光,Pen-Lip/Nr组荧光强度最强。用Image J对荧光强度进行半定量分析(图6B),Pen-Lip/Nr组的平均荧光强度分别是Lip/Nr组、Nr染料组的1.7倍和2.6倍,差异均有统计学意义(均P=0.000),表明ARPE-19细胞对Pen-Lip的摄取能力最强。
2.6 对离体角膜的渗透性和组织毒性
如图7A所示,随着渗透时间的增加,Pen-Lip/GFP穿透兔角膜进入下室的荧光强度越强,呈时间依赖性。Pen-Lip/GFP组、Lip/GFP组的表观渗透系数分别是GFP组的5.95和2.19倍(图7B),表明脂质体由于其类似于细胞膜的磷脂双分子层结构,可以改善药物的角膜穿透能力。如图7C所示,Conb、Lip/Conb、Pen-Lip/Conb透过兔角膜4 h后,ELISA检测到下室中Conb累积量分别为(20.4±3.1)、(42.0±5.0)、(118.9±12.5)μg/mL,Pen-Lip/Conb组的药物累积量分别是Conb组、Lip/Conb组的5.83倍和2.83倍(均P=0.000),表明Penetratin的修饰可以显著提高药物的角膜透过能力。经Conb、Lip/Conb、Pen-Lip/Conb处理的兔角膜的水合值与未处理对照组差异均无统计学意义,表明在本研究使用的浓度范围内未观察到脂质体的体外组织毒性(图7D)。

图6 ARPE-19细胞对Nr染料、Lip/Nr和Pen-Lip/Nr的摄取情况比较Fig 6 Comparison of uptake of Nr,Lip/Nr and Pen-Lip/Nr by ARPE-19 cells

图7载药Lip和Pen-Lip对离体兔角膜的渗透性和组织毒性检测Fig 7 Detection of permeability and tissue toxicity of drug-loaded Lip and Pen-Lip on rabbit corneas in vitro
3 讨论
Conb是临床上常用的治疗眼底新生血管疾病的生物药物,是一种大分子蛋白类药物,容易受到酸碱度、温度以及有机溶剂的影响而失活。本研究选用较温和的薄膜分散法制备载药脂质体,在冰上进行水浴超声减小粒径,减小超声时温度升高对药物活性的影响。用聚乙二醇对脂质体表面进行修饰是一项在肿瘤纳米给药系统广泛使用的技术,可以延长脂质体的循环时间,但在眼部给药方面对该技术的研究较少。当DSPE-PEG2000占总脂质材料的摩尔比为5%~7%时,脂质体表面的聚乙二醇呈刷子状[19],可在空间上减少脂质体与玻璃体成分之间的静电相互作用,提高脂质体的稳定性,增加脂质体在玻璃体腔的迁移率,使其能够到达视网膜区域[20]。因此本研究在制备脂质体的过程中加入了5%摩尔比的DSPEPEG2000,稳定性检测结果表明脂质体在48 h内粒径变化很小,没有发生明显聚集,稳定性较好。
眼表局部给药时,角膜是药物吸收进入眼内的主要屏障,脂质体具有亲脂亲水性,能增强药物的角膜穿透能力,可作为滴眼给药治疗眼后段疾病的载体。有研究[7]利用多糖的生物黏附性将壳聚糖涂覆在脂质体表面,延长脂质体在眼表的滞留时间并提高药物向眼后段的渗透性,但脂质体覆盖壳聚糖涂层之后进入眼后段的荧光蛋白仅约为未修饰脂质体的1.5倍。膜联蛋白A5是一种钙依赖性磷脂结合蛋白,Davis等[21]将其连接在脂质体表面,增强脂质体穿透角膜上皮屏障的能力,然而膜联蛋白A5修饰的脂质体仅比未修饰脂质体提升了不到2倍的穿透效果。本研究结果显示Penetratin修饰脂质体后,角膜穿透能力与Lip相比提升了近3倍,较壳聚糖、膜联蛋白A5等眼部促渗剂具有更好的促进角膜穿透作用。
Penetratin是一种多肽。与一些通过损害角膜完整性而起作用的化学渗透促进剂相比,多肽生物相容性高,适用于眼部给药。本研究采用Penetratin修饰脂质体,结果显示Pen-Lip生物相容性好,组织毒性低,是一种安全的眼部药物载体。
本研究构建了Pen-Lip用于眼部给药,初步结果显示Pen-Lip可被视网膜色素上皮细胞摄取,具有有效的离体兔角膜穿透能力,有望作为一种安全、有效的能透过角膜屏障作用于眼底的给药系统,实现通过局部滴眼给药治疗眼底新生血管疾病。在后续的工作中,我们将进一步研究Pen-Lip抗眼底新生血管疾病的作用效果。
参·考·文·献
[1]Campochiaro PA.Ocular neovascularization[J].J Mol Med(Berl),2013,91(3):311-321.
[2]Li X,Xu G,Wang Y,et al.Safety and efficacy of conbercept in neovascular age-related macular degeneration.Results from a 12-month randomized phase 2 study:AURORA study[J].Ophthalmology,2014,121(9):1740-1747.
[3]Sivaprasad S,Prevost AT,Vasconcelos JC,et al.Clinical efficacy of intravitreal aflibercept versus panretinal photocoagulation for best corrected visual acuity in patients with proliferative diabetic retinopathy at 52 weeks(CLARITY):a multicentre,single-blinded,randomised,controlled,phase 2b,non-inferiority trial[J].Lancet,2017,389(10085):2193-2203.
[4]Sisk RA,Patel YP,Foster RE,et al.Erosive retinopathy and retinal detachment from depot intravitreal triamcinolone acetonide injection at the end of pars plana vitrectomy[J].Ophthalmic Surg Lasers Imaging Retin,2019,50(10):613-619.
[5]Gross JG,Glassman AR,Jampol LM,et al.Panretinal photocoagulation vs intravitreous ranibizumab for proliferative diabetic retinopathy:a randomized clinical trial[J].JAMA,2015,314(20):2137-2146.
[6]Chen C,Liu K,Xu Y,et al.Anti-angiogenesis through noninvasive to minimally invasive intraocular delivery of the peptide CC12 identified by in vivo-directed evolution[J].Biomaterials,2017,112:218-233.
[7]Li J,Cheng T,Tian Q,et al.A more efficient ocular delivery system of triamcinolone acetonide as eye drop to the posterior segment of the eye[J].Drug Deliv,2019,26(1):188-198.
[8]Jiang K,Hu Y,Gao X,et al.Octopus-like flexible vector for noninvasive intraocular delivery of short interfering nucleic acids[J].Nano Lett,2019,19(9):6410-6417.
[9]Yang X,Wang L,Li L,et al.A novel dendrimer-based complex co-modified with cyclic RGD hexapeptide and penetratin for noninvasive targeting and penetration of the ocular posterior segment[J].Drug Deliv,2019,26(1):989-1001.
[10]Dos Santos Rodrigues B,Kanekiyo T,Singh J.ApoE-2 brain-targeted gene therapy through transferrin and penetratin tagged liposomal nanoparticles[J].Pharm Res,2019,36(11):161.
[11]Shuai Q,Cai Y,Zhao G,et al.Cell-penetrating peptide modified PEG-PLA micelles for efficient PTX delivery[J].Int J Mol Sci,2020,21(5):1856.
[12]de Cogan F,Hill LJ,Lynch A,et al.Topical delivery of anti-VEGF drugs to the ocular posterior segment using cell-penetrating peptides[J].Invest Ophthalmol Vis Sci,2017,58(5):2578-2590.
[13]Liu C,Tai LY,Zhang WJ,et al.Penetratin,a potentially powerful absorption enhancer for noninvasive intraocular drug delivery[J].Mol Pharm,2014,11(4):1218-1227.
[14]Cheng T,Li J,Cheng Y,et al.Triamcinolone acetonide-chitosan coated liposomes efficiently treated retinal edema as eye drops[J].Exp Eye Res,2019,188:107805.
[15]Lai S,Wei Y,Wu Q,et al.Liposomes for effective drug delivery to the ocular posterior chamber[J].J Nanobiotechnology,2019,17(1):64.
[16]Zhang Q,Tang J,Fu L,et al.A pH-responsiveα-helical cell penetrating peptide-mediated liposomal delivery system[J].Biomaterials,2013,34(32):7980-7993.
[17]Liu Y,Lu Z,Mei L,et al.Tandem peptide based on structural modification of poly-arginine for enhancing tumor targeting efficiency and therapeutic effect[J].ACS Appl Mater Interfaces,2017,9(3):2083-2092.
[18]Tai LY,Liu C,Jiang K,et al.A novel penetratin-modified complex for noninvasive intraocular delivery of antisense oligonucleotides[J].Int J Pharm,2017,529(1/2):347-356.
[19]Eriksen AZ,Brewer J,Andresen TL,et al.The diffusion dynamics of PEGylated liposomes in the intact vitreous of the ex vivo porcine eye:a fluorescence correlation spectroscopy and biodistribution study[J].Int J Pharm,2017,522(1-2):90-97.
[20]Garbuzenko O,Barenholz Y,Priev A.Effect of grafted PEG on liposome size and on compressibility and packing of lipid bilayer[J].Chem Phys Lipids,2005,135(2):117-129.
[21]Davis BM,Normando EM,Guo L,et al.Topical delivery of avastin to the posterior segment of the eye in vivo using annexin A5-associated liposomes[J].Small,2014,10(8):1575-1584.

