细胞间黏附分子-1在CD4+T细胞辅助B细胞产生抗体中的作用和临床意义
赵倩,张美玉,季萍,汪佳远,王树军,刘帅#,王颖#
1.上海交通大学医学院附属仁济医院检验科,上海200127;2.上海交通大学医学院上海市免疫学研究所,上海200025
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种由抗体介导的自身免疫性疾病,好发于育龄期女性,临床表现复杂多样,多系统受累[1]。研究[2]显示,B细胞过度活化产生的多种自身抗体可与抗原形成免疫复合物沉积于多组织脏器,是SLE发病的主要机制。由于B细胞的活化及抗体的产生离不开T细胞的协助和参与,因此研究T-B淋巴细胞相互作用的分子机制对于阐明SLE的发病机制具有重要意义。
细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)属于黏附分子中免疫球蛋白超家族,是介导细胞-细胞间黏附的主要黏附分子之一[1]。表达于抗原提呈细胞(antigen-presenting cell,APC)表面的ICAM-1可通过与T细胞表面配体结合增强细胞间的黏附,从而为T细胞表面T细胞抗原受体(T cell receptor,TCR)与APC表面主要组织相容性复合体(major histocompatibility complex,MHC)-抗原肽的相互识别提供前期准备[3-4]。在多种自身免疫性疾病中,CD4+T细胞的异常活化常伴随其表面多种分子的异常高表达,例如类风湿性关节炎[5]、多发性硬化症[6]等疾病的发生均伴随ICAM-1分子表达上调。而这些自身免疫性疾病的发生过程往往伴随有自身抗体的产生。因此,作为一个重要的黏附分子,CD4+T细胞表面的ICAM-1是否参与了T-B淋巴细胞间相互作用以促进B细胞产生抗体,从而造成大量免疫复合物沉积、推动SLE疾病进程,值得研究者们进行更深入的探究。
本研究通过比较ICAM-1在不同人群的CD4+T细胞表面的表达水平,分析其与SLE发生的相关性,初步探讨该分子参与CD4+T-B淋巴细胞相互作用的分子机制及其对抗体产生的影响。
1 对象与方法
1.1 研究对象及其资料收集、SLE患者分组
选取2018年10月—2020年5月在上海交通大学医学院附属仁济医院风湿科门诊/住院的SLE患者50例(SLE组),其诊断标准符合1997年美国风湿病学会(American College of Rheumatology,ACR)修订的SLE诊断标准[7]。选取同一时间段内仁济医院体检中心的健康人60例(健康对照组,即HC组)。纳入标准:①年龄为18~60岁。②既往无基础疾病史。③既往无自身免疫性疾病史。
收集2组对象的年龄、性别、血红蛋白等基本资料,以及SLE组患者的病程、红细胞沉降率(erythrocyte sedimentation rate,ESR)、抗 核 抗 体(antinuclear antibody,ANA)和抗双链DNA(double-stranded DNA,dsDNA)抗体水平、补体C3和C4水平、血清特异性抗体IgG和IgM水平、系统性红斑狼疮疾病活动度指数(systemiclupus erythematosus disease activity index,SLEDAI)等实验室检测指标。同时,依据SLE患者活动度的血清学指标ESR和抗dsDNA,将SLE患者分为轻度活动者、中度活动者及重度活动者。
1.2 主要试剂和仪器
淋巴细胞分离液(Axis Shield,瑞典),RPMI-1640培养基(Merck Millipore,德国),α-CD3/28磁珠(美天旎,德国),抗人CD3-APC-Cy7、抗人CD4-Percp、抗人CD19-PE-Cy7、抗 人ICAM-1-FITC、抗 人CD3-Percpcy5.5(Biolegend,美国),抗人CD3-Percp-cy5.5、抗人CD4-BV510(BD,美国),可溶性ICAM-1(soluble ICAM-1,sICAM-1)细胞因子检测试剂盒(上海森雄科技实业有限公司),人CD4+T细胞和B细胞分选试剂盒(STEMCELL Technologies,加拿大)。
LSR Fortessa流式细胞仪(BD,美国),细胞培养箱(Thermo,美国),无菌超净工作台(Labconco,美国),倒置荧光显微镜(Olympus,日本),低温水平离心机(HITACHI,日本)。
1.3 研究方法
1.3.1外周血单个核细胞分离分别采集2组对象的外周 血3~5 mL,经 乙 二 胺 四 乙 酸(ethylene diamine tetraacetic acid,EDTA)抗凝后,于350×g离心5 min收集血浆,并置于-80℃冰箱保存备用。将去血浆后的血细胞置于离心管内,加入5 mL淋巴细胞分离液,于800×g离心22 min,取中间云雾层样外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)备用。
1.3.2 PBMCs中CD4+T细胞的活化取10例健康人PBMCs(1×106/100μL),按照1(磁珠数)∶4(细胞数)的比例向其中加入α-CD3/28磁珠,混匀后添加至96孔U板,并以完全培养基补充体积至200μL/孔。将刺激活化时间设置为24、48、72 h,于37℃、5%CO2培养箱中行细胞培养,而后收集该3个时间点的细胞及上清液待用。
1.3.3外周血CD4+T细胞表面ICAM-1表达检测将去血浆后的血细胞(“1.3.1”中获得)置于1.5 mL离心管中,向管内加入1 mL红细胞裂解液,于4℃避光孵育10 min,4 000×g离心2 min,弃上清液;加入1 mL磷酸盐缓冲液(phosphate buffer saline,PBS),离心后洗涤2次;加入50μL经PBS稀释后的抗体工作液(含抗人CD3-APC-Cy7、抗人CD4-Percp、抗人CD19-PE-Cy7及抗人ICAM-1-FITC),4℃避光孵育30 min后离心,弃上清液后向每管加入200μL PBS重悬混匀,于BD LSRFortessa流式细胞分析仪上进行检测,采用FlowJo软件对数据进行分析。同样地,针对从“1.3.2”中收集的3个时间点的CD4+T细胞,其表面ICAM-1的表达也采用上述方法进行检测。
1.3.4血清中sICAM-1含量检测按照sICAM-1细胞因子检测试剂盒说明书的操作流程,采用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测18例SLE患者和26例健康人血清以及10例健康人的PBMCs(经α-CD3/28刺激后)培养上清中sICAM-1的含量。
1.3.5 CD4+T细胞-B细胞体外共培养及其分组按照人CD4+T细胞和B细胞分选试剂盒说明书,从5例健康人PBMCs中分选获得B细胞和CD4+T细胞。取2×106/100μL CD4+T细胞,按照1∶1的比例加入α-CD3/28磁珠,以完全培养基补充体积至200μL,而后将其置于37℃、5%CO2环境中培养24 h。分别取经α-CD3/28磁珠刺激和未刺激的CD4+T细胞进行计数,调整细胞浓度为4×105/mL;将分选的B细胞调整细胞浓度为1×106/mL,按照以下方案设置CD4+T-B细胞共培养体系组:①刺激组:经α-CD3/28磁珠刺激的CD4+T细胞50μL+B细胞50μL。②对照组:未经α-CD3/28磁珠刺激的CD4+T细胞50μL+B细胞50μL+同型对照抗体(终浓度为5μg/mL)。③阻断抗体处理组:α-CD3/28磁珠刺激的CD4+T细胞+B细胞50μL+ICAM-1阻断抗体(终浓度为5μg/mL)。每孔补充培养基至200μL,混匀后置于37℃、5%CO2培养箱中培养12 d后,收集上清液待用。
1.3.6上清液中IgG检测按照人IgG检测试剂盒说明书的操作流程检测刺激组、对照组、阻断抗体处理组的细胞培养上清液中IgG的含量。
1.4 统计学方法
使用GraphPad Prism 5.0软件进行数据分析。定量资料经正态分布检验后,符合正态分布的以x±s表示,采用非配对t检验比较;不符合正态分布的以M(Q1,Q3)表示。采用Pearson和Spearman相关系数对SLE患者CD4+T细胞表面ICAM-1表达水平(ICAM-1+CD4+T/%)、sICAM-1含量与外周病理因子(包括ESR、ANA、抗dsDNA抗体、补体C3和C4、血清IgG和IgM、SLEDAI)水平进行相关性分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 研究对象的基本资料、实验室指标及SLE患者分组
2组研究对象的基本资料及SLE患者的实验室检测指标具体见表1。同时,根据ESR、抗dsDNA等指标,将SLE患者分为轻度活动者(ESR为0~30 mm/h、dsDNA为0~30 U/mL)、中度活动者(ESR为31~60 mm/h、dsDNA为31~60 U/mL)及重度活动者(ESR为61~100 mm/h、dsDNA为61~100 U/mL)。
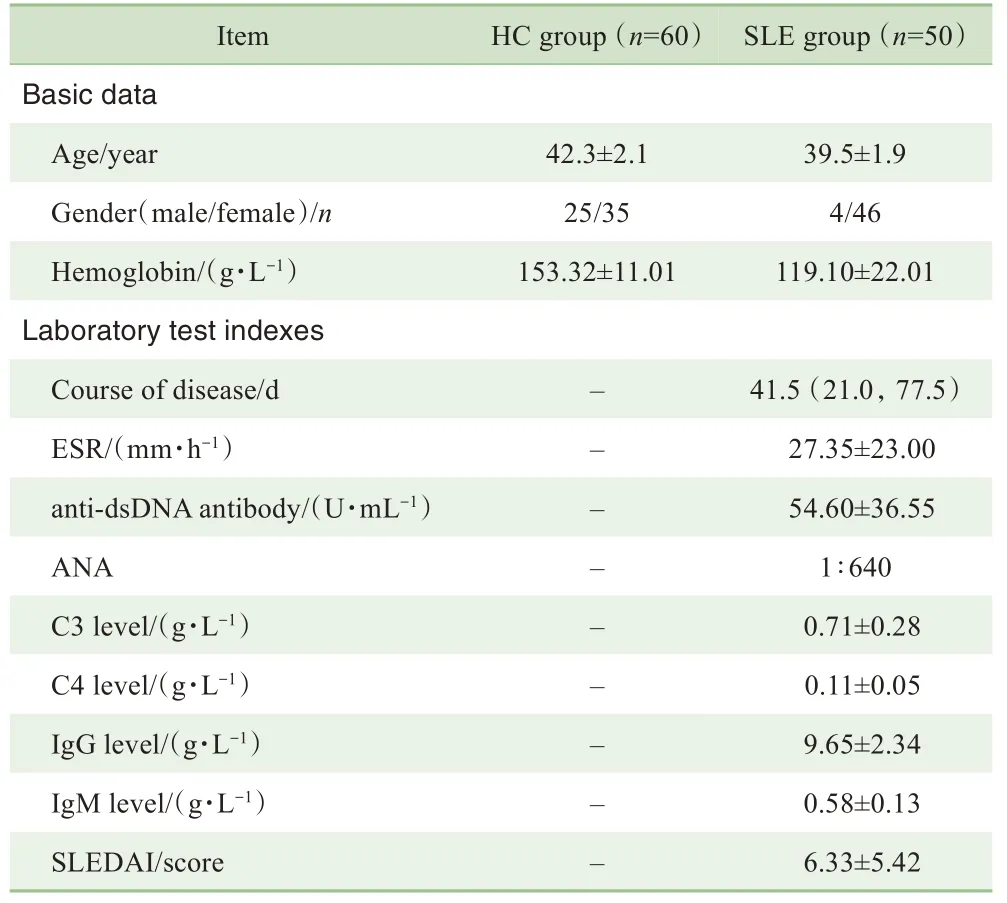
表1 2组对象的基本资料和实验室检测指标Tab 1 Basic data and laboratory test indexes of the two groups
2.2 2组对象的外周血CD4+T细胞表面ICAM-1水平分析
我们首先采用流式细胞术对2组对象的外周血CD4+T细胞表面ICAM-1水平进行检测,结果(图1)显示,与健康人比较,SLE患者外周血CD4+T细胞表面ICAM-1表达水平及ICAM-1在CD4+T细胞表面的平均荧光强度(mean fluorescence intensity,MFI)均 较 高(P=0.034,P=0.001);根据SLE患者的活动度进一步分组后发现,随着疾病活动度的增加,患者外周血CD4+T细胞表面ICAM-1表达水平呈现升高趋势,但3组间差异均无统计学意义。
2.3 SLE患者外周血CD4+T细胞表面ICAM-1表达水平与外周病理因子水平的相关性分析
对SLE患者外周血CD4+T细胞ICAM-1表达水平与外周病理因子水平的相关性进行分析,结果(图2)显示CD4+T细胞ICAM-1表达水平与ESR呈显著正相关(P=0.004,r=0.457),与SLEDAI、血清IgG和IgM含量无明显相关性。
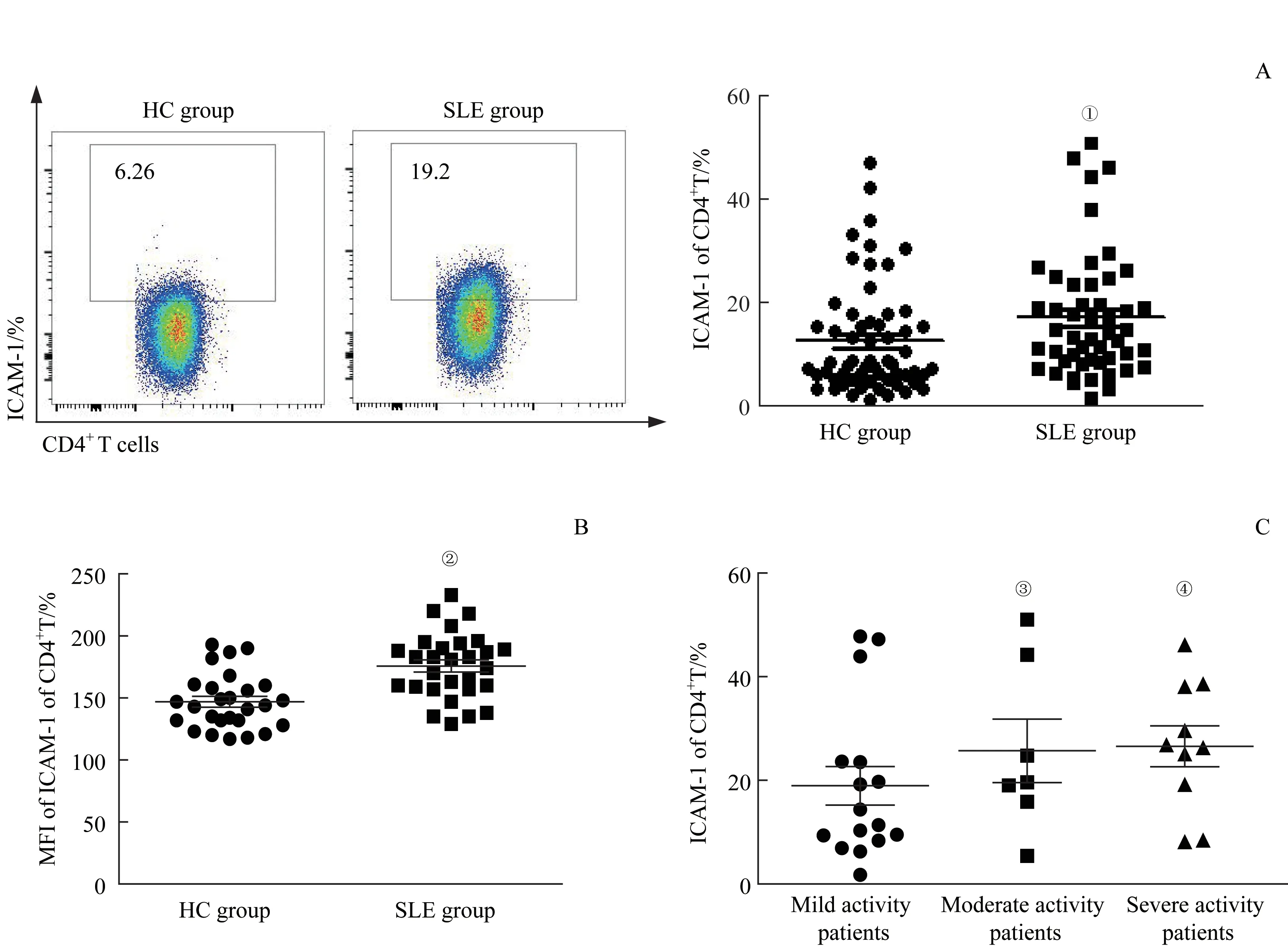
图1 SLE组和HC组外周血CD4+T细胞表面ICAM-1的表达分析Fig 1 Expression of ICAM-1 on peripheral blood CD4+T cells in the SLE group and HC group
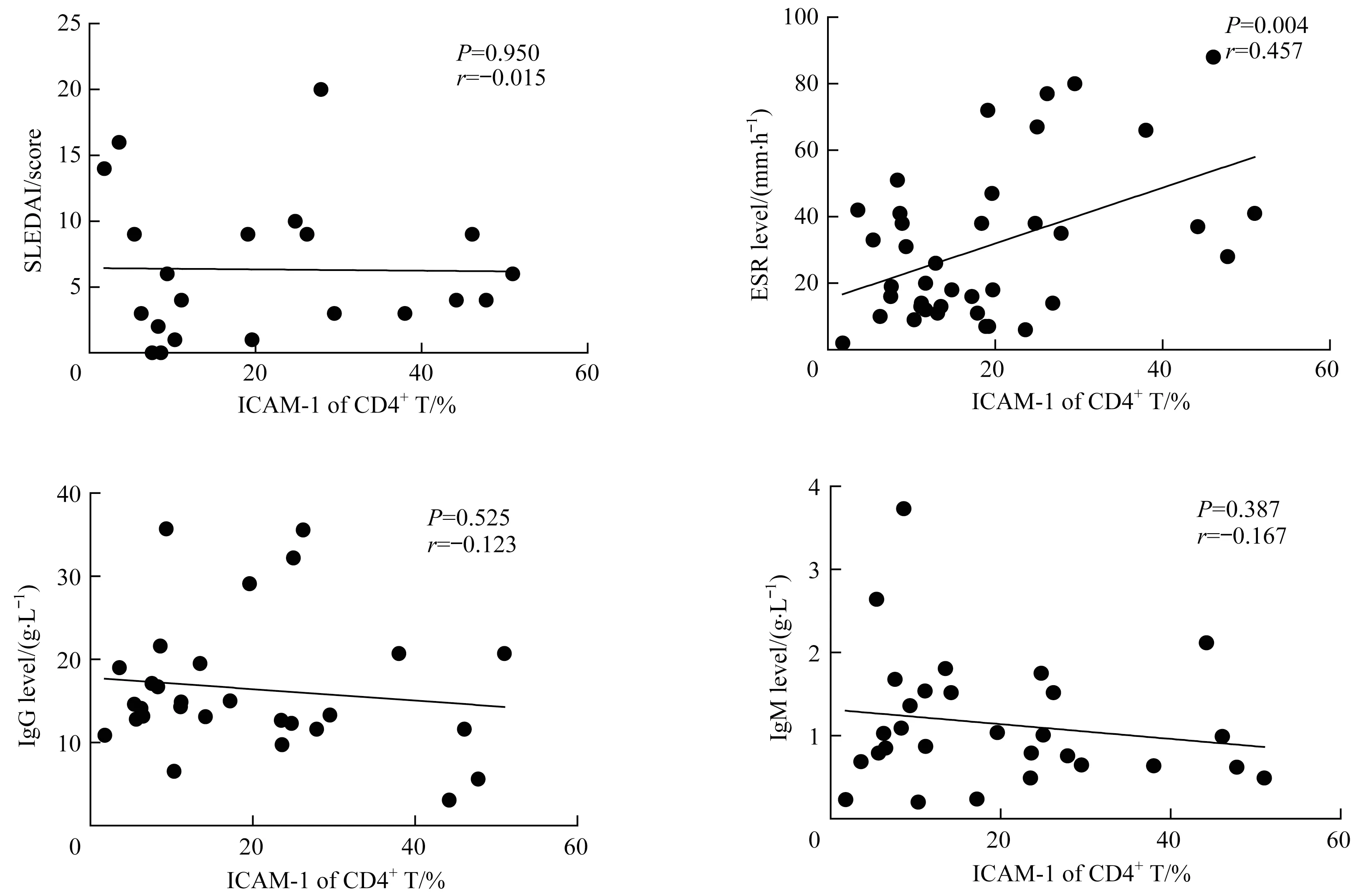
图2 SLE患者外周血CD4+T细胞表面ICAM-1表达水平与外周病理因子水平的相关性分析Fig 2 Correlation between ICAM-1 expression on the surface of CD4+T cells and peripheral pathological factors in SLE patients
2.4 2组对象的血清sICAM-1水平分析
采用ELISA法检测18例SLE患者和26例健康人血清中sICAM-1含量,结果(图3)显示,与健康人比较,SLE患者血清中sICAM-1的平均含量较高(P=0.001);在不同活动度的SLE患者间,血清sICAM-1含量随疾病活动度增加而升高,其中轻度活动者与重度活动者的血清sICAM-1含量间差异具有统计学意义(P=0.039)。
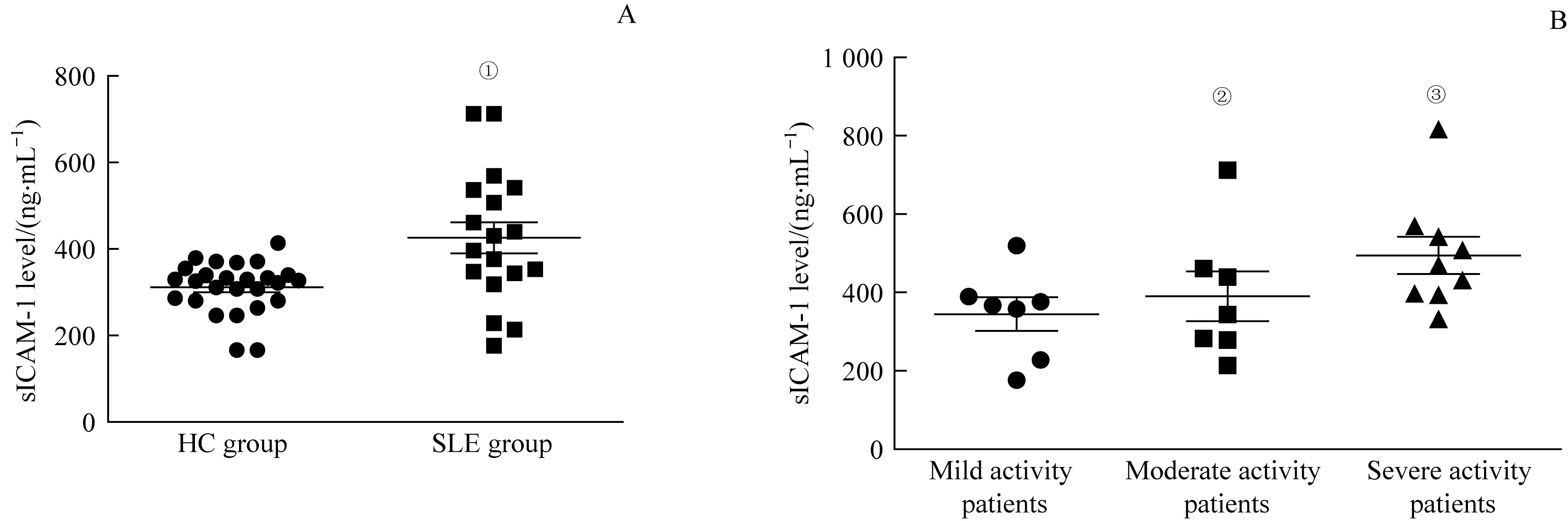
图3 SLE组和HC组血清sICAM-1含量分析Fig 3 Analysis of serum sICAM-1 levels in the SLE group and HC group
2.5 SLE患者血清sICAM-1与病理因子的相关性分析
对SLE患者血清sICAM-1含量与外周病理因子水平的相关性进行分析,结果(图4)显示sICAM-1的含量与抗dsDNA抗体、IgG水平呈正相关(均P<0.05)。
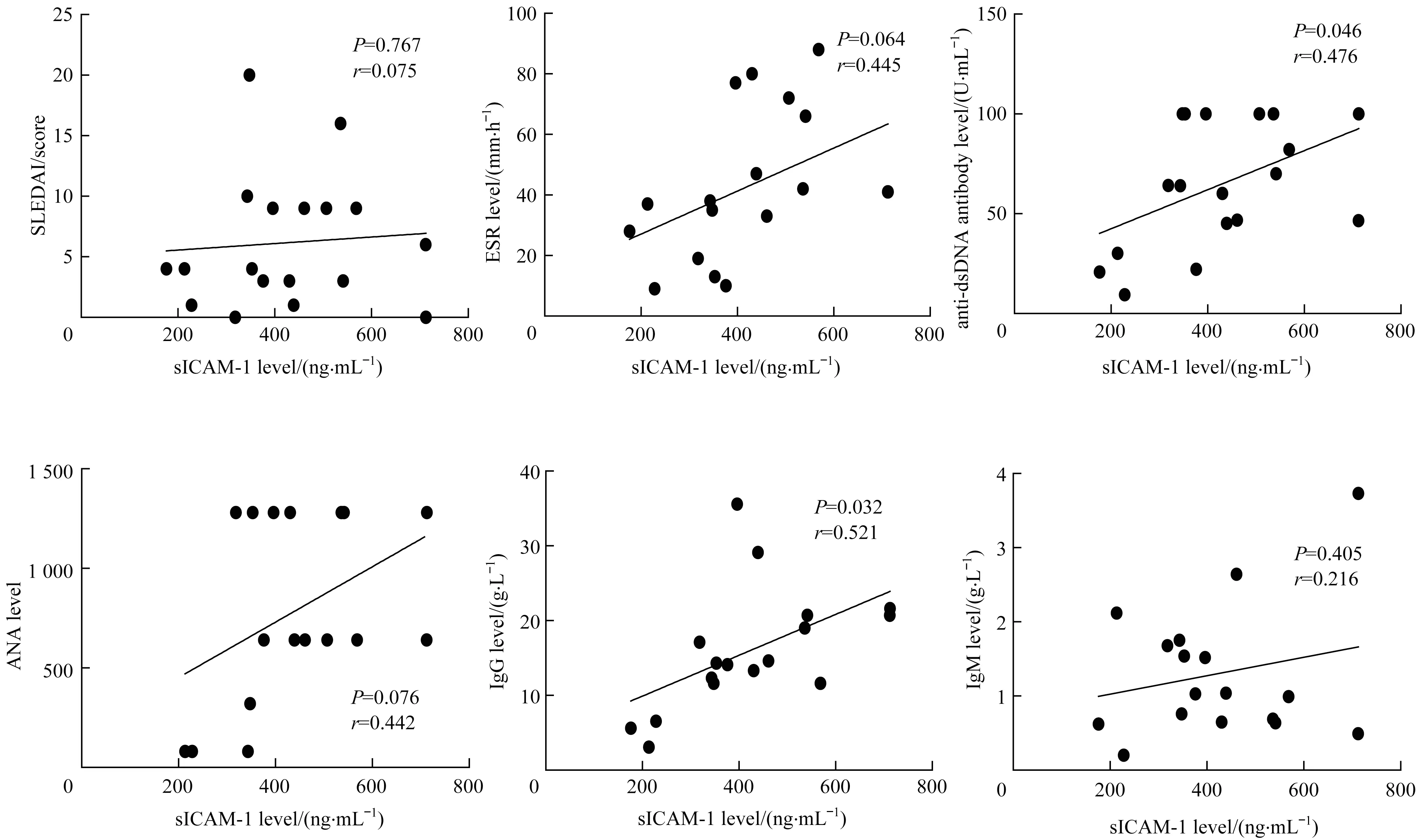
图4 SLE患者血清sICAM-1含量与外周病理因子水平的相关性分析Fig 4 Correlation between serum sICAM-1 level and peripheral pathological factors in SLE patients
2.6 健康人PBMCs中CD4+T细胞活化后ICAM-1及sICAM-1的表达水平
为进一步探讨SLE患者外周ICAM-1的表达升高与CD4+T细胞活化之间的关系,本研究采用α-CD3/28磁珠刺激健康人PBMCs以模拟SLE患者体内CD4+T细胞异常活化的现象,随后通过流式细胞术和ELISA法分别检测CD4+T细胞表面ICAM-1表达水平和上清液中sICAM-1的含量。结果(图5)显示,随着刺激时间的增加,活化的CD4+T细胞表面ICAM-1表达水平逐渐上升,其中刺激48、72 h后ICAM-1的表达百分比高于刺激24 h(P=0.002,P=0.001);同时,上清液中sICAM-1的含量也随着刺激时间的延长呈逐步升高的趋势,且差异具有统计学意义(均P=0.000)。上述结果表明,CD4+T细胞的活化可显著增加细胞表面ICAM-1的表达及sICAM-1水平,与我们在SLE患者中观察到的CD4+T细胞表面ICAM-1表达水平和sICAM-1含量升高相一致。
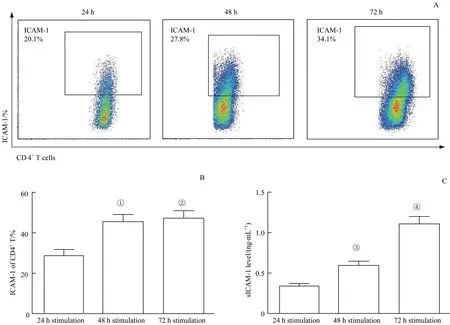
图5不同刺激时间下CD4+T细胞表面ICAM-1的表达水平和培养上清液中sICAM-1的含量Fig 5 Expression of ICAM-1 on the surface of CD4+T cells and the content of sICAM-1 in culture supernatant with different stimulation time
2.7 ICAM-1对活化CD4+T细胞辅助B细胞产生IgG的影响
和本课题组既往研究[8]一致,我们对刺激组、对照组和阻断抗体处理组的细胞培养上清液中的IgG水平进行检测,结果(图6)显示,刺激组上清液中的IgG水平高于对照组(P=0.033),但是加入ICAM-1阻断抗体后,上清液中IgG水平有所下降(P=0.041)。上述结果表明,活化24 h后的CD4+T细胞可以促进B细胞产生抗体,而阻断ICAM-1的表达后则可减弱该促进作用。
3 讨论
SLE作为一种典型的抗体介导的自身免疫病,以T细胞和B细胞的过度活化以及自身抗体的产生为主要发病机制之一。因此,了解T细胞-B细胞间相互作用、B细胞分化机制将为SLE致病机制的阐明和新的干预策略的提出打开局面。本研究结果显示,SLE患者的CD4+T细胞表面ICAM-1的表达水平较高,和健康人CD4+T细胞被活化后的升高相一致;本研究还发现,活化的CD4+T细胞可促进B细胞产生IgG,阻断ICAM-1的表达则可减低IgG的水平。从上述结果我们推测,活化CD4+T细胞或可通过上调ICAM-1的表达以促进B细胞的活化从而导致IgG的分泌增多。
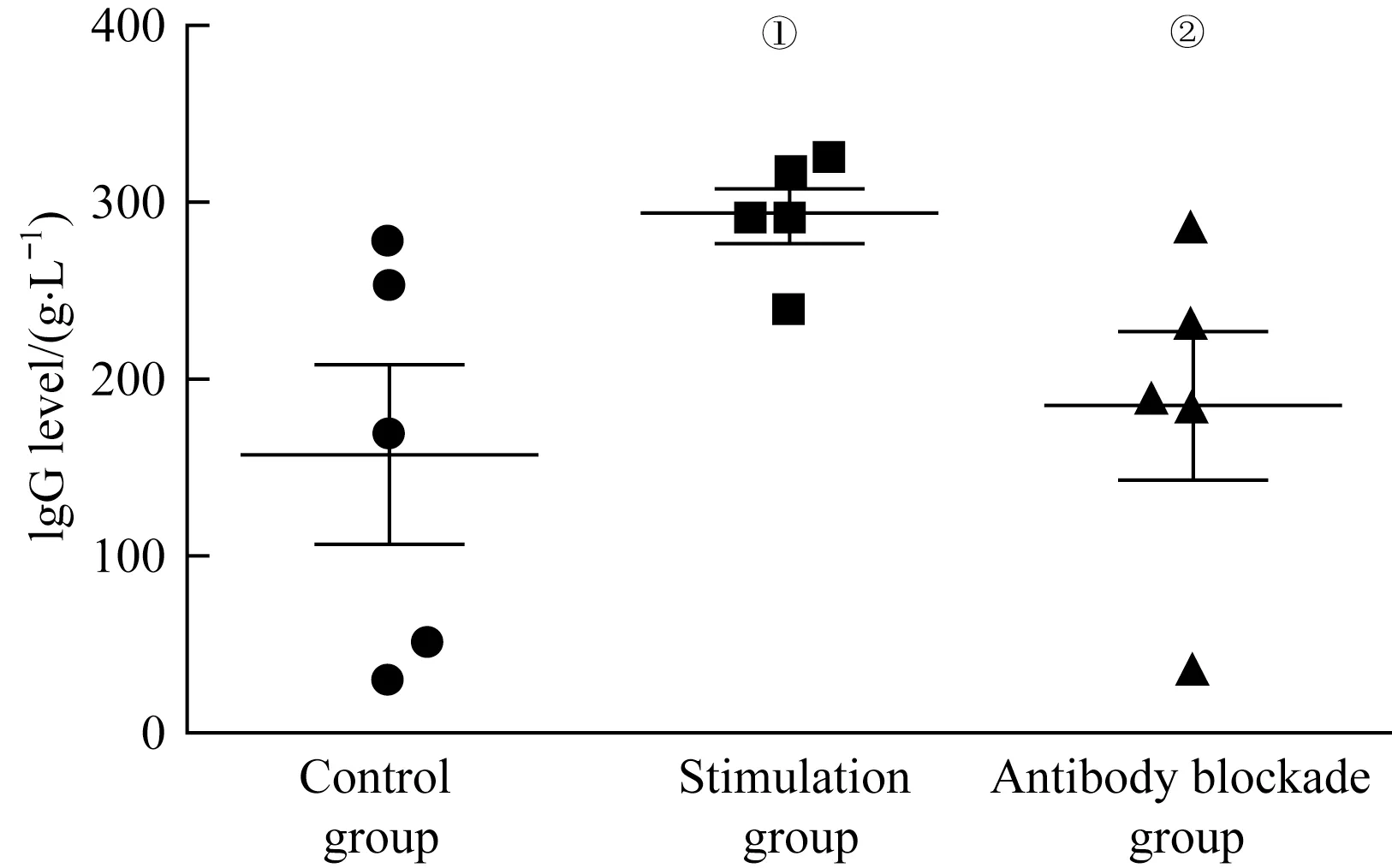
图6 CD4+T细胞-B细胞体外共培养上清液中IgG的表达水平Fig 6 Expression of IgG in the supernatant of CD4+T cells-B cells co-culture in vitro
细胞黏附是介导细胞与细胞之间相互作用的一个重要的生物学行为。介导黏附的黏附分子家族可以参与调节炎症反应[9]、免疫应答[10]及控制肿瘤恶化、转移[4]等多种生理病理过程。研究显示,ICAM-1在APC辅助T细胞的活化及分化[11]、淋巴细胞的伸展和移动[12]中发挥重要作用,如该分子可通过与淋巴细胞功能相关抗原-1(lymphocyte function associated antigen-1,LFA-1)作用增加细胞间的黏附从而促进T细胞的活化[13]。在B细胞的活化过程中,位于生发中心的滤泡辅助性T细胞(follicular helper T cell,Tfh)表面的LFA-1可通过与B细胞表面的ICAM-1相结合,进一步促进B细胞向浆细胞分化[14],继而表明LFA-1-ICAM-1分子可促进T-B细胞的相互作用及抗体的产生。在多种以自身抗体介导的自身免疫性疾病如SLE[15]、天疱疮[16]、桥本氏甲状腺炎[17]中,CD4+T细胞均呈现活化的状态。而我们的研究结果也显示,无论是SLE患者来源的还是健康对照者来源的CD4+T细胞,经过TCR/CD28活化后其表面ICAM-1和sICAM-1的水平均有显著增加;同时,在SLE病理状态下,患者CD4+T细胞表面ICAM-1与反映疾病活动度ESR指标呈显著正相关性,sICAM-1与抗dsDNA抗体、IgG水平亦呈显著的正相关性。由此可见,不同形式的ICAM-1可能都是SLE发病进程中的重要效应分子,而存在于血清中的sICAM-1相较细胞表面的ICAM-1具有更为稳定、便于检测的优势,因此其或将成为评估SLE患者疾病活动度的重要生物标志物。
在本研究中,我们利用CD4+T细胞-B细胞体外共培养系统,模拟CD4+T细胞-B细胞的相互作用。结果显示,体外活化的CD4+T细胞和B细胞共培养12 d后,可明显提高培养上清液中的IgG水平,而加入ICAM-1阻断抗体后,上清液中IgG水平显著下降;继而表明活化的CD4+T细胞表面ICAM-1分子在促进B细胞产生IgG中发挥了重要的作用。来自于小鼠的研究表明,B细胞的活化、分化均依赖于T-B细胞相互作用中的多种分子,如CD40-CD40L[18]、ICOS-ICOSL[19]等。
本研究发现,CD4+T细胞活化后其表面ICAM-1分子表达发生上调,该上调的分子可通过增加CD4+T细胞与B细胞间的相互作用促进B细胞分泌IgG;一旦这种相互作用被阻断,B细胞产生IgG的能力则会显著下降。综合上述结果可推断,在SLE病理条件下,相较于未活化的CD4+T细胞,经过自身抗原识别激活后的CD4+T细胞通过上调其表面ICAM-1分子表达或可获得与B细胞竞争结合优势。然而由于实验的局限性,有关ICAM-1促进T-B细胞间相互作用的确切分子机制仍待进一步研究。
综上,本研究显示ICAM-1可通过增加CD4+T细胞-B细胞间的相互作用,促进抗体IgG的分泌。因此,阻断CD4+T细胞表面ICAM-1分子,或可为寻找SLE治疗的潜在靶点打开新思路。
参·考·文·献
[1]GuoLiu RN,Cheng QY,Zhou HY,et al.Elevated blood and urinary ICAM-1 is a biomarker for systemic lupus erythematosus:a systematic review and meta-analysis[J].Immunol Invest,2020,49(1/2):15-31.
[2]凌燕,孙凌云.黏附分子在系统性红斑狼疮发病机制中的作用[J].中华风湿病学杂志,2000,4(3):186-188.
[3]Hubbard AK,Rothlein R.Intercellular adhesion molecule-1(ICAM-1)expression and cell signaling cascades[J].Free Radic Biol Med,2000,28(9):1379-1386.
[4]Bui TM,Wiesolek HL,Sumagin R.ICAM-1:a master regulator of cellular responses in inflammation,injury resolution,and tumorigenesis[J].J Leukoc Biol,2020,108(3):787-799.
[5]林勇.细胞粘附、影响因素及粘附分子基因表达的调控[D].北京:北京协和医学院,1998.
[6]Sharief MK,Noori MA,Ciardi M,et al.Increased levels of circulating ICAM-1 in serum and cerebrospinal fluid of patients with active multiple sclerosis.Correlation with TNF-αand blood-brain barrier damage[J].J Neuroimmunol,1993,43(1/2):15-21.
[7]Hochberg MC.Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus[J].Arthritis Rheum,1997,40(9):1725.
[8]李玉梅,刘帅,刘芝翠,等.ICAM-1参与系统性红斑狼疮中免疫球蛋白产生的实验研究[J].中国免疫学杂志,2020,36(11):1358-1364.
[9]He P,Srikrishna G,Freeze HH.N-glycosylation deficiency reduces ICAM-1 induction and impairs inflammatory response[J].Glycobiology,2014,24(4):392-398.
[10]Jiang L,Hu JL,Feng JT,et al.Substrate stiffness of endothelial cells directs LFA-1/ICAM-1 interaction:a physical trigger of immune-related diseases?[J].Clin Hemorheol Microcirc,2016,61(4):633-643.
[11]Wingren AG,Parra E,Varga M,et al.T cell activation pathways:B7,LFA-3,and ICAM-1 shape unique T cell profiles[J].Crit Rev Immunol,2017,37(2/3/4/5/6):463-481.
[12]da Rosa Franchi Santos LF,Costa NT,Maes M,et al.Influence of treatments on cell adhesion molecules in patients with systemic lupus erythematosus and rheumatoid arthritis:a review[J].Inflammopharmacology,2020,28(2):363-384.
[13]Song G,Lazar GA,Kortemme T,et al.Rational design of intercellular adhesion molecule-1(ICAM-1)variants for antagonizing integrin lymphocyte function-associated antigen-1-dependent adhesion[J].J Biol Chem,2006,281(8):5042-5049.
[14]Ise W,Fujii K,Shiroguchi K,et al.T follicular helper cell-germinal center B cell interaction strength regulates entry into plasma cell or recycling germinal center cell fate[J].Immunity,2018,48(4):702-715.e4.
[15]Tocut M,Shoenfeld Y,Zandman-Goddard G.Systemic lupus erythematosus:an expert insight into emerging therapy agents in preclinical and early clinical development[J].Expert Opin Investig Drugs,2020,29(10):1151-1162.
[16]Kridin K,Zelber-Sagi S,Comaneshter D,et al.Bipolar disorder associated with another autoimmune disease-pemphigus:a population-based study[J].Can J Psychiatry,2018,63(7):474-480.
[17]Zhao N,Zou HJ,Qin J,et al.MicroRNA-326 contributes to autoimmune thyroiditis by targeting the Ets-1 protein[J].Endocrine,2018,59(1):120-129.
[18]Laman JD,Claassen E,Noelle RJ.Functions of CD40 and its Ligand,gp39(CD40L)[J].Crit Rev Immunol,2017,37(2/3/4/5/6):371-420.
[19]Mittereder N,Kuta E,Bhat G,et al.Loss of immune tolerance is controlled by ICOS in Sle1 mice[J].J Immunol,2016,197(2):491-503.

