儿童银屑病药物治疗meta分析①
陈 畅 徐媛媛 耿 龙(中国医科大学附属第一医院,沈阳110000)
银屑病是一种慢性的、易复发的免疫介导的全身性炎症疾病,约占普通人口的2%[1-3]。儿童和青少年的银屑病患病率约为0~1.37%,每年发病率为57/100 000[4]。患有银屑病的儿童具有更高的共病患病率,包括肥胖、高血压、糖尿病、克罗恩病、恶性肿瘤和精神障碍等疾病[5]。虽然国外已有关于儿童银屑病用药指南的发布,但关于儿童银屑病的治疗用药主要是依靠已发表的病例报告、成人银屑病治疗指南、专家意见和这些药物在其他儿科疾病治疗中的经验[6-10]。在选择特定的治疗方法时,需要考虑多个因素,例如银屑病严重程度、患儿对药物的耐受性及药物的安全性等[11-13]。
目前采用的常规治疗方案是采用局部外用药物治疗轻度银屑病,而对于中重度或难治性银屑病则采用全身用药(如甲氨蝶呤、环孢霉素、维甲酸)和生物制剂(TNF-α抑制剂,如:依那西普、阿达木单抗)进行治疗[11,14-16]。其中,依那西普是一种可溶性TNF-α受体二聚体与人的IgG1 Fc段融合蛋白,具有拮抗内源性肿瘤坏死因子(tumor necrosis factor,TNF)的作用。它是第一个被美国食品药品监督管理局批准用于4岁以上儿童治疗中重度多关节幼年特发性关节炎的生物制剂[17];阿达木单抗是一种抗TNF-α的重组人单克隆抗体,在2015年阿达木单抗获得欧洲药物管理局批准,用于对局部治疗和光疗反应不足的4岁以上儿童和青少年严重慢性斑块型银屑病[18]。甲氨蝶呤、维甲酸、环孢素等药物尚未获得批准用于儿童银屑病,目前都基于临床经验用药,对这一群体的相关随机对照试验较少。本研究通过定量分析评估临床试验的疗效,总结随机临床试验中描述的事件,以评估这些治疗方案在儿童银屑病患者中的风险和获益。通过对中重度银屑病患者治疗相关临床试验数据的分析,为评价不同药物治疗儿童银屑病的疗效和安全性提供参考依据。
1 材料与方法
1.1 文献检索 本研究在CNKI、万方、Pubmed、Embase、Cochrane Library等国内外数据库(截至2019年12月31日)系统检索不同方式治疗儿童银屑病的有效性和安全性的双盲随机对照试验,检索采用主题词与自由词相结合的方式,全文检索策略如下:“儿童银屑病”+“维甲酸/甲氨蝶呤/环孢菌素(或环孢素)/富马酸酯/阿达木单抗/英夫利昔单抗(或英利昔单抗)/依那西普/光疗”。共搜索了1 062篇文献,因重复排除了92篇文献。对标题和摘要浏览之后,排除了947篇文献,阅读了23篇文献全文。最后6篇文献纳入研究,对纳入的研究进行Jadad评分,其中2篇文献得分6分,3篇文献得分5分,1篇文献得分3分,均为高质量研究。具体的文献检索及纳入排除过程见图1。
1.2 文献的纳入与排除标准 纳入标准:①研究类型为随机对照试验研究(randomized controlled trial,RCT);②研究对象为临床诊断的儿童银屑病患者,年龄≤18岁;③治疗组研究药物为关注药物的一种或多种,对照组为治疗组设定药物以外的其他药物。排除标准:①研究类型非RCT;②研究对象非儿童银屑病患者;③治疗组所使用的药物非所关注药物;④无疗效评价指标;⑤重复发表的文献;⑥综述、会议摘要、评述、书籍、指南;⑦非中英文的文献。
1.3 数据处理 对于每篇文献,采用Cochrane偏移风险评估工具对文献质量进行评价(图2、3),并由两位研究人员同时独立进行数据提取。提取的信息为:第一作者、组别、纳入患者例数、治疗药物、剂量、性别、年龄(岁)、病程(年)、体表受累面积(BSA,%)与严重程度指数(PASI)评分,纳入文献的基本特征见表1。

图1 纳入文献流程图Fig.1 Flow chart of included literature
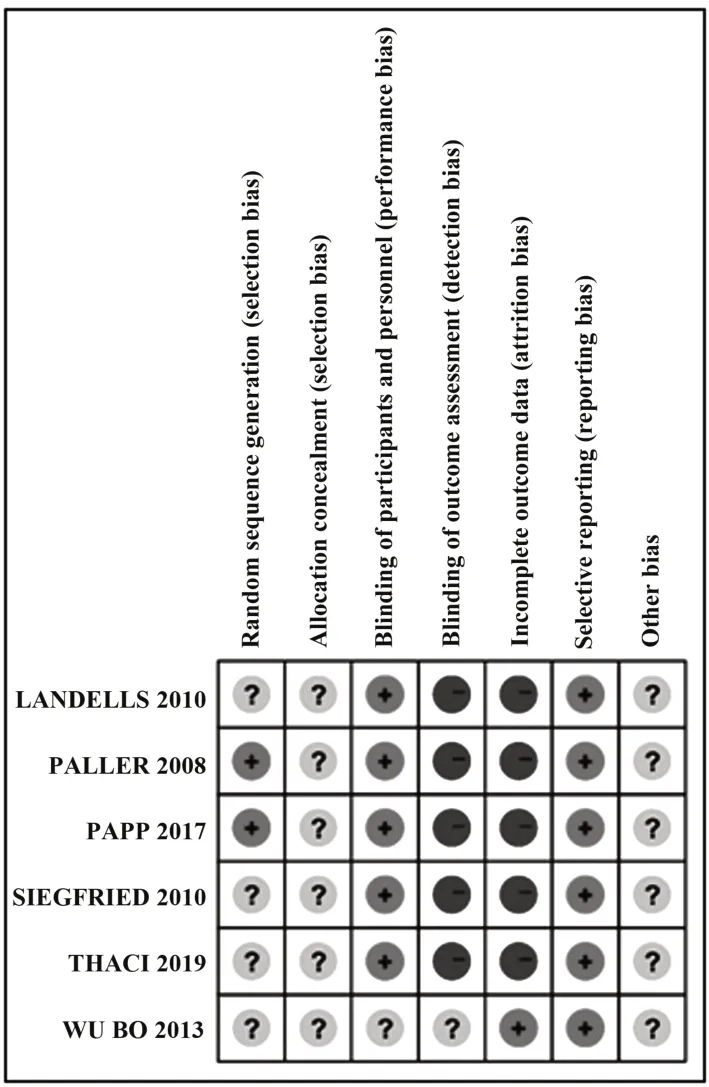
图2 偏倚风险汇总图Fig.2 Summary of risk of bias
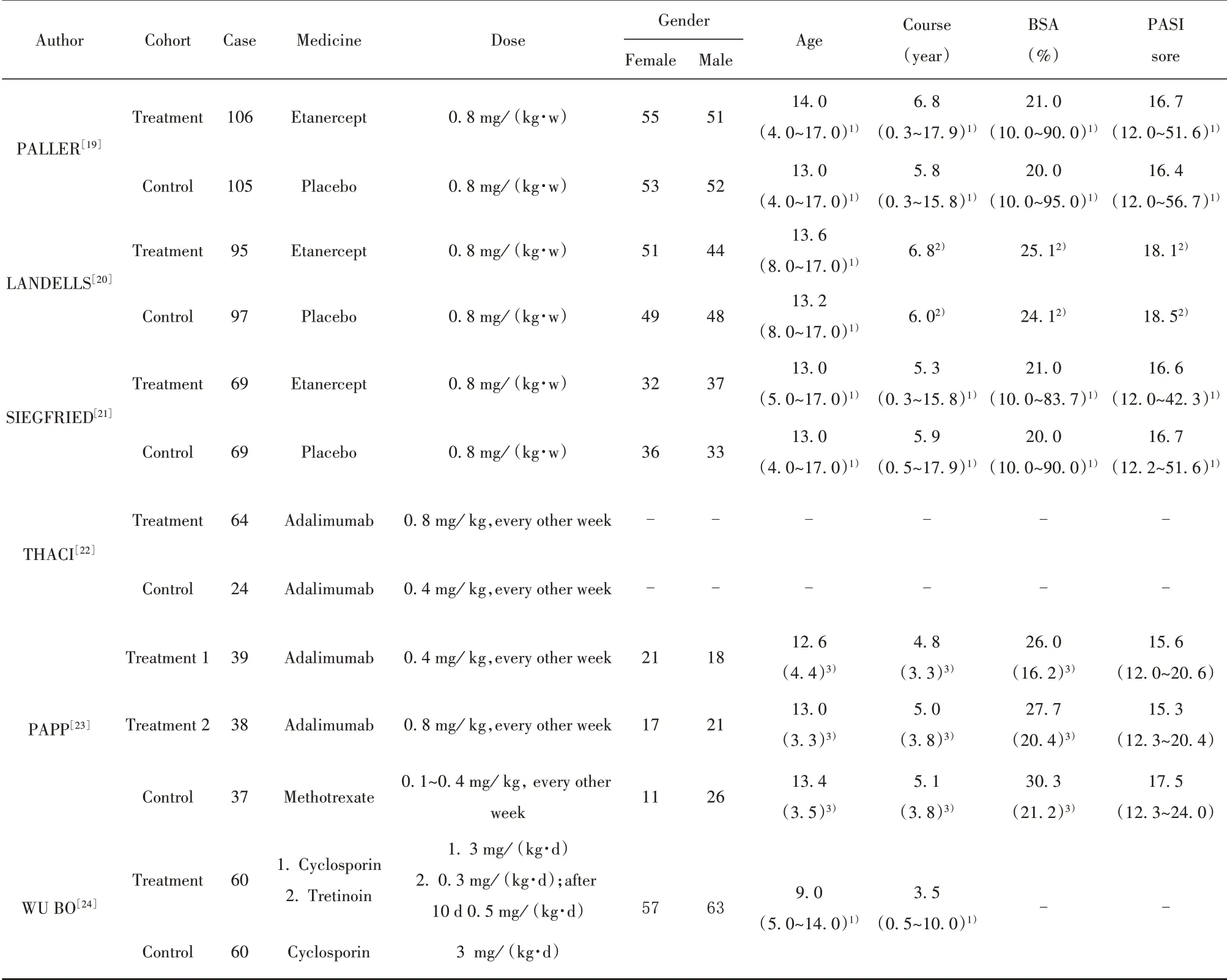
表1 纳入文献的基本特征Tab.1 Basic characteristics of included literature
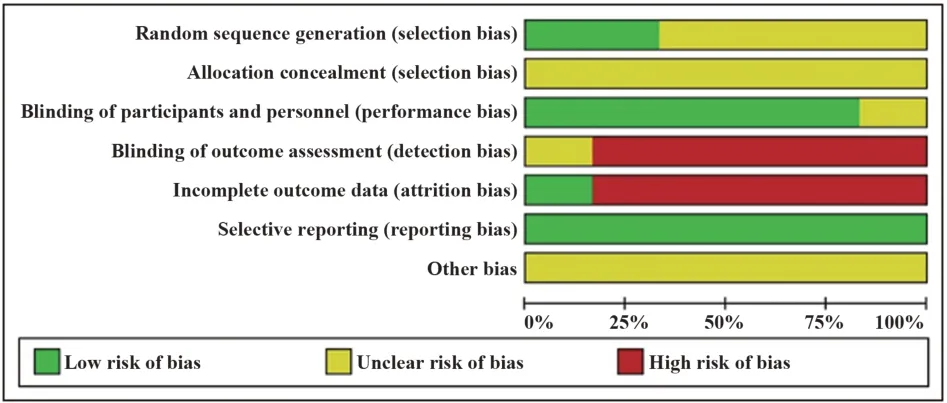
图3 偏倚风险百分比评估图Fig.3 Assessment diagram of risk of bias
1.4 统计学分析 采用Stata 14.0软件对数据进行meta分析。数据分析采用无显著异质性的固定模型或有显著异质性的随机效应模型。采用I²值分析文献的异质性,认为50%及以下的I²值研究间异质性无统计学意义,采用固定效应模型。反之,则采用随机效应模型。采用u检验(z检验)评估综合统计结果,meta分析结果以相对危险度(risk ratio,RR)及95%置信区间(confidence interval,CI)表示,P<0.05为差异有统计学意义。在这项研究中,我们使用四个指标(PASI 50、PASI 75、PASI 90、PGA)来分析这些生物治疗的疗效,而这个分析中提到的生物制品的安全性是根据患有一个或多个不良事件(adverse event,AE)和至少有一个严重不良事件(serious ad⁃verseevent,SAE)的患者统计数字来进行评估。
2 结果
2.1 治疗效果
2.1.1 依那西普与对照组(甲氨蝶呤)疗效的对比 在纳入试验中,有两项随机对照试验比较了依那西普0.8 mg/kg与甲氨蝶呤对比治疗12周后的PASI 50(严重指数改善率为50%),PASI 90(严重指数改善率为90%)[19-20]。同时,另有三项随机对照试验比较了PASI 75(严重指数改善率为75%)和医师整体评价(physicians global assessment,PGA)这两个指标[19-21]。两组比较的森林图见图4~7。PASI 50结果无统计学异质性(P=0.887,I²=0.0%),因此建立固定效应模型进行合并分析,合并效应量RR为3.169,95%CI[2.424,4.144],P<0.000 1;PASI 75研究结果具有统计学异质性(P=0.000,I²=92.4%),因此建立随机效应模型进行合并分析,合并效应量RR为2.944,95%CI[2.305,3.762],P<0.000 1;PA⁃SI 90结果无统计学异质性(P=0.830,I²=0.0%),因此建立固定效应模型进行合并分析,合并效应量RR为4.057,95%CI[2.284,7.206],P<0.000 1;PGA研究结果具有统计学异质性(P=0.000,I²=93.1%),因此建立随机效应模型进行合并分析,合并效应量RR为2.573,95%CI[0.944,7.009],P=0.065。这说明治疗12周后,依那西普0.8 mg/kg组达到PASI 50、PASI 75、PASI 90的疗效优于甲氨蝶呤组(P均<0.05),两组对PGA指标的影响差异无统计学意义(P>0.05)。
2.1.2 阿达木单抗0.8 mg/kg与对照组(阿达木单抗0.4 mg/kg)治疗的疗效 有两项RCT比较了阿达木单抗0.8 mg/kg组与阿达木单抗0.4 mg/kg组对比治疗后的PASI 75、PASI 90、PGA,两组比较的森林图见图8~10[21-22]。其中PASI 75结果无统计学异质性(P=0.829,I²=0.0%),因此建立固定效应模型进行合并分析,合并效应量RR为1.286,95%CI[1.008,1.641],P=0.043≤0.05;PASI 90结果具有统计学异质性(P=0.111,I²=60.6%),因此建立随机效应模型进行合并分析,合并效应量RR为1.385,95%CI[0.708,2.708],P=0.342>0.05;PGA结果具有统计学异质性(P=0.108,I²=61.3%),因此建立随机效应模型进行合并分析,合并效应量RR为1.158,95%CI[0.761,1.763],P=0.494>0.05。说明治疗16周后,阿达木单抗0.8 mg/kg组达到PASI 75的疗效优于阿达木单抗0.4 mg/kg组,达到PASI 90的疗效差异无统计学意义,两组对PGA指标的影响差异无统计学意义。
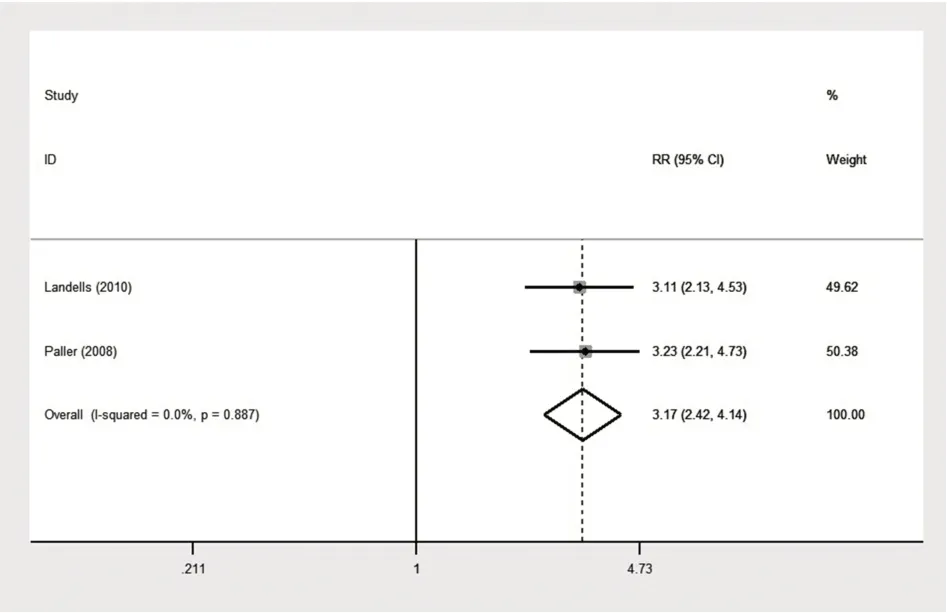
图4 依那西普组与对照组(甲氨蝶呤)达到PASI 50的森林图Fig.4 Forest map with PASI 50 in etanercept group and control group(methotrexate)

图5 依那西普组与对照组(甲氨蝶呤)达到PASI 75的森林图Fig.5 Forest map with PASI 75 in etanercept group and control group(methotrexate)
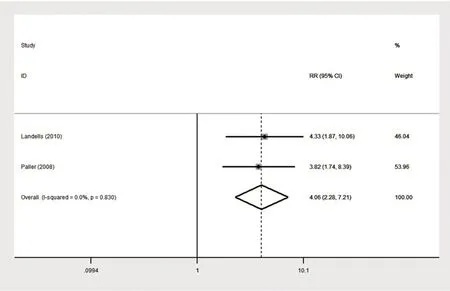
图6 依那西普组与对照组(甲氨蝶呤)达到PASI 90的森林图Fig.6 Forest map with PASI 90 in etanercept group and control group(methotrexate)

图7 依那西普组与对照组(甲氨蝶呤)达到PGA 0或1的森林图Fig.7 Forest map of etanercept group and control group(methotrexate)reaching PGA 0 or 1
2.1.3 阿达木单抗0.8 mg/kg、阿达木单抗0.4mg/kg与甲氨蝶呤疗效的对比 PAPP等[23]的RCT研究比较了阿达木单抗0.8 mg/kg组、阿达木单抗0.4 mg/kg组与甲氨蝶呤组0.1~0.4 mg/kg组治疗后的PASI 75、PASI 90、PGA。其中阿达木单抗0.8 mg/kg组与甲氨蝶呤组0.1~0.4 mg/kg组的PASI 75:RR为1.785,95%CI[1.042,3.058],P=0.035≤0.05。PASI 90:RR为1.339,95%CI[0.607,2.951],P=0.469>0.05;PGA:RR为1.493,95%CI[0.936,2.382],P=0.093>0.05;阿达木单抗0.4 mg/kg组与甲氨蝶呤组0.1~0.4 mg/kg组 的PASI 75:RR为1.344,95%CI[0.748,2.416],P=0.323>0.05,PASI 90:RR为1.423,95%CI[0.657,3.084],P=0.371>0.05,PGA:RR为1.012,95%CI[0.588,1.740],P=0.966>0.05。研究表明,治疗16周后阿达木单抗组0.8 mg/kg的患者PASI 75的疗效优于甲氨蝶呤组,PASI 90的改善率差异无统计学意义,对PGA指标的影响差异无统计学意义;除此之外,应用0.4 mg/kg阿达木单抗组与应用甲氨蝶呤组达到PASI 75、PA⁃SI 90的改善率差异以及对PGA指标的影响差异均无统计学意义。
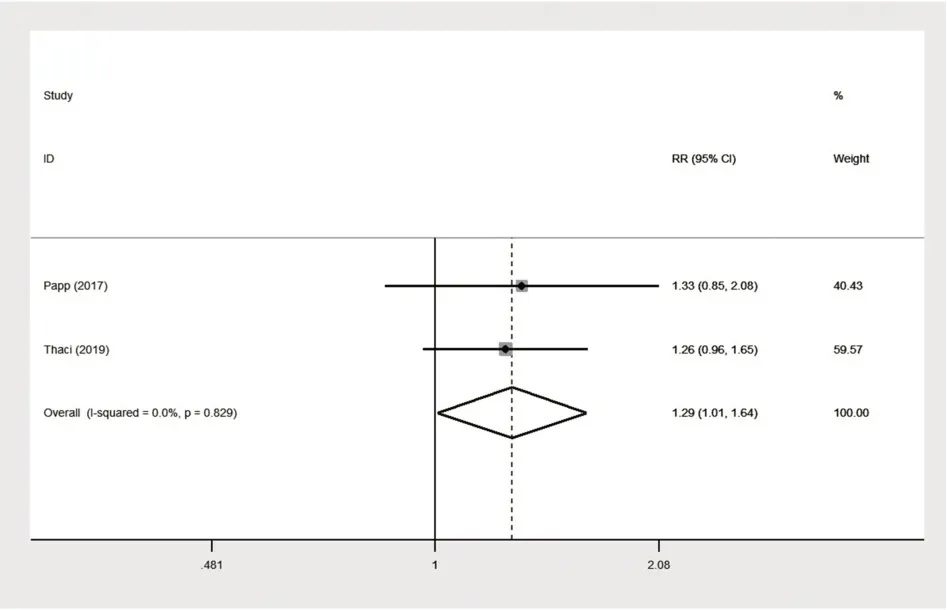
图8 阿达木单抗0.8mg/kg与对照组(阿达木单抗0.4mg/kg)达到PASI 75的森林图Fig.8 Forest map of adalimumab 0.8 mg/kg and control group(adalimumab 0.4 mg/kg)reaching PASI 75
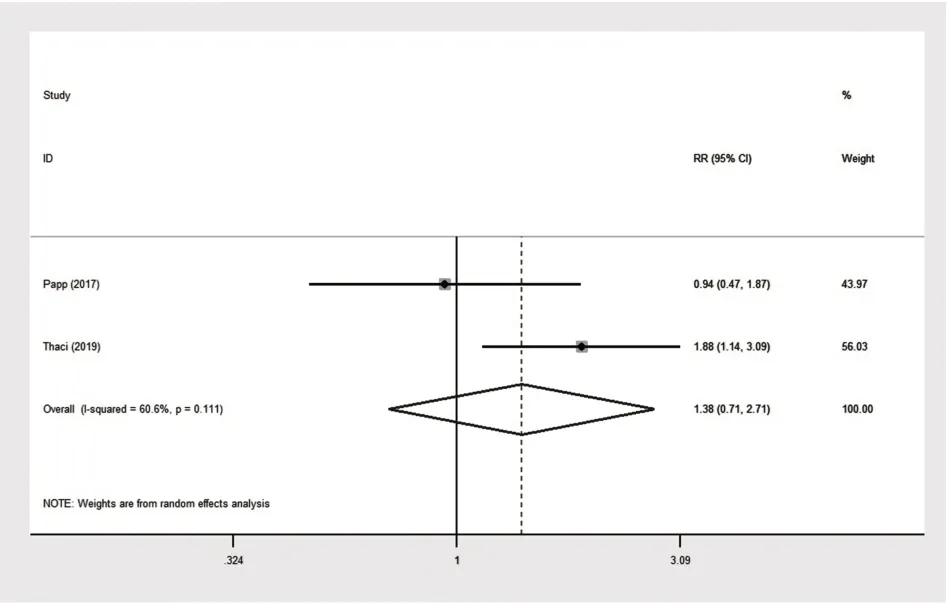
图9阿达木单抗0.8mg/kg与对照组(阿达木单抗0.4mg/kg)达到PASI 90的森林图Fig.9 Forest map of adalimumab 0.8 mg/kg and control group(adalimumab 0.4 mg/kg)reaching PASI 90
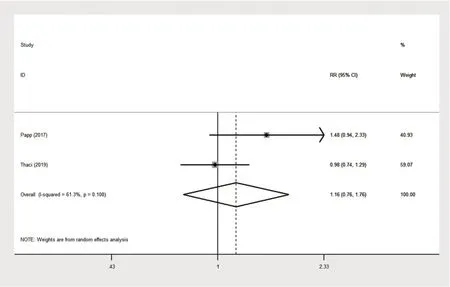
图10 阿达木单抗0.8 mg/kg与对照组(阿达木单抗0.4 mg/kg)达到PGA 0或1的森林图Fig.10 Forest map of adalimumab 0.8 mg/kg and control group(adalimumab0.4mg/kg)reachingPGA 0or 1
2.1.4 阿维A联合环孢素与环孢素单一用药对比治疗的疗效 一篇纳入的随机对照试验[24]比较了环孢素3 mg/(kg·d)(从第10天开始减药,1个月后停药)联合阿维A 0.3 mg/(kg·d)(10 d后调整为0.5 mg/(kg·d),疗程为12周,累积剂量1 300 mg)与单独应用环孢素3 mg/(kg·d)(疗程为12周)对比治疗重型儿童银屑病的随机对照试验,通过对比前后的PASI评分评价疗效,PASI 90:RR为1.400,95%CI[1.035,1.894],P=0.029≤0.05,治疗12周后,治疗组达到PASI 90的疗效优于对照组,两组的复发率差异无统计学意义,对两组患儿后续观察1~24个月,两组儿童生长发育情况正常,相关治疗未对其造成不良影响。
2.2 不良反应评价
2.2.1 依那西普治疗的不良反应 采用依那西普治疗时,治疗组和对照组的不良反应发生率分别为52.9%和46.4%。多为鼻咽炎和头痛等轻中度不良反应。其中治疗组鼻咽炎7例(10.3%)、头痛6例(8.8%)、注射部位反应1例(1.5%),对照组鼻咽炎2例(2.9%)、头痛2例(2.9%)、注射部位反应1例(1.4%)。治疗期间未见严重不良反应,没有患者因不良反应退出治疗[19]。治疗组与对照组之间经统计学分析,差异无统计学意义。
2.2.2 阿达木单抗的不良反应 阿达木单抗组0.8 mg/kg、阿达木单抗组0.4 mg/kg以及甲氨蝶呤组患者的不良反应发生率分别为68%、77%和76%,多为感染(上呼吸道感染、鼻咽炎、流感等)、注射部位反应等,严重不良反应发生率低。其中阿达木单抗0.8 mg/kg组感染事件17例(45%),阿达木单抗0.4 mg/kg组感染事件22(56%),甲氨蝶呤组感染事件21例(57%)。仅有一例严重感染事件:阿达木单抗0.4 mg/kg组的一名患者报告食物中毒(编码为胃肠道感染)。阿达木单抗0.8 mg/kg组注射部位反应4例(11%),阿达木单抗0.4 mg/kg组注射部位反应3例(8%),甲氨蝶呤组注射部位反应3例(8%)。114例患者中有严重不良事件3例(2.62%)报告,均为阿达木单抗0.4 mg/kg组患者,并且未被判定为与研究药物有关(手部骨折、食物中毒引起的胃肠道感染等)。在治疗期间,没有患者因为不良反应而停止治疗[23]。治疗组与对照组之间未见明显统计学差异。
2.2.3 阿维A与环孢素联合用药的不良反应 总体而言,由于环孢素起效快而阿维A起效慢,两者合用能减少环孢素用量并减少不良反应的发生,单一应用环孢素组不良反应较重,治疗组不良反应多而轻。阿维A与环孢素联合用药组出现血压升高10例,头晕7例,其余均未见肝、肾功能明显改变,停用环孢素后未出现反跳现象,另出现口干和皮肤干燥9例,脱发3例。环孢素组出现血压升高11例,头痛、视物模糊5例,感染加重5例,胆红素升高退出治疗3例,肾功能减退2例。多数不良反应在减量或停药后症状逐渐缓解,肝肾功能降低经对症处理后也恢复正常[24]。
3 讨论
银屑病是一种T细胞介导的自身免疫性疾病,多由炎症、抗原呈现、细胞信号和转录调控等多种危险因素诱发,持续的诱发因素刺激导致不受控制的角质形成细胞增殖并出现功能失调的分化。角质形成细胞与皮肤中各种类型细胞相互作用,发生表皮炎症,表现为大面积的红斑、鳞屑[25-26]。针对这一疾病的各类药物,作用机理各有不同。其中依那西普是一种完全人源化重组可溶性TNF-α受体二聚体与人类IgG1 Fc段的融合蛋白,可拮抗内源性TNF的作用。阿达木单抗是一种完全人源化的单克隆IgG1抗体,能与可溶性TNF-α结合,并抑制TNFα与其受体的结合[1,27];甲氨蝶呤是叶酸的抗代谢合成类似物,用作化疗和免疫抑制剂,干扰DNA合成、修复和细胞复制[28];环孢素A是一种强效免疫抑制剂,其作用机理为通过调节T细胞亚群比例,抑制活性T细胞增殖、阻止其生成IL-2,抑制角质形成细胞DNA的合成与增殖来达到治疗的目的[29];阿维A则是一种具有抗炎和免疫调节作用的口服维甲酸,用于治疗严重难治性银屑病。它作用于基因表达的调控,导致表皮细胞增殖和分化减少[30]。
本文对儿童中重度银屑病疗效和安全性的评估中,依那西普与甲氨蝶呤对疾病具有较好疗效。安全性方面,采用依那西普治疗时,不良反应均为鼻咽炎和头痛等较轻的症状。除此之外,根据国外的相关文献报道,依那西普是临床上较早用于治疗银屑病的生物制剂,多用于系统治疗效果不佳的中重度银屑病,而且已完成为期5年的安全性试验,说明其具有较好的安全性能[31-32]。通过meta分析可以得到阿达木单抗的疗效优于甲氨蝶呤组,且高剂量组(0.8 mg/kg)疗效优于低剂量组(0.4 mg/kg),这提示阿达木单抗具有较优的疗效且治疗效果与使用剂量相关。在安全性方面,在为期52周的多中心RCT三期临床试验中,尚无报告与阿达木单抗及甲氨蝶呤相关的严重不良事件[21]。虽然目前儿童寻常型银屑病尚不是依那西普及阿达木的用药适应症,但国外已有相关循证医学证据证明这两种药物在应用过程中效果明显,安全性高[19,22]。需说明的是,这里作为对照组的甲氨蝶呤是国际上治疗儿童银屑病最常使用的药物[33-34]。本研究还证明了环孢素联合阿维A治疗的疗效优于单一应用环孢素治疗组,由于合并用药减少了环孢素的用量,该试验组的不良反应较对照组轻,多为血压升高、口干及皮肤干燥等,这提示对于常规药物治疗无效的重度银屑病,可以考虑采用两种药物联合应用,从而提高疗效,减轻药物的副作用。但两者均可增加血清胆固醇和三酰甘油水平,故只能短期联合应用,病情控制后逐渐过渡到单一药物治疗[24]。环孢素的儿童用药口服吸收率低,清除率高,需要更高的药物剂量以达到与成人类似的疗效,故仅建议使用其他药物治疗无效的严重银屑病患儿使用,常见不良反应包括肾毒性、高血压等,需定期监测血药浓度、肝肾功能及血压等指标[33,35]。维甲酸类药物多用于治疗中重度的寻常型、红皮病型及腺癌型儿童银屑病,但对关节病型银屑病效果欠佳,常见不良反应包括皮肤黏膜症状、眼毒性、肝酶或血脂升高、骨髓发育异常及致畸性,需监测血脂及生长曲线图等指标[12]。
综上所述,本研究meta分析的结果显示,在儿童中重度银屑病的治疗上,依那西普、阿达木单抗均显现出较好的疗效且短期内无严重不良反应。对于常规药物治疗无效的重度银屑病患儿,采用阿维A与环孢素两种药物联合治疗的方案可以取得显著疗效且副作用较轻。本文为临床儿童银屑病患者的药物选择提供了参考,在实际应用中,还需要临床医生结合患者病情制订更为个体化的治疗方案。