髓源抑制细胞在非肿瘤疾病中的研究进展①
焦肖宁 苏 琳 朱杨壮壮 侯怡飞 胥孜杭 邹纯朴
(上海中医药大学基础医学院,经方理论应用研究中心,上海201203)
1 髓源抑制细胞的概述
髓源抑制细胞(myeloid-derived suppressor cell,MDSC)首现于癌症患者体内,来源于骨髓中的骨髓祖细胞[1-3]。这群细胞由不成熟的粒细胞、树突状细胞和巨噬细胞等组成,主要通过抑制T细胞的杀伤活性促进肿瘤细胞发生免疫逃逸,从而加速肿瘤的发展进程[4]。根据表观结构的不同,MDSC主要分为单核细胞样-髓源抑制细胞(M-MDSC)和粒细胞样-髓源抑制细胞(PMN-MDSC)两大亚群,在不同种属中表面标志表达有所不同[5-8]。MDSC形态的异质性影响其功能的异质性,M-MDSC较PMN-MDSC更具免疫抑制活性[9-10]。MDSC的增殖主要体现在募集和扩增,这是一个由多种因素支配的复杂而渐进的过程,其调控受生长因子、细胞因子、转录因子和信号通路等影响。近年来,MDSC在肿瘤相关疾病中的研究逐渐深入。在肿瘤微环境中,MDSC发挥负向免疫调控机制,激活的MDSC通过高表达精氨酸酶1(ARG-1)和诱导型一氧化氮合酶(iNOS),抑制T细胞介导的免疫应答[11]。在结直肠癌、乳腺癌、非小细胞肺癌和甲状腺肿瘤患者中,MDSC与实体瘤的转移和预后相关,其数量与癌症分期和肿瘤负荷呈正相关[12-19]。大多数肿瘤细胞即使在有氧情况下,葡萄糖也会发生糖酵解。而在更适宜肿瘤细胞生长的缺氧环境中,有氧糖酵解的“瓦博格效应”促使肿瘤细胞产生高浓度乳酸(糖酵解的最终产物),使肿瘤浸润性中性粒细胞逐渐趋向免疫抑制状态,从而促进肿瘤微环境中粒细胞集落刺激因子(GCSF)高表达,进一步诱导MDSC的分化和募集,促进肿瘤的进展[20-22]。
MDSC的免疫抑制活性会诱导肿瘤发生和转移,那么其免疫抑制活性是否只存在于肿瘤相关疾病?在其他非肿瘤疾病中,MDSC是否也具有相同的免疫抑制作用?其发挥的免疫抑制作用在这些疾病的发生发展中又扮演怎样的角色?
2 MDSC在非肿瘤疾病中的作用
MDSC在自身免疫性疾病、移植妊娠、感染等多种疾病的发生发展过程中,参与多种免疫细胞和免疫因子的调控,详见表1,具体阐述如下。
2.1 自身免疫性疾病
2.1.1 类风湿性关节炎 许多研究表明,MDSC参与类风湿关节炎(rheumatoid arthritis,RA)疾病的进展。RA是一种因白细胞侵袭和滑膜细胞激活导致的慢性全身性自身免疫性疾病[23]。目前认为疾病的发生发展与CD4+T细胞亚群(Th细胞)的失衡及功能异常密切相关。在RA患者关节滑液中,有85%的细胞是MDSC,其中PMN-MDSC所占比例为95%。存在于关节中的MDSC限制了RA患者关节浸润性T细胞的扩增,T细胞扩增减少抑制了过激的免疫反应,从而减轻临床症状,因此研究者认为存在于关节滑液中的MDSC是有益的[24]。当RA患者处于活动期时,外周血中的PMN-MDSC明显高于稳定期的RA患者和健康人。MDSC可抑制CD4+T细胞向Th17细胞分化,通过抑制Th1和Th17细胞的数量和功能调节体内Th1/Th2的平衡,进而缓解RA患者疾病的发展[25-27]。在小鼠模型中,M-MDSC与疾病的发展呈正相关,M-MDSC通过上调转录因子RORγt促使CD4+T细胞向Th17细胞分化、IL17分泌及IL17 mRNA的相关表达,消除M-MDSC可明显改善疾病的严重程度[28]。因此,在RA疾病发生发展过程中,PMN-MDSC可在一定程度上抑制疾病的发展,M-MDSC则更倾向于促进疾病的发展,但目前仍未有明确具体的定论[29]。
2.1.2 自身免疫性皮肤病 自身免疫性皮肤病是免疫系统自身抗原发生免疫反应导致Th2失衡,从而引起皮肤损伤的一类疾病,包括系统性红斑狼疮(systemic lupus erythematosus,SLE)、系统性硬皮病、银屑病、慢性荨麻疹等多种疾病[30]。在自身免疫性皮肤病中,调节性T细胞(Treg)、调节性B细胞(Breg)、Th1、Th2、Th9、Th17、IL2、IL17、IL22、IL-23和IFN等参与此类疾病。
SLE发病的主要因素是B细胞过度活化和辅助性T细胞(Th)功能失调[31-32]。MDSC通过iNOS诱导Breg细胞扩增,以维持免疫耐受。MDSC过继治疗会减少脾脏和淋巴结中Th1和Th17的数量,从而抑制自身免疫过程,改善SLE小鼠症状[33]。在SLE小鼠模型中,PMN-MDSC诱导B细胞中IFN-1信号传导活化,IFN-γ通过激活NADPH氧化途径促进ROS产生,进而抑制Treg细胞分化,M-MDSC则通过IL-1β增强Th17细胞分化,促进疾病的发生发展[34-36]。因此,全面地认识MDSC及不同的亚型在SLE疾病发生发展中的作用仍待进一步探索。
银屑病的产生和发展与免疫系统的异常密切相关,其主要体现在CD4+T淋巴细胞功能异常[37-38]。MDSC的数量与疾病发展的不同阶段相关,进行期银屑病患者外周血中MDSC数量较稳定期和正常人减少,且与外周血中Th17细胞比例和血清中IL-17A水平呈负相关[39-40]。MDSC促使Treg细胞增加和树突状细胞相关的硫酸乙酰肝素蛋白聚糖依赖性整联蛋白配体(DC-HIL)表达,Treg细胞对CD4+T细胞分泌IL-17没有抑制作用,但可明显下调CD4+T细胞的增殖和IFN-γ释放;同时,DC-HIL对T细胞的增殖也具有显著抑制效果。不同于MDSC在肿瘤中的免疫抑制作用,在银屑病中,MDSC因其增殖的有限性、对T细胞活化的能力不足以及在患者中异质性免疫抑制等因素使MDSC显示出降低的免疫抑制功能[41-43]。
2.1.3 1型糖尿病 1型糖尿病(type 1 diabetes,T1D)是由T细胞介导的器官特异性自身免疫性疾病[44]。MDSC对于非肥胖糖尿病/重症联合免疫缺陷(NOD/SCID)小鼠具有积极的免疫抑制作用,过继转移MDSC不仅能够诱导Treg细胞扩增,延缓血糖升高,在糖尿病肾病模型中,还可改善小鼠肾小球纤维化状态,缓解糖尿病肾病。使用B细胞消耗或抗Gr-1治疗方法促进MDSC扩增,可有效逆转T1D的发展进程[45-48]。尽管很多学者认为MDSC可以形成自身抗体免疫耐受,预防T1D的发生,但仍有研究表明,MDSC促进T1D疾病的发展。T1D患者外周血中MDSC的数量较健康人多,且以M-MD⁃SC为主[47-51]。MDSC在T1D疾病中的研究多集中在动物模型,在临床中的作用未被完全揭示[52]。其在疾病中究竟是促进疾病的发生发展,还是通过负反馈阻止疾病的发展,目前仍不清楚。
2.2 移植免疫 器官移植是治疗器官衰竭的重要疗法,移植器官非自身和同种免疫应答期间涉及多种免疫机制。在同种异体器官移植中,MDSC高表达ARG-1和iNOS,促使一氧化氮(NO)产生并与超氧阴离子结合形成过氧化亚硝酸盐,诱导效应性T细胞凋亡[53-54]。Treg细胞是维持器官移植者免疫耐受的关键性免疫细胞,但单纯的Treg在许多情况下难以实现对机体免疫耐受的控制,MDSC在某些情况下抑制效应T细胞以及诱导Treg或Breg扩增,从而延长移植物的存活时间,其中M-MDSC发挥重要作用[55-57]。MDSC也可诱导树突状细胞成为耐受性树突状细胞(tolerogenic dendritic cell,Tol DC),Tol DC同样可以介导免疫抑制[58-60]。因此研究者可以靶向MDSC,通过诱导其募集,提高机体免疫耐受,进而延长移植器官存活时间。
妊娠在生殖领域被认为是成功的半异体移植现象,此过程是孕妇的全身先天免疫和适应性免疫的激活。而妊娠的维持则取决于母胎界面免疫系统间的动态平衡,若失去这种平衡,则会引起母体对胎儿的排斥反应,从而导致流产[61]。妊娠期妇女外周血MDSC的表达显著高于非妊娠妇女,其中以PMN-MDSC显著增高为主。孕中期MDSC表达量显著高于孕早期和晚期,脐带血MDSC比例显著高于蜕膜及胎盘。分娩后外周血中的PMN-MDSC在几天内下降,恢复至正常人水平[62]。但不同的是,MMDSC在妊娠期妇女外周血中同样有所累积,使用17β-雌二醇通过信号转导和转录激活因子(STAT)-3可诱导M-MDSC的扩增,增强其免疫抑制活性[63]。在复发性流产患者中,外周血中MDSC含量显著降低[64]。在妊娠小鼠模型中,MDSC可显著抑制CD3+T、CD4+T细胞的增殖[62,65]。缺氧、雌激素及炎症反应可激活缺氧诱导因子1α(HIF-1α),通过激活NF-κB炎症途径诱导MDSC分化停滞,进而产生累积[66-67]。在自然流产小鼠模型中,MDSC中的ARG-1、iNOS、IL-10和TGF-β水平显著降低[68]。这些都表明,MDSC参与母体免疫,对新生儿及母体具有积极的保护作用。
2.3 感染
2.3.1 结核病 肺结核是传染病中引起死亡的主要疾病,这主要是由于病原体具有逃避宿主免疫防御的能力[69]。结核分枝杆菌包含在病变组织内,富含IL-6、G-CSF和PROK-2的促炎环境,促使多种模式识别受体(PRR)产生,诱导经典单核细胞(Ly6Chi或CD14+)转化为具有潜在抑制功能的单核细胞(L-Mono),在IFN-γ和脂多糖(LPS)等多因素作用下,L-Mono细胞转化为活化的M-MDSC,S100蛋白和MMP9蛋白高表达促使M-MDSC向肺组织募集[70]。M-MDSC通过过表达NO、ARG-1和iNOS,分泌IL-4、IL-6、IL-10和TGF-α等免疫抑制因子,导致T细胞增殖、活化和运输受阻,Treg细胞扩增间接诱导DC细胞凋亡,进而参与机体免疫抑制[42,71-74]。在分枝杆菌卡介苗(BCG)感染小鼠模型胸膜腔内,TNF-α可调节PMN-MDSC和M-MDSC的激活和扩增[75]。由于MDSC的免疫抑制活性和在疾病发展过程中的高频率,MDSC被认为是可能导致BCG疫苗功效低的因素之一[76]。
2.3.2 脓毒症 脓毒症主要由革兰氏阳性菌和革兰氏阴性菌感染引起。脓毒症早期的高炎症性“细胞因子风暴”介导组织损伤和器官功能障碍,伴随炎症的解决和组织修复的改变,脓毒症诱导的免疫抑制会引起继发感染和多器官衰竭[77-79]。在疾病发生发展过程中,促炎环境激活NF-κB/C/EBPB/STAT3信号通路从而上调S100A9表达,S100A9易位进入细胞核,以上调microRNA miR-21和miR-181b的转录,从而调节MDSC的扩增和功能[80-81]。Nrf2、TGR5、SIPR2和P38-GRK2-CCR2信号通路也参与MDSC的扩增[82-83]。在疾病早期阶段,MDSC大量募集可抑制机体的高炎反应,实现对机体的保护。在疾病晚期阶段,MDSC发挥的免疫抑制功能促使机体处于低炎环境,进而引起继发感染和代谢综合征等。
2.3.3 乙肝 乙型肝炎病毒感染(hepatitis B vi⁃rus,HBV)并非细胞致病性导致,该疾病主要是由于免疫失衡而导致各种程度的肝脏炎症和组织损伤[84]。在慢性乙型肝炎(CHB)患者肝脏中,ARG-1过表达促使PMN-MDSC募集、CD3ζ链低表达和T细胞增殖能力受损,在局部发挥保护肝细胞的作用[85]。M-MDSC同样参与CHB疾病的发展,健康供体外周血单核细胞(PBMC)可作为M-MDSC前体,当其暴露于乙型肝炎E抗原(HBeAg)时,会诱导MMDSC扩增,PD-1、IL-1β、IL-6、IL-10和吲哚胺-2、3-双加氧酶(IDO)上调,CD4+、CD8+T细胞增殖和IFN-γ产生显著降低[86-87]。尽管研究表明,外周循环中的免疫抑制不足以削弱外周免疫反应,但外周血中的MDSC发挥的有限的免疫抑制可能会导致不良的疾病清除率和促进疾病进展[85]。
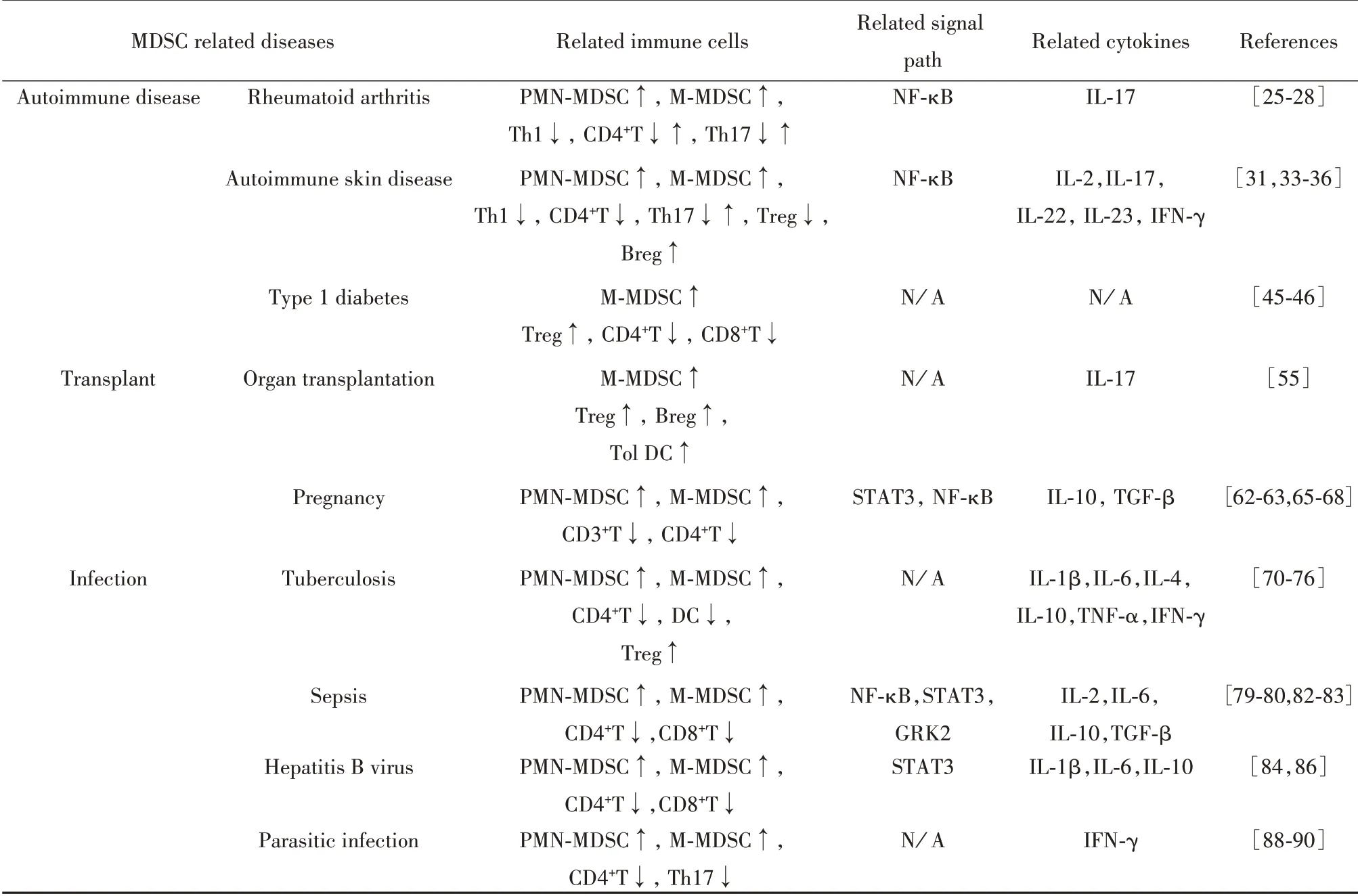
表1 MDSC在非肿瘤疾病中的研究Tab.1 Study of MDSC in non-neoplastic diseases
2.3.4 其他急慢性感染 在寄生虫感染小鼠模型中,敲除锥虫感染小鼠体内MDSC后,Th17细胞急剧增加,并导致寄生虫血症[88]。日本血吸虫感染小鼠内的可溶性蛋白抗原通过诱导NADPH氧化酶(NOX)亚基gp91phox和p47phox诱导MDSC在感染小鼠脾脏中的积累[89]。在细粒棘球绦虫小鼠感染模型中,M-MDSC还具有潜在的血管生成作用[90]。在肠沙门氏菌感染小鼠模型早期阶段,PMN-MDSC引起的急性免疫抑制主要通过抗原呈递和NO的产生来调节CD4+T、CD8+T介导的免疫应答,在一定程度上控制疾病的发展。但当PMN-MDSC的累积和持久的免疫抑制超过一定的阈值水平则会引发附带效应,从而延长或加剧疾病的发展[91]。在肺炎克雷伯菌小鼠模型中,S100A9蛋白通过激活STAT3信号通路,诱导M-MDSC细胞在局部炎症反应区域增殖,其发挥的免疫抑制活性可能会干扰机体有效的细菌清除,对疾病的发展起促进作用[92]。在真菌感染中,白色念珠菌通过识别受体Dectin-1及其下游衔接子蛋白CARD9诱导MDSC产生,MDSC通过下调NK细胞和T细胞活性,在白色念珠菌感染的小鼠模型中起保护作用[93]。
3 讨论与展望
MDSC首次被发现在肿瘤疾病中,病理条件下具有特殊的免疫调控作用。在肿瘤微环境中,MDSC通过高表达ARG-1和iNOS,分泌IL-10和TGF-β等免疫抑制因子,消耗L-精氨酸,下调CD3ζ链的表达,进而导致T细胞活化受阻,诱导肿瘤细胞发生免疫逃逸。而在自身免疫性疾病、感染、器官移植和妊娠等非肿瘤疾病中,MDSC发挥一定的良性调节作用,MDSC通过调控B细胞和T细胞等免疫细胞,弱化机体自身“激进”的免疫抗原反应,进而改善临床症状。但值得注意的是,MDSC不同的亚型在疾病中发挥的作用有所不同,其累积程度和抑制能力在疾病的发展过程中是动态变化的,因而研究者要从整体性和动态性探究MDSC在非肿瘤疾病中的作用。
尽管研究表明MDSC在非肿瘤疾病中发挥一定的正向调节作用,然而因疾病的复杂性,现代医学的靶向治疗尚不能改善疾病发生发展的整体环境。中医学属于传统医学,是医学领域的一个重要分支,越来越多的研究表明中医药在调控机体微环境中发挥重要作用。在调控肿瘤微环境时,中医经典复方阳和汤下调肿瘤微环境中MDSC、iNOS和ARG-1的表达,通过抑制IL-6和TGF-β的表达负向调节JAK/STAT3通路。同时,阳和汤通过增加NK细胞和CD4+T细胞的数量来增强免疫反应,最终抑制乳腺癌小鼠模型肿瘤的生长[94]。在调控非肿瘤疾病时,中药单体雷公藤内酯醇可有效抑制风湿性关节炎患者外周血中ARG-1的表达[95];同时通过抑制TLR4/NF-κB信号通路,减少TNF-α,IL-4,IL-6炎症因子的产生,减轻炎症反应,从而治疗大鼠RA模型[96]。雷公藤多苷联合甲氨蝶呤治疗类风湿性关节可降低药物的毒副作用,改善患者预后[97-99]。通痹汤联合雷公藤在治疗活动期老年性风湿性关节炎作用显著,能够达到标本兼治的功效[100]。大量文献查阅表明,中医药在调控MDSC进而影响非肿瘤疾病进展的相关研究较少且较浅。因此,加强中医学对MDSC在非肿瘤疾病中的调控研究,联合现代医学治疗疾病,将中医学独特的优势在疾病相关研究和治疗中彰显出来,以达到标本兼治、增效减毒和改善患者生存质量的作用。
无论是生理性状态(如妊娠)或是肿瘤相关疾病,都与机体免疫系统密切相关。虽然MDSC在非肿瘤疾病中发挥一定的正向调节作用,但如将其诱导并应用于非肿瘤疾病中,是否会诱发肿瘤的形成?精准治疗与靶向治疗的理念随着现代科学研究的深入应运而生,MDSC亚型尚未明确,各个亚型在自身免疫性疾病、感染和器官移植领域的作用也不尽相同,如何才能更好地利用各个亚型的优势在疾病中发挥正向调节作用?MDSC在疾病的不同阶段和不同组织中发挥的作用有所不同,如何从整体性出发去利用其活性或增加其数量才可以更好地治疗疾病?总之,正确的认识MDSC的免疫调控机制,应用靶向治疗的同时在机体整体环境中把握动态平衡,才可以更好地使MDSC在疾病中发挥良性调节作用。