甲状腺乳头状癌中PBX3和Twist表达的临床意义
曹学全,蔡小波,杨朝晖,魏科娜,阮正英,周璐青,卢洪胜
台州市中心医院(台州学院附属医院) 病理科,浙江 台州 318000
甲状腺乳头状癌(papllary thyroid carcinoma,PTC)是甲状腺癌最常见的亚型,约占全部甲状腺癌的80%。大多数PTC甚至在发生淋巴结转移的情况下仍具有相对较高的生存率[1]。然而15%的淋巴结转移病例具有侵袭性行为,其特征表现为局部浸润、远处转移、治疗耐药性以及复发率和病死率增加[2]。因此,研究PTC侵袭、转移的分子机制,发现有效的治疗靶点具有重要的临床意义。前B细胞白血病同源盒基因3(pre-B-cell leukemia homeobox 3,PBX3)是PBX家族中一个主要的辅因子,它能提高同源盒蛋白的DNA结合/转录活性,其异常高表达是诱导和维持耐药急性髓系白血病的必要条件[3-4]。此外,体外研究发现PBX3的过度表达促进胰腺癌细胞的增殖、迁移和侵袭,而减少癌细胞的凋亡[5]。Twist转录因子是由TWIST1基因编码,属于碱性螺旋环螺旋(basic helix loop helix,bHLH)转录因子家族成员,在细胞谱系的确定和分化中起着重要的作用。研究证实,Twist的过度表达与肿瘤的临床病理特征和化疗的耐药有关,并可作为较短总生存期的候选生物标志物[6-7]。PBX3基因和蛋白在PTC组织中是否存在异常表达,其与临床病理特征的关系及PBX3和Twist的相关性如何,目前仍不清楚。本研究采用RT-qPCR及免疫组化En vision二步法分别检测PTC和相应癌旁组织中PBX3和Twist m RNA及蛋白的表达特点,拟分析PBX3和Twist基因及蛋白表达水平变化在PTC发生、侵袭和转移中的作用及机制。
1 材料和方法
1.1 组织标本 选取台州市中心医院2017年1月至2018年1月住院进行手术切除的PTC标本60例,术后常规病理诊断结果为PTC。所有患者均具有完整的临床病理资料,且术前未接受放疗、化疗及生物学治疗。60例PTC患者中,男19例,女41例,年龄21~77(46.1±13.4)岁。甲状腺癌TNM分期参照2010年第七版美国癌症联合委员会(AJCC)/国际抗癌联合会(UICC)制定的分期标准:I~II期38例,III~IV期22例。同时选取同组30例PTC的相应癌旁组织(距离肿瘤≥2 cm)作为对照,经病理诊断为正常甲状腺组织,患者男12例,女18例,年龄21~72(49.2±14.0)岁。收集癌和癌旁标本分为2份,1份在离体后20 min内放入-80 ℃低温冰箱保存用于RT-qPCR检测PBX3和Twist基因的表达量;1份标本用4%多聚甲醛固定,石蜡包埋,行免疫组化标记PBX3和Twist蛋白的表达。
1.2 主要试剂 TRIzol试剂盒购自美国Invitrogen 公司,PIPA裂解液、cDNA试剂盒、SYBR Green荧光染料等均购自美国Promega公司。PBX3兔抗人多克隆抗体购自美国Santa Cruz公司,Twist兔抗人多克隆抗体购自英国Abcam公司,En Vision通用试剂盒及二氨基联苯胺(DAB)均购自福州迈新生物技术有限公司。
1.3 方法
1.3.1 RT-qPCR检测PBX3和Twist mRNA表达:在美国国家生物技术信息中心(NCBI)基因库中查找目的基因PBX3、Twist和内参基因的编码序列,选取GAPDH为内参基因,所有基因PCR引物序列均由温州长丰生物科技公司设计合成,具体如下:PBX3正向 引物5’-CAAGTCGGAGCCAATGTG-3’,反向引物5’-ATGTA GCTCAGGGAAAAGTG-3’;Twist正向引物5’-GGAGTCCGC AGTCTTACGAG-3’,反向引物5’-TCTGGAGGACCTGGTAGA GG-3’;内参GADPH正向引物5’-CTGGGCTACACTGAGCAC C-3’,反向引物5’-AAGTGGTCGTTGAGGGCAATG-3’,参照TRIzol试剂盒说明书提取PTC和癌旁组织的总RNA并检测浓度及纯度,然后按照反转录试剂盒说明书将RNA反转录为cDNA,37 ℃孵育60 min。加入目的基因的上、下游引物和SYBR Green荧光染料,完成40个PCR循环,收集荧光信号进行结果分析,计算目的基因的mRNA相对表达量。
1.3.2 免疫组化检测PBX3和Twist蛋白表达:应用免疫组化En Vision二步法进行检测。制作4 μm厚的石蜡切片,常规脱蜡水化。3% H2O2室温孵育阻断内源性过氧化物酶的活性,0.1 mmol/L枸橼酸盐缓冲液高压水浴抗原修复,1%山羊血清封闭,滴加一抗(PBX3稀释浓度为1:200,Twist为1:100)4 ℃冰箱过夜,次日滴加二抗(En Vision免疫组化检测试剂),DAB显色,苏木素复染、盐酸分化、脱水、透明和封片,显微镜下观察表达特点和阳性定位。以PBS代替一抗作阴性对照,PBX3用前列腺癌组织作阳性对照,Twist用宫颈癌组织作为阳性对照。阳性细胞表现为淡黄色至棕褐色颗粒,PBX3阳性表达均定位于细胞质,Twist阳性表达定位于细胞质和(或)细胞核。在光学显微镜下,每张切片随机选取至少5个高倍视野,每个视野计数200个细胞进行评分和记录。每张切片根据半定量积分法进行判定,最终积分=染色强度×阳性细胞百分比。染色强度:无显色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞占所有细胞的百分比:<10%为0分,10%~25%为1分,25%~50%为2分,50%~75%为3分,>75%为4分,最终积分≤4分为阴性,>4分为阳性[8]。
1.4 统计学处理方法 采用SPSS17.0软件进行数据分析。计量资料以 ±s表示,2组间基因表达水平的比较采用t检验,不同组间蛋白表达阳性率的比较采用χ2检验,采用Spearman等级相关分析探讨PBX3和Twist蛋白表达的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 PBX3、Twist mRNA表达情况
2.1.1 PTC和癌旁组织中PBX3、Twist mRNA表达的比较:PTC组织中PBX3、Twist m RNA的表达量均高于癌旁组织,差异有统计学意义(P<0.05),见图1。
2.1.2 PBX3、Twist mRNA的表达与PTC临床病理特征的关系:PBX3、Twist mRNA表达均与PTC的包膜侵犯、淋巴结转移及临床分期有关(P<0.05),而与患者年龄、性别、肿瘤直径和组织学分型均无关(P>0.05)。见表1。
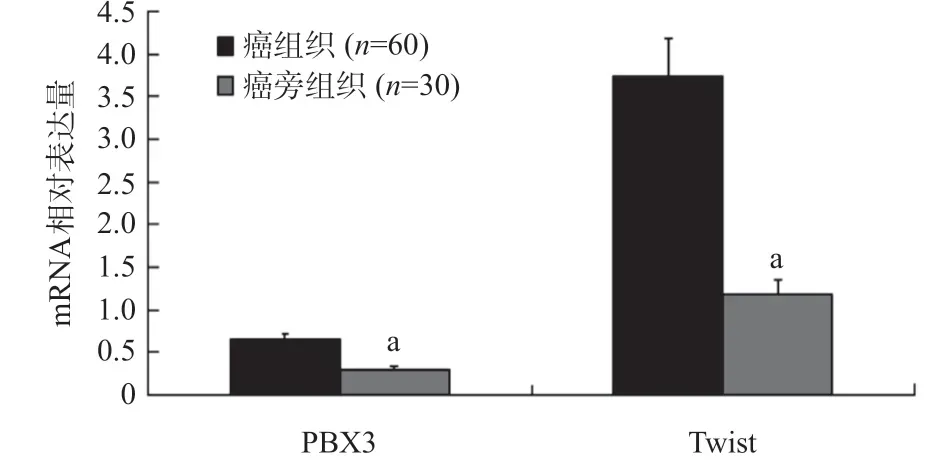
图1 PTC和癌旁组织中PBX3、Twist mRNA相对表达量
2.2 PBX3、Twist蛋白表达情况
2.2.1 PTC和癌旁组织中PBX3、Twist蛋白表达的比较:多数PTC中PBX3在细胞质和Twist在细胞质和(或)细胞核呈弥漫强表达,而在癌旁组织中多为表达缺失或少数弱或中等强度表达。PTC组织中PBX3和Twist蛋白的阳性表达率分别为73.33%(44/60) 和68.33%(41/60),癌旁组织中PBX3和Twist蛋白的阳性表达率分别为16.67%(5/30)和13.33%(4/30),癌组织中的阳性表达率显著高于癌旁组织(P<0.05),见图2。
2.2.2 PBX3、Twist蛋白表达与PTC临床病理特征的关系:伴有包膜侵犯、淋巴结发生转移和III~IV期PTC组织中PBX3蛋白表达均高于无包膜侵犯、无淋巴结转移及I~II期PTC组织(P<0.05),而在患者不同年龄、性别、肿瘤直径和组织学分型中的表达差异无统计学意义(P>0.05)。包膜是否侵犯、淋巴结是否转移及I~II期和III~IV期PTC组织中Twist蛋白表达差异有统计学意义(P<0.05),而在患者不同年龄、性别、肿瘤直径和组织学分型中的表达略有差异,差异无统计学意义(P>0.05),见表2。
2.2.3 PBX3和Twist蛋白表达在PTC中的相关性: Spearman等级相关分析结果显示,PBX3和Twist蛋白表达共同阳性者35例,二者表达共同阴性者10例,PTC组织中PBX3和Twist蛋白阳性表达呈显著正相关(r=0.400,P=0.002)。
3 讨论
PBX3是PBX家族中的一个重要的转录因子,具有高度保守的同源结构域。早期的研究证实,PBX3最显著的作用是维持胚胎干细胞的未分化状态,在人类心脏发育和先天性心脏病中有潜在的作用[9]。近年来研究发现,PBX3与肿瘤发生、发展密切相关,其在胃癌、前列腺癌等多种实体肿瘤及白血病中表达明显升高,PBX3表达增加与肿瘤的生长、侵袭、转移和增殖有关[10-11]。研究表明,PBX3在多种恶性肿瘤中存在高表达,且与肿瘤的侵袭、转移及预后有关[12]。本研究从基因和蛋白水平探讨PTC和相应癌旁组织中PBX3和Twist的表达水平及PTC患者不同临床病理特征与两者表达的关系。荧光定量PCR结果显示,PBX3 mRNA在PTC组织中的表达均明显高于癌旁组织(P<0.05)。免疫组化结果显示,PBX3蛋白在多数PTC中呈弥漫强表达,而在癌旁正常组织中呈弱表达或不表达,且癌组织中PBX3蛋白阳性表达率高于癌旁正常组织(P<0.05)。表明PTC中PBX3基因和蛋白表达变化一致,提示PBX3基因和蛋白表达水平升高可能与PTC的发生密切相关,在病理诊断中增加PBX3基因和蛋白表达的检测有助于PTC良性病变的鉴别。进一步统计学分析发现,伴有包膜侵犯、淋巴结出现转移和III~IV期PTC组织中PBX3 m RNA和蛋白表达均高于无包膜侵犯、无淋巴结转移及I~II期PTC组织(P<0.05)。这表明随着PBX3基因和蛋白水平升高,PTC的恶性程度和临床分期越高,越容易侵犯甲状腺包膜和淋巴结,PBX3可能参与PTC细胞的侵袭、转移,在PTC的发生、进展过程中发挥作用。该结果与LI等[12]在宫颈癌中的研究结果一致。
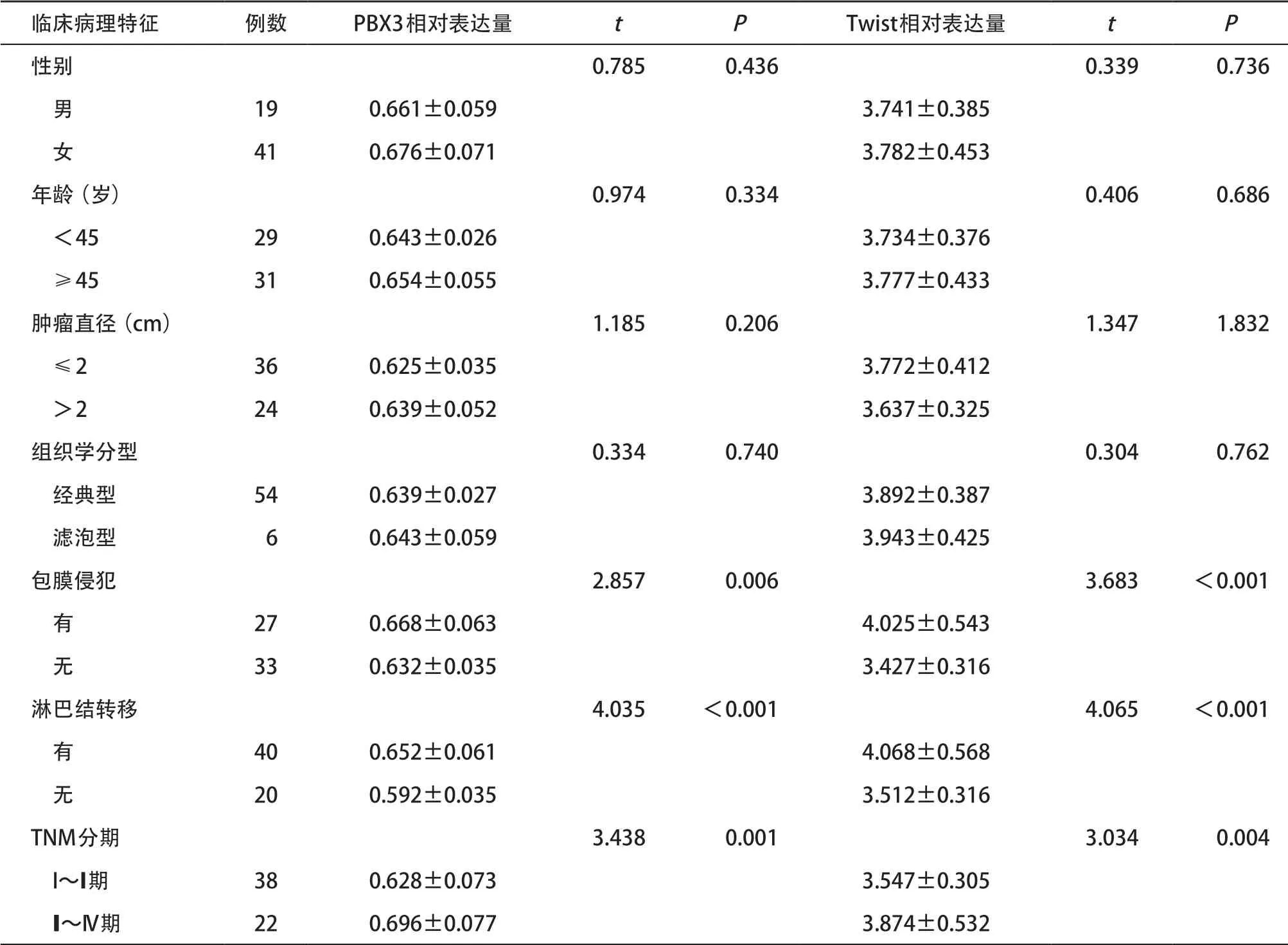
表1 PBX3和Twist m RNA表达与PTC临床病理特征的关系
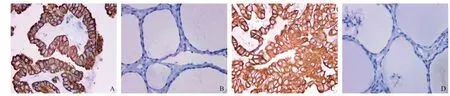
图2 PTC和癌旁组织中PBX3、Twist蛋白表达(En Vision染色,×400)
Twist是高度保守的bHLH转录因子家族成员之一,其特征在于靶向共有E-box序列5’-CANNTG-3’和 HLH区的碱性DNA结合区[13]。生理情况下,Twist是胚胎发育过程中,特别是中胚层的形成、发育和分化过程中的重要调控因子。病理情况下,随着Twist在肿瘤作用中的研究深入,发现Twist是一种癌基因,通过诱导上皮间质转化参与了肿瘤的发生、侵袭、转移和耐药[14-15]。本研究发现,Twist mRNA及蛋白在PTC组织中的表达均明显高于癌旁组织 (P<0.05),与SUN等[16]在胃食管交界处腺癌及近端胃癌中Twist高表达的研究结果一致。Twist在PTC和癌组织和癌旁组织中的表达差异在肿瘤诊断及鉴别诊断中提供了新的思路。国内学者进一步证实,Twist诊断PTC在敏感度、特异度和准确性方面显著高于良性对照组织,推测Twist可用于甲状腺良恶性肿瘤的鉴别[17]。本研究免疫组化结果还发现,Twist阳性表达定位于细胞质和(或)细胞核,在30%的PTC组织中存在细胞质和细胞核同时表达,可能与分子进入细胞核及其介导激活的调控机制有关。分析Twist表达与PTC临床病理特征的结果发现,与无包膜侵犯、无淋巴结转移及I~II期PTC组织比较,Twist m RNA和蛋白表达在发生包膜侵犯、淋巴结出现转移及III~IV期PTC组织中进一步升高(P<0.05)。提示Twist基因和蛋白表达水平增高可能在在PTC的发生中起促进作用,且与包膜侵犯、淋巴结出现转移和临床分期晚期密切相关,检测Twist基因和蛋白表达水平有助于临床评估PTC的进展情况。
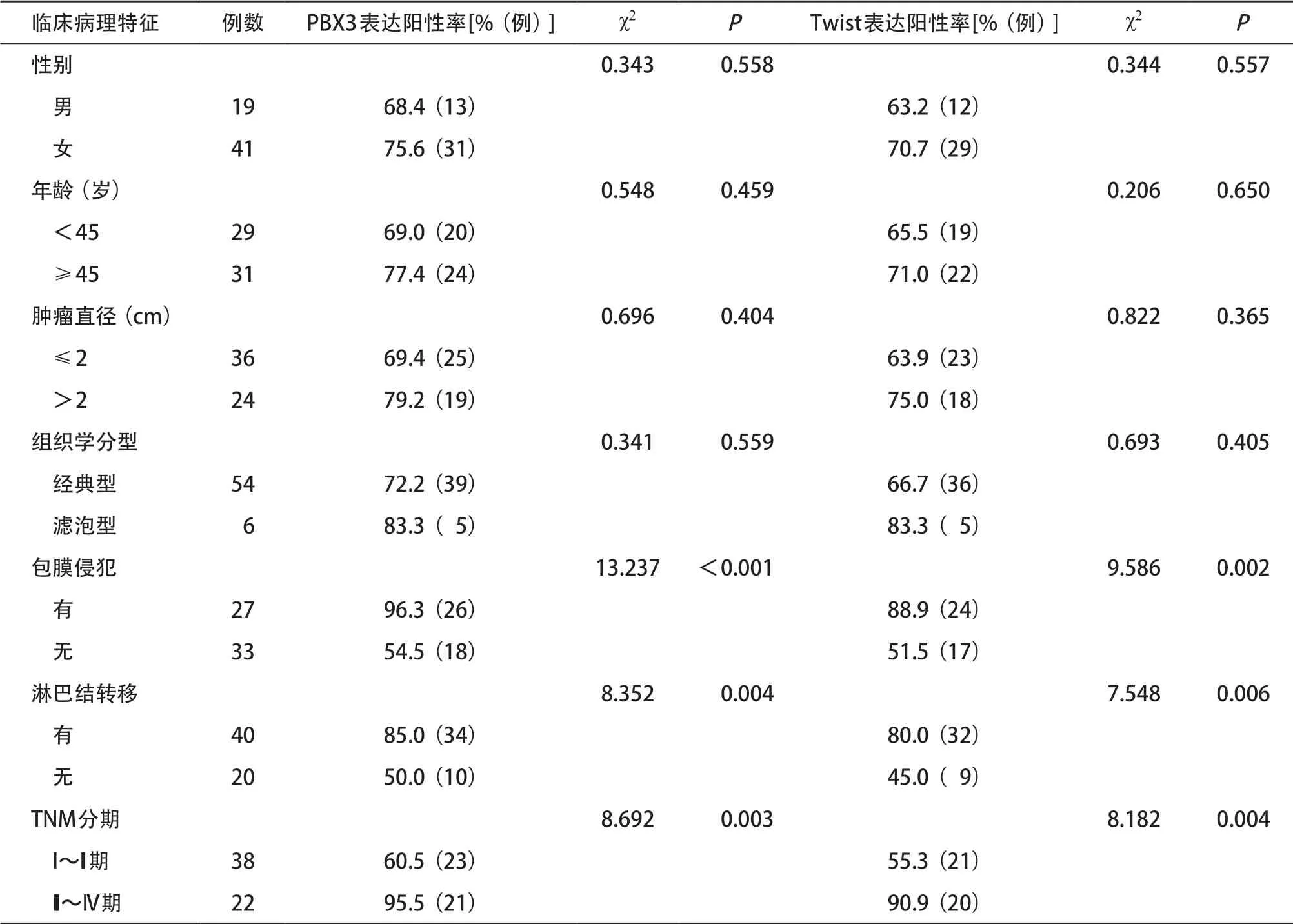
表2 PBX3、Twist蛋白表达与PTC临床病理特征的关系
研究表明,PBX3和Twist过表达均可诱导上皮间质转化的发生,从而促进肿瘤细胞的侵袭、转 移[10,14]。有关PBX3和Twist在PTC中关系的研究鲜见文献报道,本研究对PTC中PBX3和Twist表达的相关性采用Spearman等级相关分析,发现PBX3过表达,Twist表达增加,二者的表达呈正相关,其异常高表达与PTC的发生、侵袭和转移密切相关,表明PBX3和Twist的表达变化可能在PTC的进展中起协同调控作用。联合检测PBX3和Twist在PTC中的表达水平,对预测PTC的侵袭、转移能力及预后有一定的临床价值。对于PBX3和Twist在PTC中调控的具体机制需要下一步进行体内、体外实验探究其生物学功能及分子机制。

