铁死亡与骨质疏松症的研究进展
郭冰清,蒋涛
(1.南京中医药大学,南京 210023;2.常州市中医医院骨伤科,江苏 常州 213000)
细胞死亡是细胞生命结束的标志,可出现在胚胎发育、生物内环境平衡等生理病理过程中。细胞死亡模式分为非程序性细胞死亡和程序性细胞死亡两大类。非程序性细胞死亡即被动型死亡,主要包括自溶或异溶等;程序性细胞死亡即主动型死亡,包括自噬、凋亡、程序性坏死、铁死亡、焦亡等[1-2]。研究表明,铁死亡与许多疾病的生理病理过程密切相关,如肾损伤、肿瘤、缺血再灌注损伤、神经系统疾病以及骨代谢疾病等[3-4]。铁死亡是一种非凋亡性细胞死亡方式,与其他细胞程序性死亡(包括传统的凋亡、自噬、坏死、焦亡等)有显著区别,其主要特征为铁依赖性活性氧类(reactive oxygen species,ROS)在细胞内大量累积,从而促使细胞死亡[5]。铁死亡指在Fe2+或脂氧合酶的作用下,细胞膜高表达的不饱和脂肪酸被催化,发生脂质体过氧化,最终导致细胞死亡[6]。常见骨代谢疾病——骨质疏松症的发生与铁超载以及脂质过氧化均密切相关。现就铁死亡与骨质疏松症的研究进展予以综述。
1 细胞铁死亡概述
1.1细胞铁死亡的发现和命名 2003年,Dolma等[7]发现,erastin具有诱导癌细胞死亡的能力,且erastin诱导细胞死亡时胱天蛋白酶(caspase)3活化以及细胞核形态改变(核碎裂、染色质凝集、细胞体积缩小)等典型特征均未出现,而caspase抑制剂对erastin诱导的细胞死亡亦无显著抑制作用,故推测可能存在一种有别于经典细胞凋亡模式的全新细胞死亡方式。2007年,Yagoda等[8]报道显示,erastin通过致癌H-Ras诱导了肿瘤细胞快速、氧化和非凋亡性死亡。2008年,Yang和Stockwell[9]研究发现,Ras选择性致死化合物与erastin具有相似性,且检测到ROS和铁水平升高均与Ras信号密切相关。直至2012年,Dixon等[5]证实,erastin诱导的细胞死亡在形态学、生化特性以及遗传学等方面与坏死、凋亡和自噬等均不同,其特征是铁依赖性ROS在胞内大量堆积,并依据这一特征将其正式命名为铁死亡。
1.2细胞铁死亡的主要特征 作为全新非凋亡性细胞死亡模式,铁死亡不同于其他的细胞程序性死亡(如凋亡、自噬、坏死或者焦亡),见表1[10-11]。
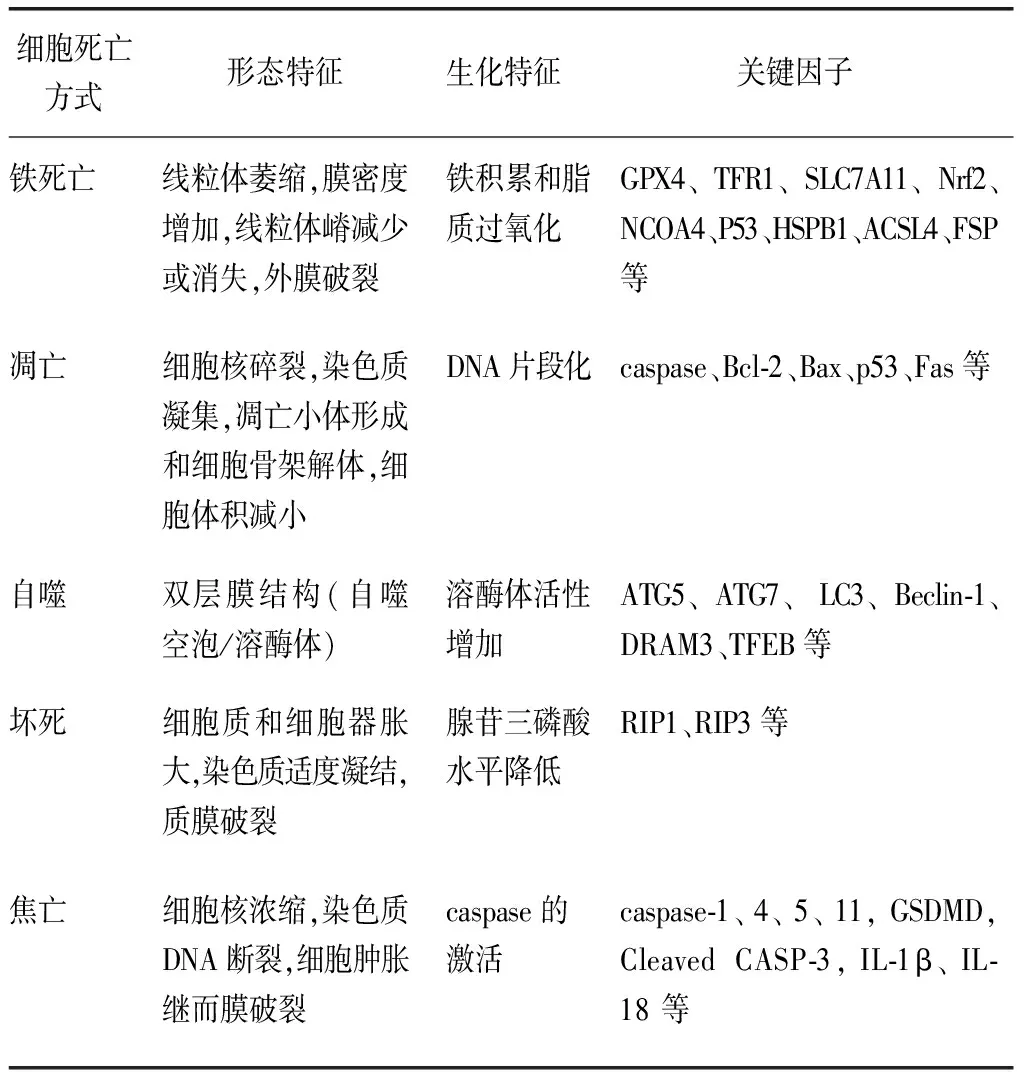
表1 细胞铁死亡、凋亡、自噬、坏死和焦亡的特征
在形态学上,细胞铁死亡主要表现为细胞变小、变圆、细胞间分离;细胞膜完整并聚缩、质膜起泡,无核固缩;线粒体皱缩、线粒体嵴减少或消失、线粒体膜密度增加以及线粒体外膜破裂等[12]。
在分子作用机制上,当Ras选择性致死化合物3(Ras-selective lethal compound 3,RSL3)诱导细胞铁死亡时,RSL3直接靶向谷胱甘肽(glutathione,GSH)依赖性酶——谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)4;GPX4通过催化GSH依赖的高反应性脂质氢过氧化物还原为非反应性脂质醇,限制脂质过氧化的能力,以保护细胞免受膜脂质过氧化作用,目前GPX4已成为铁死亡的主要内源性抑制剂[13]。erastin通过抑制胱氨酸/谷氨酸反向转运体(cystine/glutamate antiporter,system Xc-)降低细胞内半胱氨酸和GSH水平,这一机制间接影响了GPX4的催化循环,导致大量ROS聚集,从而诱发铁死亡[14-15]。
从遗传学角度分析,铁死亡在许多疾病的发生、发展中均起到重要作用,在肿瘤性疾病的治疗中,利用特异性铁死亡开发的抗肿瘤药物已应用于临床。研究发现,整个铁死亡过程受多种基因调控,主要涉及铁稳态[16-19]、ROS以及脂质过氧化过程等[20-23]。
1.3细胞铁死亡的诱导剂和抑制剂
1.3.1细胞铁死亡的诱导剂 参与诱导铁死亡的物质主要包括两类:system Xc-抑制剂:system Xc-是广泛分布于磷脂双层中的一种氨基酸反向转运蛋白,属于细胞中重要的抗氧化系统[24]。system Xc-抑制剂通过抑制system Xc-的活性(即通过抑制胱氨酸的吸收)影响GSH的合成,导致GPX4活性降低,使细胞的抗氧化应激水平减弱,脂质ROS大量产生,最终引发氧化应激损伤,导致铁死亡[25]。GPX4抑制剂:GPX4作为细胞铁死亡的关键因子,可催化GSH转变为氧化型GSH,使具有细胞毒性的脂质过氧化物转化为相应的醇[13]。抑制GPX4活性可以间接诱导脂质过氧化物的积累。erastin作为system Xc-抑制剂,可直接靶向细胞中的线粒体电压依赖性阴离子通道蛋白,进而降低GPX4活性[7]。还有一种小分子FIN56(一种特异性铁死亡诱导剂)则通过与角鲨烯合酶结合并消耗抗氧化剂辅酶Q10降解GPX4,达到抑制GPX4的目的;而FINO2(一种特异性铁死亡诱导剂)可间接灭活GPX4以诱导铁死亡[10,24]。
1.3.2细胞铁死亡的抑制剂 目前抑制铁死亡的方法主要包括:①抑制铁的累积,如铁螯合剂通过调平铁稳态,减少Fe2+蓄积,进一步抑制铁死亡进程;②通过抑制脂质过氧化反应达到抑制铁死亡的目的,铁抑素-1是第一代铁抑素,其活性依赖于芳香胺结构,芳香胺结构可特异性抑制脂质过氧化产生的ROS的积累[10]。Zileuton是一种新型5-脂氧合酶抑制剂,可抑制胞质中ROS的产生,对diagnosis和erastin诱导的HT22细胞铁死亡模型具有显著的保护作用[26]。
1.3.3中药提取物 除了各种天然或人工合成的化合物外,中药提取物及其衍生物也可诱导细胞铁死亡的发生。例如,常见的青蒿素类化合物(青蒿素、蒿乙醚、青蒿琥酯、蒿甲醚、双氢青蒿素等)均为铁死亡的诱导剂,现已证实,青蒿素类化合物对人体不同组织恶性肿瘤具有优先的细胞毒性作用,可通过诱导铁死亡发生进行抗肿瘤治疗,且具有一定的安全性和良好的耐受性[27]。来源于天然甘草酸的异甘草酸镁则可直接诱导肝星状细胞的铁死亡[28]。另一方面,来源于中药黄芩的黄酮类化合物黄芩苷元可以抑制细胞铁死亡,对创伤后癫痫发作具有神经保护作用[29]。儿茶酚类黄酮槲皮素及其代谢物具有抗铁死亡和抗氧化活性,可通过抗氧化应激作用抑制铁死亡的发生,保护骨髓间充质干细胞[30]。
1.4细胞铁死亡的机制研究 铁逐渐被认为是细胞铁死亡的重要启动剂[31],而铁螯合剂可抑制细胞铁死亡[9]。铁死亡的启动依赖脂质过氧化反应累积ROS[23]。研究表明,细胞铁死亡的关键介质是铁代谢与脂质过氧化[32-33]。
1.4.1铁代谢 铁是哺乳动物体内必需的微量元素,在活细胞和生物体内起重要作用,参与许多生物过程,包括整个细胞周期、能量产生、生物合成、复制和运动,甚至基因表达的调控等[34]。缺铁会导致贫血,而铁过量则会增加肝病、心脏病、糖尿病甚至恶性肿瘤的患病风险[35]。铁死亡通常与铁稳态的破坏有关,铁超载是铁死亡的关键因素之一,过量的铁参与提供超氧化物并完成脂质过氧化过程[32]。调节铁稳态蛋白表达的经典系统为铁调节蛋白/铁反应元件,包括转铁蛋白受体1、膜铁转运蛋白1、Fe2+转运体蛋白1以及铁蛋白等,均参与铁的提取、储存和流出的整个过程[32-33]。细胞铁主要以Fe2+或Fe3+形式储存于细胞中,Fe3+以非转铁蛋白铁或转铁蛋白结合铁的形式进入质膜,非转铁蛋白铁在质膜表面被还原为Fe2+,并被Fe2+转运体蛋白1或锌铁调控蛋白14转载至胞质,而转铁蛋白结合铁在吞饮小泡的作用下释放Fe3+并将其还原为Fe2+,同样通过Fe2+转运体蛋白1转载至胞质中[36]。Fe2+汇聚于铁池中,其中一部分形成含铁蛋白或以铁蛋白的形式存储,正常情况下,机体通过维持Fe2+的动态平衡保持稳态;病理情况下,过多的Fe2+通过Fenton反应与过氧化氢相互作用,引发多不饱和脂肪酸的脂质过氧化反应,使ROS积聚,最终导致铁死亡[37]。另有研究指出,一种存在于线粒体外膜的通道构成蛋白——电压依赖性阴离子通道(voltage-dependent anion channels,VDACs)可通过膜电位的改变而开放外膜通道(允许铁和代谢物通过),erastin则通过介导VDAC2或VDAC3开放线粒体外膜通道增加铁摄取,进而加速铁死亡进程[38-40]。
1.4.2脂质过氧化 脂质过氧化在增加细胞脂质毒性并诱导细胞铁死亡的进程中起关键作用。有报道称,erastin可引发GSH消耗和GPX4失活,最终导致脂质过氧化和细胞死亡[41]。GPX4作为一种抗氧化酶,既可在复杂的质膜环境下催化GSH转化为氧化型GSH,又可消除细胞代谢产物过氧化物和羟基自由基,减轻质膜多不饱和脂肪酸的脂质过氧化反应[37,41-42]。
目前已报道了两种铁死亡触发机制:①抑制system Xc-,同时抑制胞内半胱氨酸和GSH,作为GPX4的辅助因子,GSH同时参与过氧化物酶反应循环,因此,抑制system Xc-可间接抑制GPX4,导致致死性过氧化脂质积聚,启动铁死亡进程;②利用小分子抑制剂与GPX4活性位点的共价作用抑制GPX4活性,导致胞内脂质过氧化水平上升到一定高度,触发铁死亡[5]。
2 铁死亡与骨质疏松症
越来越多的研究发现,细胞铁死亡在神经系统疾病、心脏病、肝病、胃肠道疾病、肺部疾病、肾脏疾病、胰腺疾病中起重要作用[43-56]。骨质疏松症发病的主要原因在于骨代谢异常,其中骨稳态破坏是关键,即成骨细胞介导的骨形成减少和破骨细胞驱动的骨破坏增加。铁死亡的显著特征包括细胞内铁超载和ROS的大量堆积。
2.1铁超载 铁离子是细胞色素氧化酶的重要组成部分,参与机体血液内气体循环及脂质的运输等,过量的铁具有毒性作用。有研究指出,铁超载是骨质疏松症的一个危险因素[57]。细胞铁超载状态打破了骨形成与骨破坏的平衡,即骨平衡状态破坏,而骨质弱化是铁超载状态的共同特征之一,表现为骨量减少、骨微结构和生物力学改变、频繁骨折等[58]。骨质疏松症的发展与铁超载程度呈正相关[59]。铁超载可在一定程度上抑制成骨细胞的活性,影响其分化和矿化进程,同时激活破骨细胞的活化和分化,造成骨流失[60-61],最终导致骨质疏松症。
铁超载诱发的骨质疏松症在动物模型及临床中均有研究。长期给予右旋糖酐铁的小鼠具有部分组织铁超载和骨质疏松症的表现[62]。有报道显示,除雌激素缺乏外,绝经后女性还表现出铁超载征象,这可能是老年女性易患骨质疏松的关键因素;铁螯合剂可有效抑制铁聚集和破骨细胞分化,减少骨破坏,改善骨组织微结构,防止骨丢失[57]。由此可见,铁超载可影响骨代谢平衡,诱导骨质疏松症的发生。而控制铁超载可以在一定程度上维护铁稳态的平衡,有可能成为预防骨质疏松症的有效手段之一。
2.2ROS的累积 ROS在铁死亡相关骨质疏松症中起重要作用。线粒体是ROS的主要来源,线粒体电子转移机制是ROS形成的主要方式。ROS是正常细胞内线粒体代谢产生的副产物,主要包括羟基、过氧化氢等。一般情况下,ROS可以被机体内抗氧化酶(如GSH、GPX)清除,ROS的生成与清除可维持ROS的平衡状态。铁超载可诱导ROS累积,即自由铁通过Fenton反应催化ROS形成[63]。ROS在一定程度上参与了成骨细胞的分化和线粒体的形态转化,而过多ROS生成使正常的骨重建过程转变为骨丢失的病理过程,即骨吸收增加、骨形成减少[64-65]。
有报道称,降低ROS水平是抑制破骨细胞分化的重要因素之一,提示ROS在一定程度上刺激了破骨细胞的形成与分化[66]。Chen等[67]报道,通过降低ROS水平可以抑制去卵巢小鼠破骨细胞的产生,防止雌激素缺乏引起的骨丢失。Liu等[68]通过实验首次证实,Loureirin B可通过抑制ROS活性直接抑制破骨细胞的产生,进而防止卵巢切除术后的骨丢失。综上可知,ROS可影响骨代谢平衡,在骨质疏松症进展中的起到关键作用,但目前具体机制尚不明确。
铁死亡是铁依赖的细胞死亡形式,骨质疏松症与铁死亡密切相关。铁超载以及ROS的大量堆积是铁死亡的显著特征。铁死亡是骨质疏松症发病的重要组成部分,骨质疏松患者常合并铁超载和ROS累积,进一步研究铁死亡与骨质疏松症的关系有望改善临床骨质疏松症患者的预后。
3 问题与展望
目前对于铁死亡的认识尚不全面。在铁死亡的分子机制方面,铁和ROS是铁死亡信号通路中的重要因素,该过程的其他潜在分子机制以及除Fenton反应外介导线粒体中ROS积累的其他机制仍需进一步研究。目前对骨质疏松症的研究主要集中于铁超载和ROS的产生方面,对铁死亡与骨质疏松症的内在联系尚未深入研究。中药成分(如黄芩素[69]、青蒿琥酯[70]、槲皮素[30])可以调控铁死亡,但其具体作用机制目前尚不清楚。其他中药单体在铁死亡调节中的作用还有待进一步探讨。总之,深入研究铁死亡有助于进一步分析骨质疏松症的发病机制,为预防和临床治疗临床骨质疏松症治疗提供依据。

