经导管主动脉瓣置换术治疗老年主动脉瓣狭窄的安全性和有效性
徐东辉 罗新锦 王旭 冯翔 丘俊涛 王巍
(中国医学科学院阜外心血管病医院,北京 100037)
主动脉瓣狭窄(AS)是最常见的心脏瓣膜病之一,具有症状的AS可明显缩减患者寿命。既往的外科主动脉瓣置换术(SAVR)可改善症状和确保生存,但存在较高的并发症及死亡的风险〔1,2〕。很大一部分AS老年患者由于年龄较大及相关并发症而不适合行SAVR〔3〕。因此, 需要一种更为微创的治疗策略。 经导管主动脉瓣膜置换术(TAVR)是一种新方法,其将生物人工瓣膜通过导管植入患者的自然主动脉瓣膜内,可避免正中胸骨切开术和对体外循环支持的需求。在西方国家,TAVR已被证明在AS患者中的安全性和有效性,并广泛应用于临床〔4~8〕。我国TAVR相关研究和数据较少,本研究探讨TAVR在中国老年AS患者中的安全性和有效性。
1 资料与方法
1.1一般资料 回顾性分析阜外心血管病医院2019年1月至2020年1月行手术治疗的AS老年患者132例。其中SAVR组8例,TAVR组124例。平均年龄(74.23±5.80)岁,男79例(59.8%),女53例(40.2%)。比较两组基线资料,除年龄外,其他基线资料如心功能分级、左室舒张末径、左室射血分数(LVEF)、主动脉瓣的峰值压差及平均压差等均无统计学差异(均P>0.05),具有可比性,见表1。入选标准: ①中危以上主动脉瓣狭窄美国胸外科医师协会手术风险评分(STS)> 4;②年龄≥65岁。排除标准:①存在抗凝禁忌患者;②脑血管事件急性期;③合并需同期再血管化的冠心病。
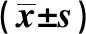
表1 两组基线资料比较
1.2手术前准备 术前患者均行经胸超声心动图检查和冠状动脉螺旋CT(MSCT)检查。超声心动图在短轴切面测量主动脉瓣环直径。CT资料经荷兰PIE医学影像公司的3 MENSIO软件进行分析重建和主动脉瓣环平面、流出道平面、窦管交界平面、升主动脉平面测量,评估主动脉无冠窦、右冠窦、左冠窦的大小及冠状动脉开口高度。根据评估结果和术中造影情况,选取合适大小的术中瓣膜。
1.3手术方法 TAVR手术在外科杂交手术室内进行,患者行监护麻醉。经颈内静脉植入心内膜临时起搏导线至右心室。根据患者术前CT测量主动脉瓣环内径,确定植入支架瓣膜的尺寸。手术开始的同时支架瓣膜进行组装。根据术前下肢动脉CT评估,选择主入路切开直视穿刺股动脉,置入10F下肢动脉鞘管。对侧副入路置入6F角度猪尾导管至无冠窦窦底,并行主动脉根部造影验证投照角度。使3个主动脉窦窦底平面与视频平面完全垂直,并按照无冠窦、右冠窦、左冠窦顺序从左至右一字排开。经主入路将猪尾导管置入左心室,并交换Landerquist支撑导丝。交换20F或18F大鞘,准备进行瓣膜释放操作。将瓣膜输送器延主入路送至主动脉根部,释放时将临时起搏器调至120~180 次/min。根据不同根部结构特点,采取不同释放策略,将支架瓣膜尽量与瓣环完全贴合。释放完成后撤出输送系统,并交换猪尾导管至左室内。经副入路行主动脉根部造影,验证支架瓣膜位置及功能。常规外科手术于外科手术室进行。患者行全麻插管,经由标准正中入路常规开胸。升主动脉插动脉管,右心房插腔房管,建立体外循环。升主动脉阻断,经升主动脉根部灌注冷血停跳液。心脏停搏后,切开升主动脉。去除病变的主动脉瓣瓣膜,根据测瓣器测量大小,选取合适的瓣膜,丝线固定于主动脉瓣瓣环。缝合升主动脉切口。充分排气后开放升主动脉,心脏复苏后停止体外循环,充分止血后关胸。
1.4统计学方法 采用SPSS20.0软件进行t检验、χ2检验、Fisher精确检验。
2 结 果
132例患者均接受手术治疗,SAVR组围术期死亡及医源性主动脉夹层与TAVR组有显著性差异(P<0.001)。两组其他并发症、术后主动脉瓣跨瓣压差无统计学差异(P>0.05)。

表2 两组围术期临床结果〔n(%)〕
3 讨 论
本研究证实了对于中国的老年人群,TAVR治疗AS的安全性和有效性。TAVR于2002年第一次应用于临床〔9〕,改变了传统AS患者的治疗方法,对于很多高危及无法耐受手术的患者,取得了较好的临床效果〔4,5〕。随着适应证的拓展,TAVR手术已被大量研究证实在低危和中危的AS患者中的安全性和有效性〔6~8〕。2017年美国心脏病协会/美国心脏协会(AHA/ACC)指南更新,推荐TAVR作为中危AS患者的有效治疗方法〔10〕。TAVR有着优异的临床结果,应用广泛,全球有超过40万例患者接受过TAVR。随着TAVR技术的推广,可发现中国人的发病及根部解剖特点,与西方人有所区别。有研究发现,中国人的二瓣化的患病率极高(47.5%),且与三叶瓣主动脉瓣膜患者相比,有更大的主动脉成角、瓣叶钙化和升主动脉增宽〔11〕。二叶瓣因其独特的解剖特点,手术难度和风险要远高于三叶主动脉瓣,国外报道的早期预后较差,装置成功率降低和瓣周漏发生率增加〔12,13〕。同时,中国人病变以风湿性心脏病为主,相比于西方常见的退行性变〔14〕,本身瓣叶及瓣环的钙化较重,常合并较重的主动脉瓣关闭不全,手术的难度较高。这些都是我国TAVR应用时面临的难题。建议对于钙化较重的患者,首先进行充分的预扩张,尽量减少钙化对于瓣膜的挤压。同时选择瓣膜时,根据术前评估的钙化情况及是否为主动脉瓣二瓣化,适当进行缩小,使瓣膜不至于过大,可有效降低使用起搏器的发生率和瓣膜移位发生率。TAVR目前主要入路为股动脉入路,而亚洲人的动脉平均直径比西方人小1~2 mm,股总动脉平均直径也小0.5~1.0 mm〔15〕。建议行主入路的股动脉切开,直视下穿刺,可有效避免钙化,降低外周血管的并发症。TAVR无论使用自膨胀瓣膜还是球囊扩张瓣膜,术后均有较高的概率需要植入永久性起搏器。起搏器植入一般发生于术后早期,球囊扩张瓣膜发生率为6.0%~6.4%,自膨胀瓣膜占25.4%~28.0%。TAVR术后的心脏传导异常可能是由于植入过程中或植入后的外伤,局部缺血、出血或水肿损伤了房室结。与球囊扩张瓣膜相比,自膨胀瓣膜的瓣架较大,有较大的径向支撑力,这使传导异常率和起搏器植入率更高〔16〕。男性、既往的传导阻滞、假体较大、瓣膜过大和植入深度增加〔17〕,也是起搏器植入的独立危险因素。本研究中使用我国国产的Venus A自膨胀瓣膜,起搏器植入率为8.1%,低于国际的25.4%~28.0%。这可能是中国人瓣叶钙化重,承受了很大的径向支撑力,使左室流出道和膜部间隔的径向压力减低有关。也可能是由于数据较新,手术技术、理念较新。选取合适的瓣膜,释放精准,可有效降低使用起搏器的发生率。
综上,与SAVR治疗相比,应用TAVR治疗老年AS的医源性主动脉夹层发生率和死亡率更低,其他并发症有着相似的结果,提示TAVR治疗老年AS是安全和有效的。本研究病例数相对有限,且目前仍缺失远期随访结果,有待更多的研究和数据证实。

