芪地糖肾方对高糖诱导足细胞自噬相关因子表达的影响
王琳 赵丽 魏慧丽 赵俊峰 安志超 谢惠迪 郭燕 宿家铭 柳红芳
(1北京中医药大学东直门医院,北京 100700;2河南省中医院)
糖尿病肾脏病(DKD)是全球导致终末期肾病的主因〔1〕,其治疗以降低尿蛋白为主,而足细胞损伤引起的蛋白尿是DKD进展的关键。芪地糖肾方(QDTS)(专利号:201711097315.2)由北京中医药大学东直门医院柳红芳教授依据明代医家张介宾“真阴精气”学说为理论基础并结合多年临床经验拟创而成〔2〕。QDTS针对DKD 蛋白尿的临床疗效颇佳〔3,4〕。研究证明QDTS可激活db/db小鼠肾脏自噬相关营养感知信号通路,调控自噬相关蛋白LC3Ⅱ、P62、Beclin1等表达起到保护小鼠肾脏的作用〔5,6〕,本研究探讨QDTS对高糖诱导足细胞自噬相关因子表达的影响及其作用机制。
1 材料与方法
1.1实验材料 实验药物:QDTS冻干粉(原药材购自北京中医药大学东直门医院)。实验细胞:小鼠足细胞MPC5(东直门实验室刘伟敬老师团队馈赠)。主要试剂和仪器:TRYPSIN 0.25%乙二胺四乙酸(EDTA、DMEM细胞培养基(无糖)、胎牛血清、青霉素-链霉素溶液购自Invitrogen公司;二甲基亚砜(DMSO)购自SIGMA公司;磷酸盐缓冲液(PBS)购自美国Solarbio公司;蛋白提取放射免疫沉淀试验(RIPA)裂解液、二喹啉甲酸(BCA)蛋白浓度测定试剂、蛋白酶抑制剂苯甲基磺酰氟(PMSF)均购自Solarbio公司;移液器购自Eppendorf;兔多克隆抗体兔抗鼠LC3Ⅱ、P62、SIRT1一抗购自Abcam公司;电化学发光(ECL)显影剂购自Biorad;蛋白上样缓冲液购自普利莱。其他生化试剂:无水乙醇、氯仿、异丙醇、多聚甲醛、过硫酸铵(APC)、水等均由北京中医药大学附属东直门医院实验中心提供。HDL洁净工作台:北京东联哈尔仪器制造有限公司;CO2恒温培养箱:Thermo公司;台式低温高速离心机:3K15型,德国Sigma公司;涡旋机:QL-861,Qilinbeibr;细胞刮刀:购自Corning;自动超纯水蒸馈器:Milli-Q型,Integral公司;光谱扫描多功能酶标仪:Promega公司;倒置相差显微镜购自Olympus公司;电泳仪购自Biorad公司。
1.2实验分组 体外培养小鼠足细胞MPC5,葡萄糖35 mmol/L干预48 h成功建立高糖诱导足细胞模型,分为空白对照组(正常足细胞)、高糖模型组、QDTS低、中、高剂量组(中药冻干粉分别为0.1、0.2、0.4 mg/ml)。
1.3细胞培养 取出细胞冻存管,于37℃水浴锅中融化,1 000 r/min室温离心5 min,弃冻存液用完全培养基洗涤,离心重悬后转移至细胞培养瓶,置33℃、5%CO2恒温箱增殖培养2~3 d,转移至37℃、5%CO2分化。细胞计数:制备单个细胞悬液,在细胞计数板中央放置计数专用的盖玻片,细胞悬液吹打均匀后转移EP管中,沿盖玻片边缘加入,置显微镜计数四角大方格内的细胞总数,细胞密度=(4个大格子细胞总数/4)×104个/ml。
1.4细胞免疫荧光染色 12孔板细胞爬片分组培养至其生长融合到70%~80%,PBS洗3遍;4%多聚甲醛室温固定20 min,PBS洗3遍;0.2%Triton X-100通透5 min,PBS洗3遍;5%牛血清白蛋白(BSA)室温封闭30 min;一抗湿盒4℃内过夜,PBS洗3遍,二抗室温2 h(避光),PBS洗3遍;4',6'-二脒基-2-苯基吲哚(DAPI)染细胞核:在避光的条件下,加入用PBS稀释5 000倍的1 μg/ml DAPI,在室温下放置5 min,然后使用预冷的1‰ Tween清洗2次,每次清洗5 min,继而用预冷PBS洗5 min,蒸馏水洗掉PBS,95%甘油封片。免疫荧光分析:图中柔和的小亮点即目的蛋白的具体表达部位,3位病理从业者独立对其进行了盲法评分,根据数量从最小到最大分为5个层次。
1.5Western印迹蛋白提取 PBS清洗,加入蛋白裂解液(RIPA+蛋白酶抑制剂),细胞刮刀刮下细胞移至离心管,4℃、3 000 r/min、5 min离心。蛋白定量(Solarbio BCA蛋白浓度测定试剂盒)96孔板设标准品、样品、设2个复孔;每孔200 μl BCA工作液;稀释待测样品至合适浓度,总体积20 μl,BCA工作液200 μl、37℃、30 min、酶标仪562 nm波长,记录OD值;5×蛋白上样缓冲液加入混匀后,100℃,水浴10 min。配分离胶(H2O、30%Acr-Bis、分离胶缓冲液、10%APS、TEMED),配浓缩胶(H2O、30%Acr-Bis、分离胶缓冲液、10%APS、TEMED),加TEMED后,将孔梳插入浓缩胶后置入电泳槽,加电泳液(Tris-甘氨酸缓冲液 SDS),拔出梳子,加样,Mark,按上样质量为20 μg的体积加入电泳道内;电泳100 V、1.5 h分离胶;80 V浓缩胶;NC膜浸润甲醇中15 s活化,将聚偏氟乙烯(PVDF)膜、滤纸浸入1×电转移液中(Tris、甘氨酸、甲醇)半干转15 V 1.5 h;TBST洗,5%脱脂奶粉(2 g脱脂奶粉+4 ml TBST混匀)封闭后TBS清洗,孵育一抗LC3Ⅱ、P62、SIRT1、β-actin 4℃过夜;TBS洗7次,5 min/次,二抗羊抗鼠1.5 h,显色。
1.6统计学方法 采用SPSS20.0软件进行ANOVA单因素方差分析、Welch检验、LSD-t检验。
2 结 果
2.1QDTS对高糖刺激足细胞MPC5自噬相关蛋白表达影响 与空白对照组比较,高糖模型组LC3Ⅱ、SIRT1表达显著降低,P62表达显著升高(均P<0.01);与高糖模型组比较,QDTS低、中、高各剂量组LC3Ⅱ、SIRT1表达均显著升高,P62表达均显著降低(均P<0.001)。见图1、表1。
2.2QDTS对高糖刺激足细胞MPC5 LC3Ⅱ、P62免疫荧光表达影响 与空白对照组比较,高糖模型组P62表达显著升高,而LC3Ⅱ表达显著降低(P<0.001);与高糖模型组比较,QDTS低、中、高各剂量组LC3Ⅱ表达显著升高,P62表达显著降低(均P<0.001)。见表1、图2。

1~5:空白对照组,高糖模型组,QDTS低剂量组,QDTS中剂量组,QDTS高剂量组图1 各组MPCS细胞SIRT1、P62、LC3Ⅱ蛋白表达
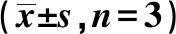
表1 各组MPC5细胞SIRT1、P62、LC3Ⅱ蛋白相对表达量比较

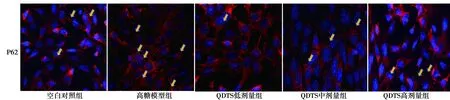
图2 QDTS刺激高糖足细胞LC3Ⅱ、P62免疫荧光蛋白表达(DAPI,×100)
3 讨 论
DKD是以虚实夹杂、气阴两虚为病机基础,日久耗气伤阴至肝肾不足,阴阳两虚,脾肾阳虚的疾病〔7〕。中医治疗应分清标本缓急,早期重在扭转病势,中后期重在延缓病情进程〔8〕。糖尿病无肾脏疾病阶段,气阴两虚为主要病机,伴随疾病的发展导致人体阴精亏损,肾藏精,逐渐形成肾精亏损的症状,多体现为蛋白尿阳性。肾脏精气亏损无力推动血脉运行致血流不畅、脉络痹阻〔9〕。柳红芳教授根据长期临床经验结合当前DKD相关三焦失用说、脾失健运说、微型徵瘕说、毒损肾络等学说提出DKD的核心病机为精损络痹,以填精通络为治疗法则,并拟QDTS(黄芪、熟地、芡实、水蛭、大黄等)〔10〕,经临床和体内实验验证疗效显著〔3,11,12〕。DKD初期以间歇性蛋白尿为主,随着病情发展出现持续性蛋白尿、低蛋白血症等最终导致肾病综合征、慢性肾衰竭并死于尿毒症,因此,有效控制蛋白尿的发生发展是DKD治疗的关键因素〔13,14〕。足细胞是一种过滤血液、阻止血浆蛋白进入尿滤液的特殊肾小球细胞,是肾小球滤膜的基本组成部分,其形成的狭缝隔膜对维持肾小球的完整性和功能至关重要,其密度降低及功能损伤可引起蛋白尿、小管间质病变,并最终发展为终末期肾病〔15,16〕,足细胞功能改变是蛋白尿发生发展的重要影响因子〔17〕。自噬是足细胞、近端小管、系膜和内皮细胞的重要保护机制,调控足细胞自噬可改变DKD发生发展〔18,19〕。高水平的葡萄糖会造成足细胞损伤,但很少报道高浓度葡萄糖和细胞自噬之间的关系,研究表明,高糖可促进足细胞的自噬,细胞内出现需要自噬作用清除的毒性物质时,LC3首先被裂解为LC3Ⅰ,然后再经过磷脂酰乙醇胺加工修饰而转变为LC3Ⅱ,然后再被募集到自噬体膜上,所以LC3Ⅱ也被公认为是细胞内自噬活性的早期标志蛋白〔20〕;SIRT1激动剂白藜芦醇能够增强SIRT1表达,改善胰岛素抵抗,降低血糖,促进线粒体再生,还能减轻系膜细胞增生,改善足细胞损伤,增强肾脏自噬活性和减轻炎症及减轻肾脏内氧化压力等多个途径发挥治疗DKD的作用〔21,22〕。本研究提示中药QDTS上调了自噬相关蛋白LC3Ⅱ、SIRT1表达,同时减少了自噬转运底物P62的蓄积,与db/db小鼠体内实验基本一致。本研究表明QDTS对db/db小鼠具有不依赖血糖控制的肾保护作用,可能归因于自噬相关营养感知信号的调节〔5〕,该研究从体外实验初步探讨验证相关结论,但仍需深入研究其相关作用机制和靶点。

