上调SERCA2a基因对慢性心力衰竭大鼠的作用及机制
陈磊 吴小燕
(海南医学院第二附属医院心内科,海南 海口 570100)
慢性心力衰竭是多种心脏疾病终末状态,当心肌细胞发生衰竭后会导致多种生物过程发生改变,其中较为重要的表现之一为肌浆网Ca2+调控障碍〔1〕。已有研究证实在心力衰竭患者和心力衰竭动物模型的心肌细胞中心肌肌浆网Ca2+-ATP酶(SERCA)2a活性显著降低,且其表达水平显著低于在正常心肌细胞中的表达,目前临床上认为SERCA2a活性降低和表达下降和肌浆网Ca2+调控障碍是导致心脏收缩、舒张功能异常的原因之一〔2,3〕。本研究中通过建立慢性心力衰竭大鼠模型,构建SERCA2a基因慢病毒载体,研究上调SERCA2a基因对慢性心力衰竭大鼠的作用及机制。
1 材料与方法
1.1材料 研究动物:选取SPF级SD健康大鼠40只,由北京维通利华实验动物技术有限公司提供,鼠龄(3.9±0.6)个月,体重(225.8±11.5)g。所有大鼠均养殖在干净笼子里,室温在(22.1±1.8)℃,相对湿度35%~40%,每天光照12 h,喂饮纯净水,饲养时间1 w。本研究所做实验均获得医院伦理委员会批准。
主要试剂:小鼠抗大鼠PLB抗体(上海优宁维生物科技有限公司),小鼠抗大鼠GRP78抗体(广州市格瑞林生物科技有限公司),兔抗大鼠p-JNK抗体(SANTA CRUZ公司),兔抗人Caspase-12抗体(Abcam公司)。
1.2方法
1.2.1慢病毒载体构建 SERCA2a表达上调的慢病毒载体构建及测定大鼠SERCA2a的序列查找和设计由广州易锦公司完成。重组的LV-SERCA2a和LV-SERCA2a(抑制载体)慢病毒表达载体由广州易锦公司合成,并经测序进行验证。之后行慢病毒滴度测定,制备完成后重组慢病毒在-80℃下保存。
1.2.2建模 随机选取40只小鼠中的10只作为正常组,另外30只小鼠建立参照Ahemed等〔4〕研究实验中腹腔注射阿霉素的方法建立慢性心力衰竭大鼠模型,将阿霉素配制成2 mg/ml的溶液连续6 w注射于大鼠腹腔(4 mg/kg),使用10%水合氯醛注射于大鼠腹腔进行麻醉处理,之后使得大鼠仰卧在操作台上,并作固定,剃除大鼠胸前区毛发,测定心脏左室射血分数(LVEF),当LVEF<60%时则表示慢性心力衰竭大鼠模型建立成功。将建模成功的30只慢性心力衰竭大鼠随机分为模型组、下调组、上调组各10只。在建模成功后,将10 μl重组的LV-SERCA2a慢病毒悬液(病毒滴度为108TU/ml)在无菌环境下注射至上调组大鼠心脏中,将10 μl LV-SERCA2a(抑制载体)慢病毒悬液(病毒滴度为108TU/ml)在无菌环境下注射至下调组大鼠心脏中,正常组、模型组大鼠不做任何处理。
1.2.3样本采集 采用断头法处死,立即取大鼠心肌组织,将提取的组织制作标本,使用40 ml/L的多聚甲醛进行固定,常温下使用15%的乙二胺四乙酸二钠(EDTA)脱钙,脱水后进行石蜡包埋,制作3 μm的组织切片,每组各7份心肌组织样本。其中1份心肌组织样本作病理组织学观察;取其中4份心肌组织,剪碎放置于器皿中,之后将5 ml 25%的胶原酶Ⅱ加入,将心肌细胞分离出待用;另外2份作后续研究指标检测。
1.2.4病理组织学观察 取1份心肌组织样本后行苏木素-伊红(HE)染色处理,之后使用显微镜观察大鼠心肌组织病理变化。
1.2.5心功能检测 使用10%水合氯醛注射于各组剩余2只大鼠腹腔行麻醉处理,待麻醉后剃除大鼠局部毛发,使用高分辨率小动物超声系统对四组大鼠左心室舒张、收缩末内径(LVEDD、LVESD)、LVEF及左心室短轴缩短率(FS),测量连续完整的4个心动周期,取平均值。
1.2.6血流动力学检测 在大鼠心功能检测后,将右侧颈动脉分离出,行气管插管,之后气管通过压力传感器和多导生理监护仪相连接,当波形稳定后逆行将导管插入大鼠左心室,对四组大鼠左心室收缩、舒张末压(LVESP、LVEDP)及左心室内压上升、下降速率(±dp/dt)。
1.2.7心肌细胞中Ca2+浓度检测 取2份分离出的心肌细胞放置于温度为37℃水中行水浴处理,之后使用钙荧光染料(Fluo/AM)避光孵育,孵育时间为1 h,之后在转速为3 000 r/min的离心机中离心处理1 min,去除负载液,并使用生理记录液反复洗涤3次。使用激光共聚焦显微镜对形态完成、染色效果较好的细胞进行扫描,心肌细胞中荧光值(钙离子浓度)测定:激发波长为488 nm、发射波长为520 nm。之后使用计算机将图像处理,得到细胞内分布图。最后经过系统分析、换算出心肌细胞中Ca2+浓度。
1.2.8心肌细胞凋亡检测 使用TUNEL法检测大鼠心肌细胞凋亡数量,TUNEL阳性细胞形态学表现为细胞胞体变小,细胞核固缩,染色质凝聚,呈现为黄褐色或者黄色颗粒,出现明显的为凋亡细胞凋亡特征。
1.2.9蛋白检测 使用Western印迹检测四组大鼠心肌组织中受磷蛋白(PLB)、内质网分子伴侣葡萄糖调节蛋白(GRP)78、凋亡蛋白CCAAT/增强子结合蛋白同源蛋白-磷酸化的c-Jun氨基末端激酶-半胱氨酸天冬氨酸蛋白酶(CHOP-p-JNK-Caspase)-12通路蛋白表达量,将采集到的标本,研磨后加入蛋白缓冲液,进行常规蛋白提取,采取二喹啉甲酸(BCA)法进行定量分析。50 μg的蛋白样品上样后十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),通过蛋白电转到聚偏氟乙烯(PVDF)膜,使用5%的脱脂奶粉TBST中进行避光封闭1 h,洗涤之后加入一抗稀释溶液(PLB、GRP78、CHOP、p-JNK、Caspase-12按照1∶1 000比例进行稀释),在4℃的环境中过夜保存,洗涤后加入二抗稀释溶液(PLB、GRP78、CHOP、p-JNK、Caspase-12按照1∶5 000比例进行稀释),在温床中孵育1 h后再次洗涤,加入电化学发光液,曝光2~3次,取重叠值。使用软件分析蛋白条带灰度值。设置内参蛋白为是GAPDH。
1.3统计学处理 采用SPSS19.0软件进行F检验、t检验。
2 结 果
2.1各组大鼠心肌病理组织学观察 正常组大鼠心肌纤维结构清晰、排列整齐,可见有心肌细胞呈圆形,心肌无萎缩、坏死、炎细胞浸润,病理分级为0级。模型组大鼠心肌纤维结构模糊,排列不规则、紊乱,出现心肌纤维萎缩、液化性溶解及断裂等,细胞核固缩,心肌间质可见有增生的结缔组织和炎细胞浸润,病理分级为Ⅱ级。下调组大鼠心肌结构模糊,排列混乱,心肌出现萎缩、纤维化现象,心肌纤维断裂,血管壁增厚,病理分级为Ⅱ~Ⅲ级。上调组大鼠心肌排列相比模型组和下调组稍微规整,无较为明显可见的心肌萎缩、坏死等病理性改变,心肌间质无水肿,但存在轻度的结缔组织增生,病理分级为Ⅰ级。见图1。
2.2各组心功能比较 与正常组相比,模型组、下调组、上调组大鼠LVEDD明显升高,LVEDD、LVEF、FS明显降低(P<0.05);与模型组相比,下调组大鼠LVEDD明显升高,LVEDD、LVEF、FS明显降低,上调组大鼠LVEDD明显降低,LVEDD、LVEF、FS明显升高(P<0.05);与下调组相比,上调组大鼠LVEDD明显降低,LVEDD、LVEF、FS明显升高(P<0.05)。见表1。
2.3各组血流动力学比较 与正常组相比,模型组、下调组、上调组大鼠LVEDP明显升高,LVESP、+dp/dt、-dp/dt明显降低(P<0.05);与模型组相比,下调组大鼠LVEDP明显升高,LVESP、+dp/dt、-dp/dt明显降低,上调组大鼠LVEDP明显降低,LVESP、+dp/dt、-dp/dt明显升高(P<0.05);与下调组相比,上调组大鼠LVEDP明显降低,LVESP、+dp/dt、-dp/dt明显升高(P<0.05)。见表2。
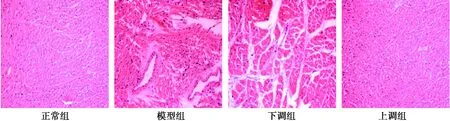
图1 各组大鼠心肌病理组织学观察(HE,×200)
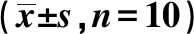
表1 各组心功能比较
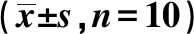
表2 各组血流动力学比较
2.4各组心肌细胞凋亡情况比较 与正常组〔(0.35±0.07)%〕相比,模型组、下调组、上调组大鼠心肌细胞凋亡率明显升高〔(17.56±3.12)%、(20.12±5.24)%、(9.45±2.01)%,P<0.05〕;与模型组相比,下调组大鼠心肌细胞凋亡率明显升高,上调组大鼠心肌细胞凋亡率明显降低(P<0.05);与下调组相比,上调组大鼠心肌细胞凋亡率明显降低(P<0.05)。见图2。

图2 各组心肌细胞凋亡情况比较(TUNEL,×200)
2.5各组心肌细胞中Ca2+浓度、心肌组织中PLB、GRP78、CHOP-JNK-Caspase-12通路蛋白表达量比较 与正常组相比,模型组、下调组、上调组大鼠心肌细胞中Ca2+浓度、心肌组织中GRP78、CHOP、p-JNK、Caspase-12蛋白表达明显升高,PLB蛋白表达明显降低(P<0.05);与模型组相比,下调组大鼠心肌细胞中Ca2+浓度、心肌组织中GRP78、CHOP、p-JNK、Caspase-12蛋白表达明显升高,PLB蛋白表达明显降低,上调组大鼠心肌细胞中Ca2+浓度、心肌组织中GRP78、CHOP、p-JNK、Caspase-12蛋白表达明显降低,PLB蛋白表达明显升高(P<0.05);与下调组相比,上调组大鼠心肌细胞中Ca2+浓度、心肌组织中GRP78、CHOP、p-JNK、Caspase-12蛋白表达明显降低,PLB蛋白表达明显升高(P<0.05)。见表3,图3。
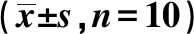
表3 各组心肌细胞中Ca2+浓度、心肌组织中PLB、GRP78、CHOP-JNK-Caspase-12通路蛋白表达比较

图3 Western印迹检测各组心肌组织中PLB、GRP78、CHOP-p-JNK-Caspase-12通路
3 讨 论
慢性心力衰竭发生的主要病理机制为肌浆网Ca2+调控障碍,因此通过对SERCA2a基因进行传导来对肌浆网Ca2+调控障碍改善目前已经成为目前临床上慢性心力衰竭基因治疗靶点〔5,6〕。
心肌收缩过程中的Ca2+其主要来源为心肌肌浆网(SR),SR上的钙泵将存在于心肌细胞胞质中的Ca2+重新摄回存储,为下次心肌收缩提供钙〔7〕。在正常机体状态下SERCA2a主要存在于心肌、骨骼肌慢肌纤维中,当胞质中的Ca2+浓度显著增加后会活SERCA2a,最终将细胞胞质Ca2+摄入SR中〔8,9〕。当慢性心力衰竭发生后会导致心肌组织中SERCA2a蛋白表达量降低,影响SERCA2a功能障碍,进而影响SR摄取Ca2+障碍,导致心肌细胞胞质中的Ca2+浓度降低,对心肌收缩期的Ca2+释放产生影响,最终导致心肌收缩功能发生障碍〔10~12〕。本研究结果说明上调SERCA2a基因可在一定程度上提高心肌细胞中Ca2+浓度,改善慢性心力衰竭大鼠心肌收缩、舒张功能,最终改善大鼠心功能。
根据目前临床上现有的研究〔13〕显示,上调SERCA2a基因对心肌衰竭的作用途径较多,一方面通过上调SERCA2a基因可增加大鼠心肌组织中SERCA2a活性和表达,直接对慢性心力衰竭大鼠心肌收缩、舒张功能进行改善;另一方面通过上调SERCA2a基因可改善心肌衰竭的能量代谢,进而降低心肌细胞的耗氧量;此外,上调SERCA2a基因可减弱心肌细胞凋亡、重构、肥厚等。目前研究认为导致心功能不全和心肌衰竭较为重要的因素为心肌细胞凋亡〔14~16〕。心肌内质网应激介导的细胞凋亡有多种途径,目前已被证实在缺血性心脏病和心力衰竭中的有着重要的作用〔17,18〕。心肌内质网应激介导细胞凋亡的途径较多,在多种凋亡途径中,主要内质网特异性途径,包括CHOP-JNK-Caspase-12通路〔19〕。当心肌内质网应激介导细胞凋亡发生后会诱导CHOP的高表达,属于心肌内质网应激介导细胞凋亡中的特异性转录因子;Caspase家族中的成员较多,目前临床上将其分为凋亡起始因子和执行因子,其中Caspase-12在内质网中所产生,属于内质网中所特有的因子,在内凋亡途径和外凋亡途径中均不会被降解,属于心肌内质网应激介导细胞凋亡中的关键因子,仅在心肌内质网应激介导细胞凋亡时被激活〔19,20〕。本研究结果提示,上调SERCA2a基因可能时通过抑制心肌内质网应激介导的CHOP-JNK-Caspase-12凋亡信号通路,起到改善大鼠心肌功能的作用。
综上,上调SERCA2a可有效改善慢性心力衰竭大鼠心功能,其机制可能和抑制心肌内质网应激相关的心肌凋亡有关。

