人脐带间充质干细胞对高浓度葡萄糖诱导的人视网膜色素上皮细胞自噬水平的影响及其机制
闫 瑾,李 蓉,王 莉,张桂鸥,杨 扬,刘文兰,朱 丹
(1 西安医学院医学技术学院眼视光教研室,西安 710021;2 西安医学院第一附属医院眼科;3 空军军医大学西京医院眼科,全军眼科研究所;*通讯作者,E-mail:rechelrong198222@163.com)
1 材料与方法
1.1 材料
经产妇本人及家属签署脐带用于实验研究的知情同意书后,取2018-2019年出生的健康足月婴儿脐带。人ARPE-19株(武汉普诺赛生命科技有限公司);DMEM培养基、0.25%胰蛋白酶及胎牛血清(美国Gibco公司);兔多抗自噬标志性蛋白微管相关蛋白1轻链3(microtubule-related protein 1 light chain 3,LC3)B(Ab48394)、兔单抗CD90(ab133350)(英国abcam公司);兔多抗Beclin-1(3495S)、兔多抗p-mTOR(5536)(美国CST公司);兔多抗P62(AF5384,美国Affinity Biosciences公司);兔多抗mTOR(20657-1-AP,武汉三鹰生物技术有限公司);兔多抗GAPDH(AB-P-R 001,杭州贤至生物有限公司);HRP标记羊抗兔二抗(BA1054,武汉博士德生物工程有限公司);噻唑兰MTT(3580MG250,德国BIOFROX公司);人VEGF ELISA试剂盒(Human VEGF-A ELISA Kit E-EL-H0111c武汉伊莱瑞特生物科技股份有限公司);FACS-Calibur流式细胞仪(美国Becton Dikinson公司);倒置相差显微镜(日本Nikon公司,型号ECLIPSE Ts2);微型高速离心机(美国Labnet公司,型号C2500-R-230V);全自动酶标仪(美国Thermo scientific公司,型号mμlISKANMK3);透射电子显微镜(日本HITACHI公司,型号HT7700-SS)。
1.2 方法
1.2.1 hUCMSCs的分离、培养和鉴定 组织块贴壁法分离培养hUCMSCs[14]。组织块附着后添加含10%胎牛血清的DMEM/F12培养基,每隔3 d换液,待细胞融合达80%-90%时,用0.25%胰蛋白酶消化传代,比例为1 ∶3。hUCMSCs细胞传代至第3代,参照文献[15]的方法,胰酶消化,PBS重悬,按照使用说明书加入小鼠抗人CD90单克隆抗体,避光孵育后流式细胞仪检测。
1.2.2 细胞培养及分组 选用DMEM/F12(含10% FBS+1%青霉素和链霉素)培养液,在37 ℃、5% CO2及饱和湿度条件下培养ARPE-19细胞,实验选用处于对数生长期的第5-10代细胞,按照5.0×105个/孔传代于6孔板内,随机分为对照组(PBS)、高糖组(25 mmol/L D-glucose)和高糖+hUMSCs组。高糖+hUMSCs组使用Transwell实现hUMSCs与ARPE-19细胞的非接触共培养,在ARPE-19细胞培养基中加入25 mmol/L D-glucose接种于上室,hUMSCs接种于下室,三组培养时间均为48 h。
1.2.3 MTT法检测ARPE-19细胞增殖率 使用微量酶比色法测定试剂盒,根据说明书检测ARPE-19细胞增殖率。细胞增殖率(%)=(实验组平均OD值-空白孔平均OD值)/(对照组平均OD值-空白孔平均OD值)×100%。
1.2.4 透射电子显微镜下观察自噬体的形成 刮取各组细胞,戊二醛固定2 h,充分漂洗后,在质量分数为1%锇酸中4 ℃固定,脱水,包埋。在裸铜网格上制备超薄切片,铀铅双染色,透射电子显微镜下观察自噬体形态、结构及数量,拍照。
1.2.5 Western blot法检测各组ARPE-19细胞中自噬蛋白LC3B、Beclin-1、P62和信号通路蛋白mTOR、p-mTOR的表达 收集各组细胞裂解充分后,离心提取总蛋白,BCA法蛋白定量。蛋白上样,SDS-PAGE凝胶电泳,转膜,封闭,滴加一抗,一抗稀释浓度如下:LC3B(1 ∶1 000)、Beclin-1(1 ∶1 000)、P62(1 ∶1 000)、mTOR(1 ∶500)、p-mTOR(1 ∶1 000)、GADPH(1 ∶1 000),辣根过氧化物酶标记的羊抗兔二抗(1 ∶50 000)孵育。暗室显影,依据胶片灰度值,与内参GAPDH比较计算出LC3B-Ⅱ/LC3B-Ⅰ比值及Beclin-1、P62、mTOR、p-mTOR的蛋白相对表达量,每组3次生物学重复,取平均值。
1.2.6 ELISA法检测ARPE-19细胞血管内皮生长因子(vascular endothelial growth factor,VEGF)蛋白表达 按照使用说明,采用人VEGF酶联免疫吸附试验试剂盒检测ARPE-19细胞上清液中VEGF蛋白浓度。酶标仪测量OD450值。应用直线相关回归分析,在标准曲线上查出待测样本对应的VEGF浓度。
1.3 统计学方法

2 结果
2.1 hUCMSCs的形态观察及鉴定
使用倒置显微镜观察脐带华通氏胶组织(Wharton jelly)贴壁培养的第3代hUCMSCs细胞呈长梭形或纺锤形,形态均一,紧密排列,类似纤维细胞,集落生长,细胞分布呈鱼群状或漩涡状(见图1A)。流式细胞仪检测结果显示,hUCMSCs阳性表达标志蛋白CD90(见图1B)。
对照组使用常规心电图进行检查,选择本院现有的设备对患者实施监测,准确记录各项检查指标与结果。研究组使用多普勒超声联合心电图检查,将探头的频率设定在2.0~4.0MHz之间,由经验丰富的医生进行操作,指导患者调整呼吸,采用左侧卧位姿势,将心脏探头放置于患者的左侧胸骨旁,详细观察患者的胸骨旁左室、二腔心、心脏各个节段室壁运动状态、厚度以及彩色多普勒血流状态等[1],同时对患者的心率以及心室血流等指标进行记录。多普勒超声心动图诊断标准为:患者发生节段性的室壁运动异常,心肌梗死区域节段的心室壁运动明显减弱或者消失;梗死区域节段的室壁厚度下降,有明显的心肌异常回声,呈现增强或者减弱,心内膜的回声断裂。

图1 hUCMSCs的形态观察及鉴定Figure 1 Morphology and identification of hUCMSCs
2.2 细胞中自噬体超微结构的观察
透射电子显微镜下可见典型的自噬体为包裹了蛋白质及细胞器等吞噬物的小囊泡,具备双层膜结构。电镜检查显著反映了高糖环境及hUMSCs对ARPE-19细胞自噬活性的影响,对照组细胞中仅见少量自噬体,高糖组及高糖+hUMSCs组细胞中自噬体数量明显增多,而高糖+hUMSCs组细胞中自噬体数量较高糖组减少(见图2)。

图2 hUMSCs对高糖条件下ARPE-19细胞内自噬体形成的影响 (×8 000,bar=1.0 μm)Figure 2 Effect of hUMSCs on the autophagosomes formed in ARPE-19 cells under the condition of high glucose (×8 000,bar=1.0 μm)
2.3 hUMSCs对高糖条件下ARPE-19细胞增殖的影响
MTT法检测结果显示,各组ARPE-19细胞增殖率总体比较差异有统计学意义(F=73.952,P=0.000)。与对照组相比,高糖组和高糖+hUMSCs组细胞增殖率降低(均P=0.000),但高糖+hUMSCs组细胞增殖率高于高糖组(P=0.007,见图3)。
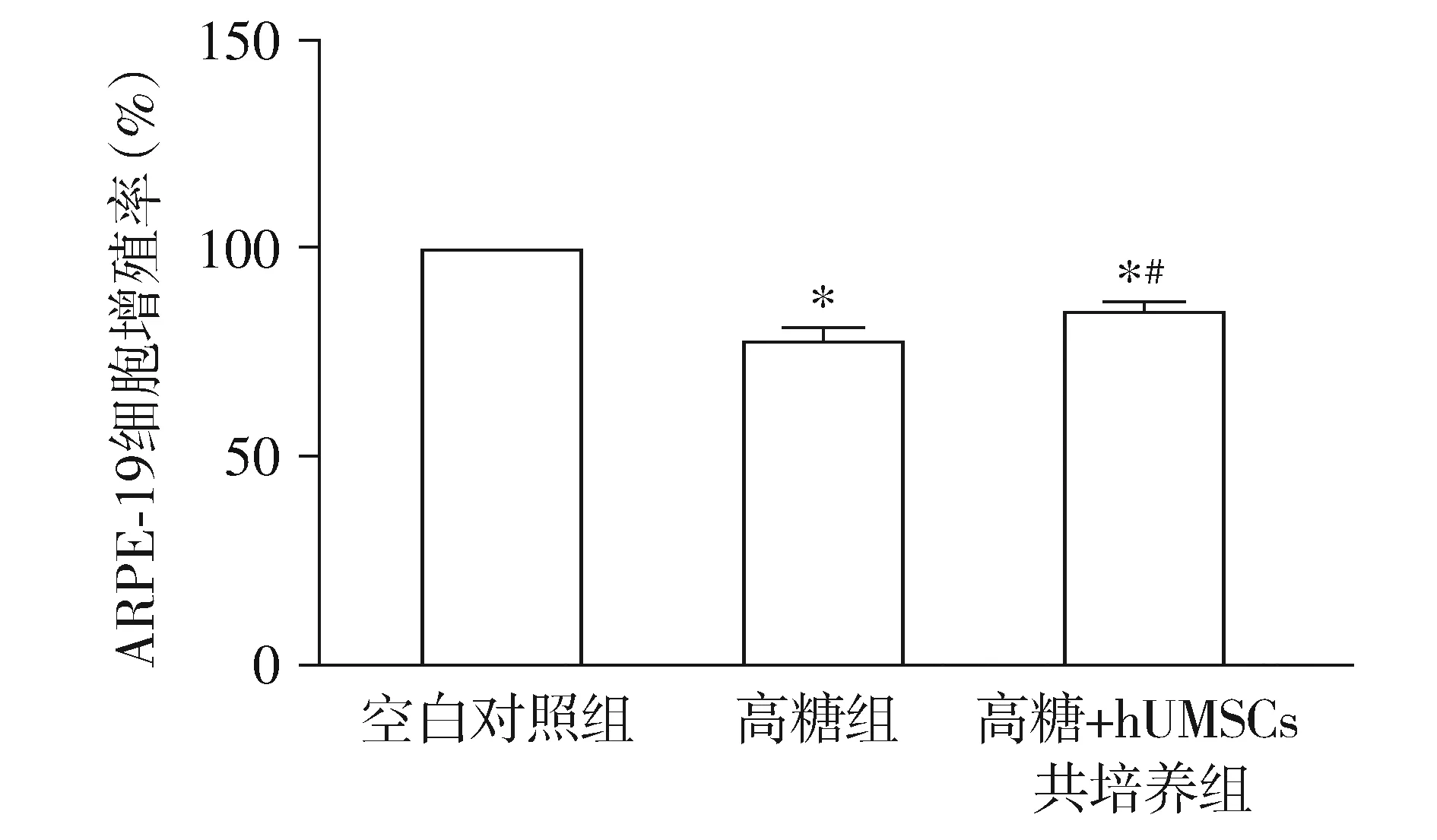
与对照组比较,* P <0.05;与高糖组比较,#P <0.05图3 hUMSCs能够提高高糖条件下的ARPE-19细胞增殖率Figure 3 HUMSCs increases the proliferation rate of ARPE-19 cells under the condition of high glucose
2.4 hUMSCs对ARPE-19细胞在高糖条件下LC3B-Ⅱ/Ⅰ比值和Beclin-1、P62蛋白相对表达量的影响
蛋白免疫印迹法检测结果显示,与对照组相比,高糖组ARPE-19细胞的LC3B-Ⅱ/Ⅰ比值和Beclin-1蛋白条带明显增强,P62蛋白表达降低,自噬活性明显升高。相较于高糖组,ARPE-19细胞与hUMSCs共培养后,LC3B-Ⅱ/Ⅰ比值及Beclin-1的蛋白表达减弱,P62的表达明显增强(见图4)。
三组间ARPE-19细胞的LC3B-Ⅱ/Ⅰ值、Beclin-1和P62蛋白的相对表达总体比较差异均有统计学意义(LC3B-Ⅱ/LC3B-Ⅰ:F=33.511,P=0.001;Beclin-1:F=86.791,P=0.000;P62:F=69.984,P=0.000)。高糖组和高糖+hUMSCs组细胞中LC3B-Ⅱ/Ⅰ值和Beclin-1蛋白的相对表达相较于对照组显著增加(均P<0.05);高糖+hUMSCs组细胞中LC3B-Ⅱ/Ⅰ值和Beclin-1蛋白的相对表达相较于高糖组显著减少,差异均有统计学意义(均P<0.01)。高糖组和高糖+hUMSCs组细胞中P62的相对蛋白表达相较于对照组显著降低(均P<0.05),高糖+hUMSCs组P62蛋白的相对表达相较于高糖组显著增加,差异有统计学意义(P=0.001,见图5)。
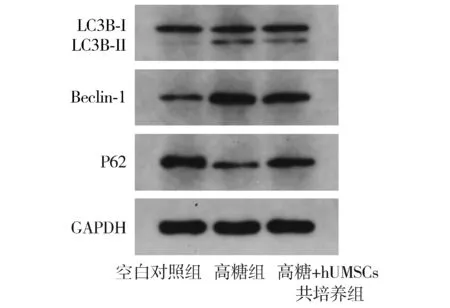
图4 各组细胞中LC3B、Beclin-1和P62的表达情况Figure 4 Expression of LC3B,Beclin-1 and P62 in the three groups
2.5 hUMSCs对ARPE-19细胞在高糖条件下mTOR和p-mTOR蛋白表达量的影响
蛋白免疫印迹检测显示,高糖组p-mTOR蛋白条带的灰度相较于对照组明显减弱,高糖+hUMSCs组p-mTOR蛋白的表达较高糖组明显增强(见图6)。对照组、高糖组和高糖+hUMSCs组细胞中的mTOR蛋白相对表达分别为0.521±0.022,0.549±0.026和0.523±0.029,组间总体比较差异无统计学意义(均P>0.05);磷酸化蛋白p-mTOR蛋白相对表达为0.150±0.008,0.047±0.009和0.088±0.15,组间总体比较差异均有统计学意义(F=64.895,P=0.000)。高糖组和高糖+hUMSCs组中p-mTOR相对表达低于对照组,差异均有统计学意义(均P<0.05),高糖+hUMSCs组的p-mTOR表达高于高糖组,差异有统计学意义(P<0.05,见图6)。
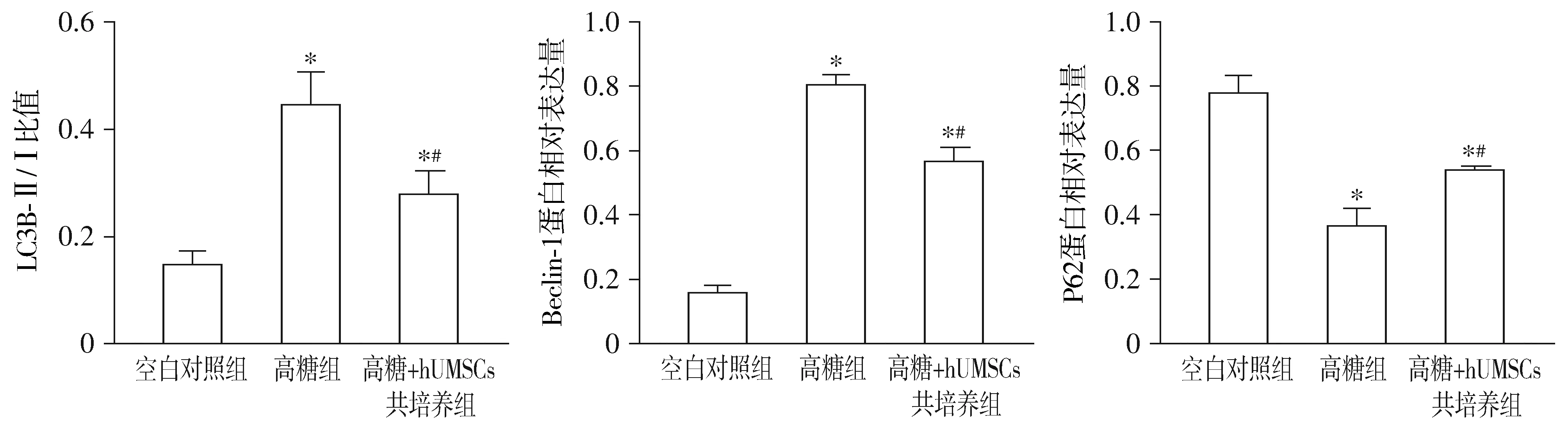
与对照组比较,* P <0.05;与高糖组比较,#P <0.01图5 hUMSCs对高糖条件下ARPE-19细胞LC3B-Ⅱ/Ⅰ、Beclin-1和P62相对蛋白表达的影响Figure 5 Effect of hUMSCs on the expression of LC3B,Beclin-1 and P62 in ARPE-19 cells under the condition of high glucose
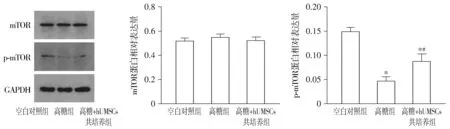
与对照组比较,* P <0.05;与高糖组比较,#P <0.05图6 hUMSCs对高糖条件下ARPE-19细胞mTOR和p-mTOR蛋白表达的影响Figure 6 Effect of hUMSCs on the expression of mTOR and p-mTOR in ARPE-19 cells under the condition of high glucose
2.6 hUMSCs对高糖条件下ARPE-19细胞上清液中VEGF含量的影响
酶联免疫吸附试验显示,对照组、高糖组、高糖+hUMSCs组ARPE-19细胞上清液中VEGF的含量分别为(46.67±7.09)ng/L,(154.43±13.51)ng/L和(88.24±15.37)ng/L,整体比较差异有统计学意义(F=56.669,P=0.000)。相较于对照组,高糖+hUMSCs组和高糖组VEGF的浓度明显升高(均P<0.01),高糖+hUMSCs组细胞VEGF含量低于高糖组(P=0.001,见图7)。

与对照组比较,* P <0.01;与高糖组比较,#P =0.001图7 hUMSCs能够降低ARPE-19细胞中VEGF的表达Figure 7 HUMSCs inhibits the content of VEGF protein in ARPE-19 cells under the condition of high glucose
3 讨论
RPE层位于视网膜的最外层,为单层色素细胞,主要功能包括:维持光感受器的新陈代谢、吸收光线、抗氧化、为视网膜外层提供营养、参与视觉循环和分泌细胞因子等,对维持视网膜光感受器微环境有重要作用。长期处于高血糖环境会诱发RPE细胞出现缺血、氧化应激、炎症激活等病理改变,影响其结构和功能,同时RPE细胞分泌的各种细胞因子在DR发生发展过程中起到重要作用[16]。其中VEGF会使视网膜血管内皮细胞间的紧密连接蛋白表达降低,破坏视网膜内屏障,增加血管通透性,参与血管炎症反应,还可以促进血管内皮细胞分裂增殖,形成管腔,是促进新生血管形成的关键因子[17,18]。间充质干细胞(mesenchymal stem cells,MSCs)是存在于骨髓、脂肪和脐带华通氏胶等多种组织中的,来源于中胚层的一类干细胞,具备多向分化潜能[19],MSCs具有不易引起免疫反应、可体外分离连续传代培养等优势[20]。hUMSCs来源于人脐带中的华通氏胶组织,易于大量获得。本研究成功提取并体外培养了hUMSCs,流式细胞仪鉴定结果显示其高表达间质细胞标志CD90,符合MSCs表面标志物鉴定标准[15]。在DR的治疗中,hUMSCs具有减轻视网膜水肿,营养和保护视网膜神经的功能,也可以对视网膜血管内皮细胞起免疫调节作用[6-8]。大量的实验研究发现,MSCs的修复和抗炎作用能够通过旁分泌这一形式实现[21-25],我们在Transwell中建立hUMSCs和ARPE-19细胞间接共培养体系,结果显示,高糖环境明显降低ARPE-19细胞增殖率,调高VEGF的蛋白表达水平,与hUMSCs共培养后细胞的增殖率升高,有效降低VEGF水平,对高糖损伤的RPE细胞有显著的保护作用。
生理状态下细胞内的自噬水平维持在一定的较低水平,对细胞的代谢、增殖、生长、分化、修复以及活性的维持都起到重要作用[9,26,27]。在自噬这一动态过程的不同阶段中,相关特异性基因编码的20多种蛋白起相互协同作用。LC3在主导自噬小体的双膜延伸过程时,通过半胱氨酸蛋白酶活化为胞浆中的LC3-Ⅰ,再与磷脂酰乙醇胺偶联生成锚定于自噬小体内外膜上的脂质型LC3-Ⅱ,在自噬体被溶酶体降解前能够较稳定地存在,因此LC3-Ⅱ与LC3-Ⅰ的转化比例值能较好反映自噬情况[28-30],LC3存在多种不同类型,目前自噬的蛋白标记物常选用LC3B。Beclin-1收集来自高尔基体、内质网等细胞器的细胞内源性双膜成分,在自噬体形成的过程中负责双膜结构起始段的合成[31],因此Beclin-1蛋白表达量也是检测自噬水平的常用标记物。P62是自噬溶酶体膜相关标记蛋白,参与大分子物质降解过程,其表达与自噬水平负相关,在自噬过程中主要介导底物识别,因此当自噬反应激活清除细胞内的蛋白质时会被优先降解,从而导致其表达水平降低[32,33]。本研究采用蛋白免疫印迹法检测LC3B的切割情况、Beclin-1的蛋白相对表达量及P62的降解程度,三项结果共同检测RPE细胞的自噬水平。目前认为检测自噬情况的金标准是电子显微镜观察到自噬小体的特征性双层膜结构[28],但在自噬发生的不同动态阶段中,会产生与自噬小体形态类似的自噬溶酶体和自噬内涵体,在未做特殊标记的情况下,很难准确区分这些结构。此外在不同切面的切片中观察到的自噬小体数量差别较大,会导致电镜检测结果产生误差。因此本文采用自噬标志性蛋白检测和电镜观察两种方式,综合分析细胞内的自噬水平,确保实验结果的准确性和严谨性。本研究中高糖环境下RPE中自噬体增加,LC3B-Ⅱ/Ⅰ,Beclin-1蛋白表达增加,而P62表达下降,细胞的自噬被激活,与既往研究结果一致[13],hUMSCs可使自噬体减少,细胞表达LC3B-Ⅱ/Ⅰ,Beclin-1蛋白下降,P62水平增加。
mTOR是细胞内一类丝/苏氨酸蛋白激酶,在细胞的生长合成、代谢增殖、衰老、凋亡及自噬中表现出重要的调节作用[34]。mTOR是自噬调节经典通路PI3K/AKT/mTOR的关键信号蛋白[35],同时对溶酶体功能也能起到调节作用[36]。mTOR能调控自噬过程的开始和自噬体形成[37],介导溶酶体合成[38]和自噬性溶酶体再生[39],调节溶酶体细胞内分布[40],因此mTOR参与了自噬的整个动态过程。为了研究hUMSCs减轻高糖诱导的RPE细胞自噬的机制,本研究进一步检测了三组细胞中mTOR蛋白的磷酸化水平。结果表明,mTOR蛋白在hUMSCs对高糖环境下RPE细胞自噬的影响中扮演重要角色。高糖组p-mTOR水平显著下降,hUMSCs共培养可上调其表达,从而负向调控RPE细胞自噬,降低自噬水平。
综上所述,本研究提示hUMSCs对高糖环境下RPE细胞自噬的影响与其对mTOR信号蛋白活性的调节有关,hUMSCs通过激活mTOR抑制高糖条件下ARPE-19细胞的自噬水平,下调VEGF的表达,对RPE细胞起到保护作用。但mTOR蛋白参与了多条调控自噬的信号通路,hUMSCs通过何种通路调节自噬,及其在体内对自噬水平的影响还需后续研究来明确。

