环状RNA circAKT3对骨肉瘤细胞生物学行为的影响
张开亮,韩 康,陈 明,信 波,李大河
(1 解放军第960医院泰安医疗区骨科,泰安 271000;2 空军军医大学唐都医院骨科;3 解放军第960医院济南医疗区骨科;4 解放军第960医院泰安医疗区肿瘤科;*通讯作者,E-mail:bzmcldh@163.com)
作为最常见的恶性骨肿瘤之一,骨肉瘤主要发生于儿童和青少年[1,2]。骨肉瘤具有高度侵袭性,很容易出现早期转移[3]。近年来,虽然新辅助疗法和辅助化疗已在临床中广泛使用,但是仍不能完全抑制肿瘤的生长,使骨肉瘤的死亡率依然处于较高水平[4]。因此,在针对骨肉瘤的治疗中,迫切需要发掘新的治疗手段和靶点。
环状RNA(circular RNA, circRNA)是一类新的非编码RNA分子,其广泛存在于真核细胞的细胞质中[5]。不同于线性RNA分子,circRNA作为环状闭合分子,具有高度的稳定性[6]。circRNA具有多种功能,例如调节剪接和转录,结合蛋白以及转运RNA[7,8]。最近的研究表明,众多circRNA在多种肿瘤中表达异常,且其异常表达与肿瘤的进展密切相关,在肿瘤中充当癌基因或抑癌基因[9]。作为circ-RNA家族中的一份子,circAKT3可促进胃癌和肺癌的进展[10,11]。在之前的研究中,我们在细胞层面证实,circAKT3可促进骨肉瘤U2OS细胞的增殖和抑制细胞凋亡[12]。骨肉瘤作为具有高度侵袭能力的恶性肿瘤,circAKT3是否可以抑制骨肉瘤侵袭和转移,具有重要研究意义。除了在U2OS细胞系,在其他骨肉瘤细胞系是否具有同样作用,且其在临床层面是否同样具有癌基因作用,都需要进一步去研究。本实验就以上问题进行了验证,旨在进一步明确circAKT3在骨肉瘤中的癌基因作用,也为临床骨肉瘤的治疗提供可靠有效的治疗靶点。
1 方法和材料
1.1 临床标本采集
2016年3月至2018年12月在唐都医院骨科收集42例骨肉瘤组织标本以及10例相应瘤旁组织标本,术前均征得患者同意并签署同意书,患者术前均未进行过放化疗。标本取出后,立即放入-80 ℃进行保存。
1.2 细胞系及培养条件
骨肉瘤SOSP-9607细胞系由唐都医院骨科建立,并在骨科骨肿瘤研究所进行保存[13]。U2OS细胞系购于ATCC(American type culture collection,美国模式培养物集存库)。SOSP-9607细胞系采用含有10%胎牛血清(杭州四季青公司)的RPMI-1640培养基(美国Hyclone公司)进行培养,而U2OS细胞系则采用含有10%胎牛血清的DMEM培养基(美国Hyclone公司)进行培养。所有细胞均在37 ℃、含有5% CO2浓度的饱和湿度的细胞培养箱(美国Thermo公司)内进行培养。
1.3 细胞转染及分组
根据LipofectamineTM2000的操作手册对骨肉瘤SOSP-9607和U2OS细胞的circAKT3 siRNA序列及siRNA NC(negative control)序列进行转染,转染均在6孔板(美国Corning公司)内进行。circAKT3的siRNA序列和siRNA NC序列购至广东锐博生物科技有限公司。
后续将骨肉瘤细胞分为实验组和对照组,实验组细胞转染circAKT3的siRNA序列,而对照组细胞则转染siRNA NC序列。
1.4 qRT-PCR检测骨肉瘤组织及细胞中circAKT3的表达水平
采用TRIzol溶液(美国Sigma公司)对骨肉瘤组织和细胞进行裂解,其中在SOSP-9607细胞转染效率的验证部分,在细胞转染24 h后进行裂解。在获取细胞和组织内的RNA后,采用5×All-In-One RT MasterMix试剂盒进行反转录,从而获得相应的cDNA。最后采用EvaGreen Express 2×qPCR MasterMix试剂盒进行qPCR。引物序列如下:circAKT3上游5′-TCCAAATAAACGCCTTGGTGG-3′,下游5′-CCTCAGAGAACACCCGCTCT-3′;GAPDH上游5′-CGCTCTCTGCTCCTCCTGTTC-3′,下游5′-ATCC-GTTGACTCCGACCTTCAC-3′。
1.5 CCK-8实验检测骨肉瘤细胞的增殖能力
待两组细胞转染24 h后,将细胞铺于96孔板,每孔4 000细胞,每组每个时间点铺8复孔,共铺4板,分别用于铺板后24,48,72,96 h的检测。在检测前,每孔加入10 μl CCK-8溶液(日本同仁公司),然后将孔板置于细胞培养箱1 h,最后上机检测两组细胞在450 nm波长处的光密度值(optical density,OD)。
1.6 流式细胞仪凋亡检测实验检测骨肉瘤细胞的凋亡率
采用Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒(北京索莱宝公司)进行检测。待两组细胞转染48 h后,1 ml的1×Binding Buffer重悬细胞两次,取100 μl细胞悬液加入实验管中,加入5 μl Annexin Ⅴ-FITC溶液后,室温下避光孵育10 min。每管中继续添加5 μl PI溶液,室温下避光孵育5 min。添加预冷PBS将每管补至500 μl后上机检测。
1.7 Transwell侵袭实验检测骨肉瘤细胞的侵袭能力
待Matrigel基质胶(美国BD公司)融化后,采用OPTI-MEM(美国Gibco公司)培养基进行1 ∶8稀释,然后取50 μl稀释后基质胶铺于Transwell小室(美国Corning公司)内,全程在冰上进行,铺胶后十字摇晃,以保证铺胶均匀。然后将铺胶后小室置于细胞培养箱中放置1 h,此时基质胶会发生凝固。
在细胞转染48 h后,添加相应无血清培养基离心收集6孔板内实验组和对照组细胞,计数3次,取平均值,然后将5×104细胞悬浮细胞添加至Trans-well小室内,并添加相应无血清培养基将小室内体积补至200 μl。然后在Transwell小室下孔板内添加600 μl含有20%胎牛血清的相应培养基。
在细胞培养箱培养20 h后,取出小室,棉签去除基质胶,然后采用95%乙醇固定10 min,继续采用0.5%结晶紫溶液染色5 min,最后在倒置显微镜下进行观察。
1.8 Transwell迁移实验检测骨肉瘤细胞的迁移能力
除了Transwell小室不铺Matrigel基质胶,且在细胞培养箱培养12 h后即取出小室进行观察外,余同Transwell侵袭实验。
1.9 统计学分析
实验结果采用SPSS 22.0软件(美国IBM公司)进行统计分析,并采用GraphPad Prism 7.0进行作图。计量资料采用均数±标准差表示。CCK-8实验部分结果采用two-way ANOVA检验进行分析,42例患者骨肉瘤组织中circAKT3的表达水平与骨肉瘤临床相关病理参数的相关性实验部分结果采用Fisher确切概率法进行分析,10例骨肉瘤患者肿瘤及相应瘤旁组织中circAKT3表达水平检测结果采用paired Student-t检验进行分析,余实验结果采用two-tailed Student-t检验进行分析。P<0.05被认为差异具有统计学意义。
2 结果
2.1 circAKT3的siRNA在骨肉瘤SOSP-9607细胞中转染效率的验证
qRT-PCR实验结果显示,实验组在转染circAKT3的siRNA后,其细胞内circAKT3的表达水平较对照组明显降低,差异有统计学意义(P<0.001,见图1),说明转染有效,可以用于后续实验。
2.2 抑制circAKT3的表达可抑制骨肉瘤SOSP-9607细胞的增殖能力
CCK-8结果显示,实验组在转染siRNA抑制circAKT3的表达后,其细胞在72 h和96 h的增殖能力明显降低,差异有统计学意义(P<0.05,见图2)。

与对照组比较,* * * P <0.001图1 qRT-PCR检测circAKT3 siRNA的转染效果Figure 1 The transfection efficiency of siRNA against circAKT3 detected by qRT-PCR

与对照组比较,* P <0.05,* * * P <0.001图2 CCK-8实验检测下调circAKT3对骨肉瘤细胞增殖的影响Figure 2 Effect of down-regulating circAKT3 on cell proliferation of osteosarcoma detected by CCK-8 assay
2.3 抑制circAKT3的表达可增加骨肉瘤SOSP-9607细胞的凋亡率
流式细胞仪凋亡检测实验结果显示,实验组细胞的凋亡率较对照组明显升高,差异有统计学意义(P<0.001,见图3)。
2.4 下调circAKT3表达可抑制骨肉瘤SOSP-9607和U2OS细胞的侵袭能力
Transwell侵袭实验结果表明,实验组在下调SOSP-9607和U2OS细胞内circAKT3的表达后,细胞的侵袭能力较对照组也明显降低,差异有统计学意义(P<0.01,见图4)。
2.5 下调circAKT3表达可抑制骨肉瘤SOSP-9607和U2OS细胞的迁移能力
Transwell迁移实验的结果同Transwell侵袭实验一致,较之对照组,实验组细胞的迁移能力明显降低,差异有统计学意义(P<0.01,见图5)。

与对照组比较,* * * P <0.001图3 流式细胞仪检测下调circAKT3对骨肉瘤细胞凋亡的影响Figure 3 Effect of down-regulating circAKT3 on osteosarcoma cell apoptosis detected by flow cytometry
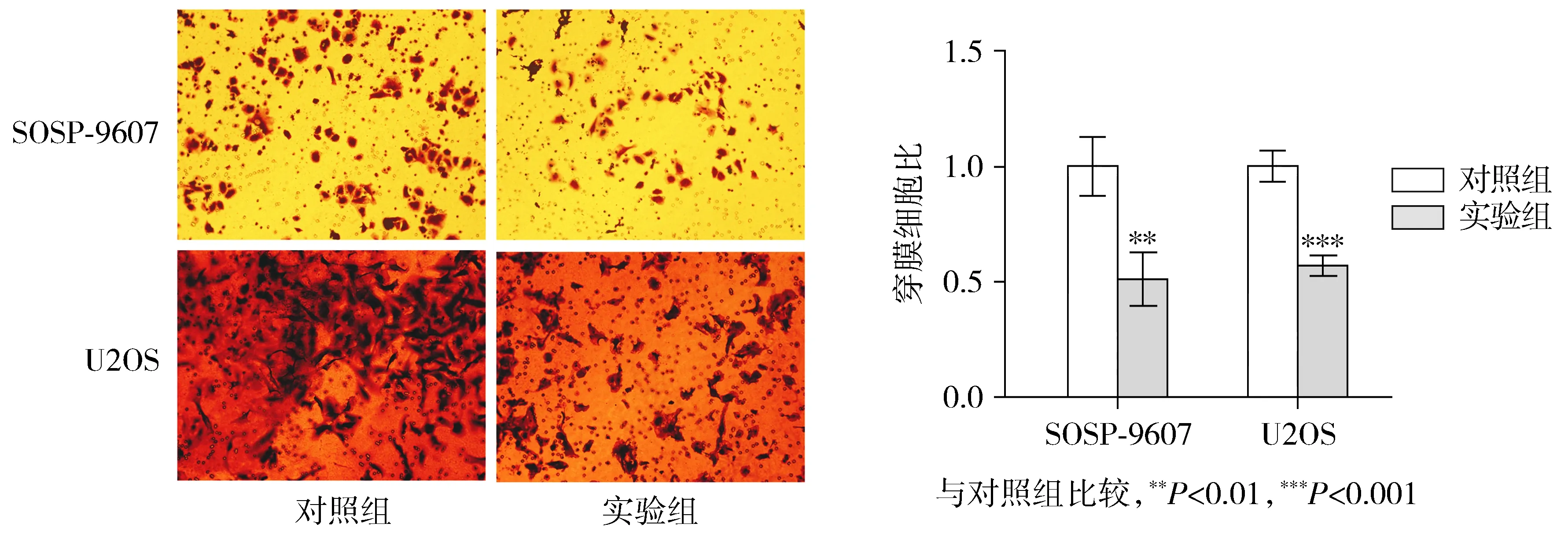
图4 Transwell侵袭实验检测下调circAKT3对骨肉瘤细胞侵袭的影响Figure 4 Effect of down-regulating circAKT3 on osteosarcoma cell invasion evaluated by Tranwell invasion assay
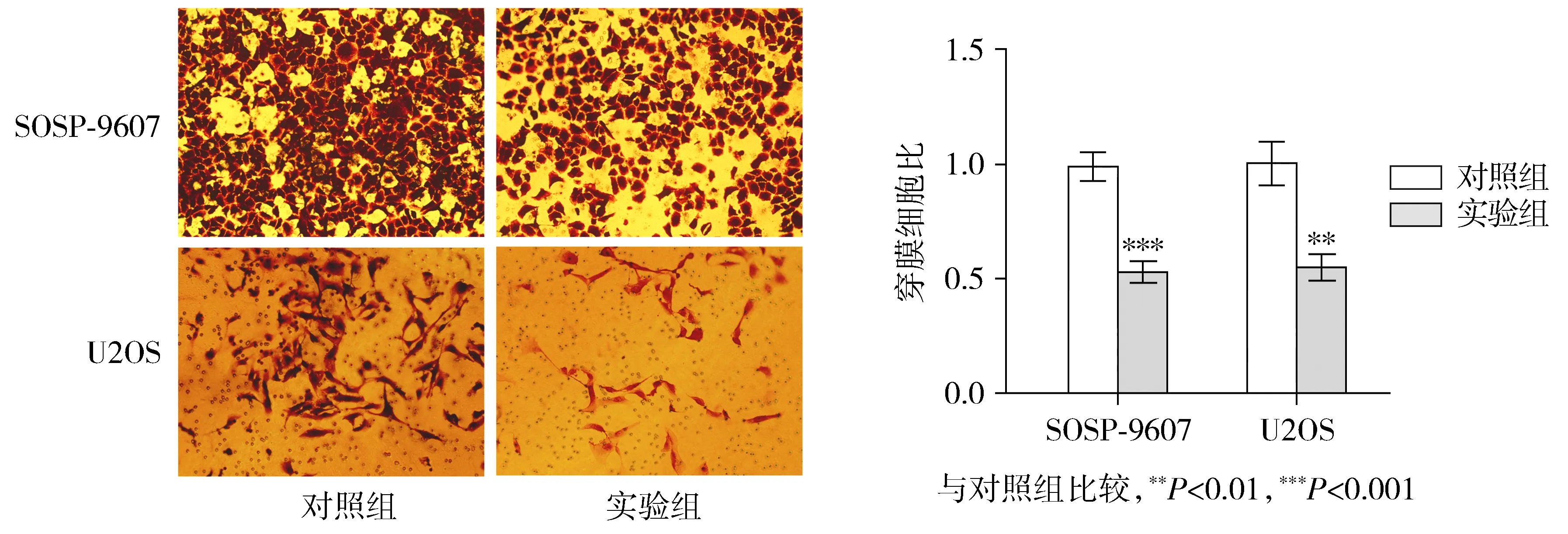
图5 Transwell迁移实验检测下调circAKT3对骨肉瘤细胞迁移的影响Figure 5 Effect of down-regulating circAKT3 on osteosarcoma cell migration evaluated by Tranwell migration assay
2.6 circAKT3在骨肉瘤组织中表达明显增高
对10对骨肉瘤组织及相应的瘤旁组织进行circAKT3表达水平进行检测,结果显示,骨肉瘤组织中circAKT3的表达水平较瘤旁组织明显升高,差异有统计学意义(P<0.01,见图6)。
2.7 circAKT3表达水平与骨肉瘤临床相关病理参数的相关性
实验选择42例骨肉瘤组织进行了circAKT3表达水平的检测,以其表达水平的平均值为标准,将其分为circAKT3高、低表达组,并分析了circAKT3的表达水平与骨肉瘤患者的年龄、性别、分期、大小及是否有转移等相关临床病理参数的关系。结果显示,circAKT3的表达水平与骨肉瘤患者的临床分期和转移呈正相关,即骨肉瘤高临床分期和发生转移患者的骨组织中circAKT3的表达水平更高(P<0.05,见表1)。

与瘤旁组织比较,* * P <0.01图6 qRT-PCR检测骨肉瘤及瘤旁组织中circAKT3的表达水平Figure 6 The expression of circAKT3 in osteosarcoma and adjacent tissues detected by qRT-PCR
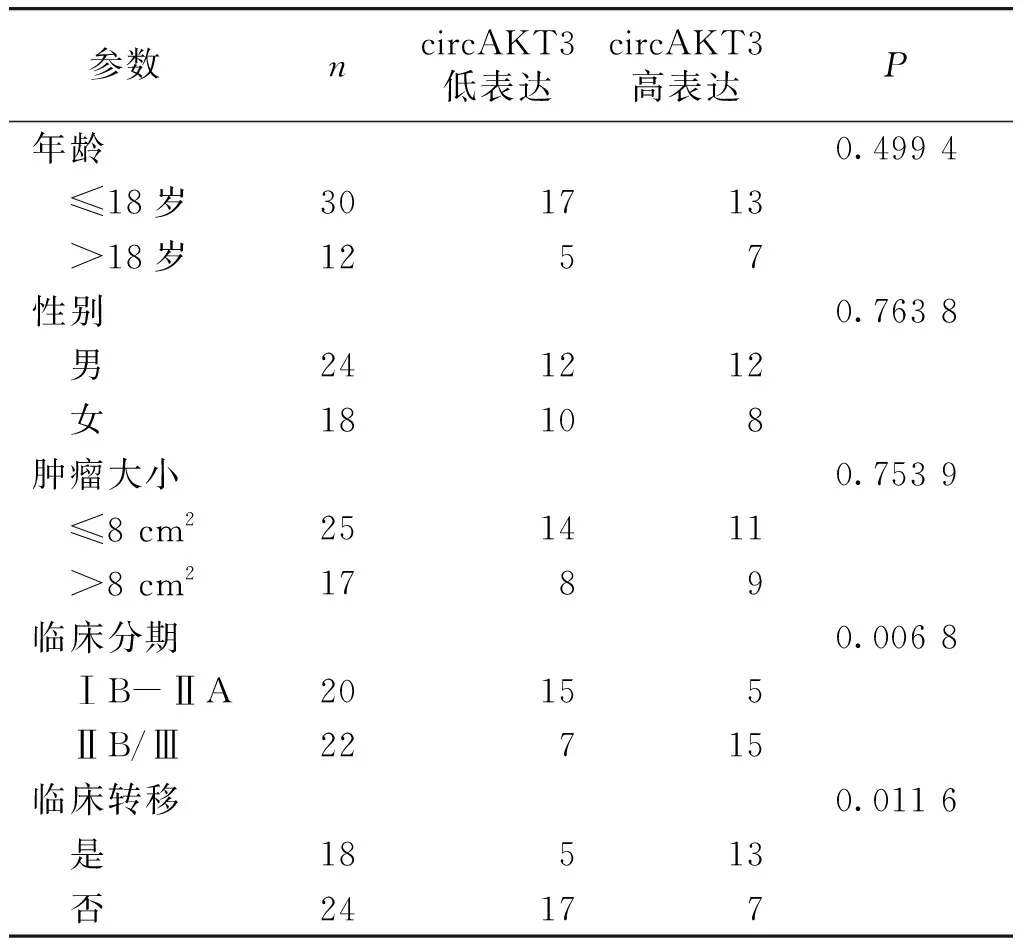
表1 骨肉瘤患者的circAKT3表达水平与临床相关病理参数的相关性
3 讨论
随着circRNA在肿瘤中的研究已成为热点,越来越多的circRNA被证实参与了肿瘤的发生和发展,成为肿瘤治疗的潜在新的靶点,为肿瘤的治疗提供了新的思路[14]。日益增多的研究表明,circRNA在骨肉瘤中同样也作为肿瘤发生和发展的重要参与者。例如,circMYO10在骨肉瘤中高表达,其作为癌基因可促进骨肉瘤增殖、侵袭和迁移[15]。此外,circ-0100876在骨肉瘤中表达被抑制,低表达的circ-0100876在骨肉瘤中作为抑癌基因可抑制骨肉瘤的恶性生物学行为[16]。而在之前的研究中,circ-AKT3被证实可促进骨肉瘤U2OS细胞的增殖和抑制细胞凋亡[12]。本实验同样证实了circAKT3可以促进SOSP-9607细胞的增殖和抑制细胞凋亡,证实了circAKT3在骨肉瘤细胞系中作用具有一定普遍性。骨肉瘤作为高度侵袭性恶性肿瘤,很多患者在就诊时已经出现转移,如何抑制骨肉瘤转移具有重要现实意义。在本实验中,我们在SOSP-9607和U2OS细胞系中证实了circAKT3可促进骨肉瘤的侵袭和迁移,是骨肉瘤促转移的参与者。综上,我们在细胞层面证实了circAKT3在骨肉瘤增殖、凋亡、侵袭和迁移等多个生物学行为中的促进作用。
除了在细胞层面,实验在临床标本层面证实了骨肉瘤中circAKT3的表达水平明显高于其瘤旁组织,同样提示了circAKT3在临床中的癌基因潜质。后续通过分析42例骨肉瘤患者组织中circAKT3的表达水平,结果表明,circAKT3的表达水平与骨肉瘤的临床分期以及转移事件的发生呈正相关,明确了circAKT3在骨肉瘤临床中的癌基因角色。需要看到的是,虽然circAKT3在细胞层面可促进细胞增殖,但是在此次临床样本统计中,其高表达与肿瘤大小的差异无明显关系。考虑其一可能是样本例数不足,未能准确反映其相关性;其二可能受骨肉瘤患者的就诊时间影响较大,以致临床很难准确反映两者的相关性。综上,临床层面的研究结果同细胞层面研究基本相一致,都证实了circAKT3在骨肉瘤中的促进作用,两者的一致性,也证实了研究的可靠性。
随着对circRNA的研究日益深入,关于其下游作用机制的研究也越发深入。大量的miRNA被证实为circRNA的下游靶点,circRNA通过海绵吸附miRNA的作用已被广泛报道。例如,circ-0060428通过海绵吸附miR-375进而解除后者对基因RBPJ的抑制作用,最终促进骨肉瘤的进展[17]。同样,circHIPK3通过作用于miR-637/STAT3轴进而促进骨肉瘤转移[18]。而circAKT3是否同其他很多circ-RNA一样存在下游miRNA,需要进一步研究。
综上,在前期研究的基础上,本实验进一步在细胞层面证实了circAKT3可促进骨肉瘤细胞的增殖、侵袭和抑制凋亡,此外,在临床标本层面中,骨肉瘤中circAKT3的表达水平与骨肉瘤的临床分期和转移事件发生呈正相关。本研究进一步证实了circAKT3在骨肉瘤中的癌基因角色,为骨肉瘤的临床治疗提供了潜在有效的治疗靶点。

