USP47通过促进抗凋亡蛋白表达介导头颈鳞癌细胞顺铂耐药
童 桐,秦 星,谢 非,蒋英英,石剑波,张建军
上海交通大学医学院附属第九人民医院·口腔医学院口腔颌面头颈-肿瘤科,国家口腔疾病临床医学研究中心,上海市口腔医学重点实验室,上海市口腔医学研究所,上海200011
头颈部恶性肿瘤患者的病死率较高,其中90%属于鳞状细胞癌[1],简称头颈鳞癌(head and neck squamous cells carcinoma,HNSCC)。尽管有许多针对HNSCC 的新疗法,但“手术+化学治疗(化疗)+放射治疗(化疗)”的三联疗法仍是治疗HNSCC 的主要方法[2-3]。顺铂(cisplatin,DDP) 是治疗HNSCC 常用的化疗药物之一[4]。许多患者在DDP 治疗的早期阶段获得了良好的效果,但会随着时间的推移而发生耐药[4]。研究[5]结果表明,超过70%的HNSCC 患者因为对DDP 产生耐药而导致疾病复发。因此,了解DDP 耐药的潜在机制并制定有效的抵抗DDP的耐药策略是临床上需要解决的问题。
泛素化是主要的蛋白翻译后修饰方式之一,在调节细胞的生长、分化和凋亡等过程中起着至关重要的作用[6]。泛素化是可逆的,主要通过去泛素化酶(deubiquitylating enzymes,DUB)从底物蛋白上裂解泛素,编辑泛素链并加工泛素前体[6-7]。DUB作为E3泛素连接酶的拮抗剂,是泛素-蛋白酶体系统的组成部分[8]。根据序列和结构域保守性,DUB 分为6 个家族:泛素特异性蛋白酶家族(ubiquitinspecific proteases,USPs)、泛素羧基末端水解酶家族(ubiquitin carboxy-terminal hydrolases,UCHs)、Joesphin结构域蛋白家族(Machado-Josephin domain-containing proteases,MJDs)、卵巢肿瘤蛋白酶家族(ovarian tumour proteases,OTUs)、与含泛素的新型DUB家族相互作用的基序(motif-interacting with ubiquitin-containing novel DUB family,MINDYs)和JAMM 家族(JAB1、MPN、MOV34 family)[7,9]。其中,USPs是数量最多的一类DUB[10],并在各种生物学过程中起着重要作用。
去 泛 素 化 酶47 (ubiquitin specific peptidase 47,USP47)是USPs的成员之一[7-8],在调节细胞活力和维持基因组完整性方面发挥关键作用[10-11]。USP47 可以促进肺癌和前列腺癌细胞Wnt 信号通路的活化[11],也可以调控结直肠癌细胞的上皮-间充质转化[12]。在胃癌中,USP47 还被证实可以增强癌细胞的化疗耐药性和生存能力,并且被认为是一种新的治疗靶标[8]。但是,关于USP47 在HNSCC 发病进展和治疗过程中发挥的作用,尚无文献报道。因此,本研究通过构建人HNSCC的DDP耐药细胞株,探索USP47 与HNSCC 的DDP 耐药之间的关系及潜在的机制,为逆转DDP耐药的临床研究提供参考。
1 材料与方法
1.1 材料
高糖DMEM 培养基(源培,中国),10%胎牛血清(CellMax,中国),DDP 注射液(豪森药业,中国),PrimeScriptTMRT reagent Kit (TaKaRa,日本),SYBR®Premix Ex TaqTM试剂盒(TaKaRa,日本),LipofectamineTM2000 Transfection Reagent(Invitrogen,美国),4%~20%SurePAGE 蛋白预制胶(GenScript,中国),鼠单克隆GAPDH抗体(Proteintech,美国;1∶10 000),鼠单克隆USP47抗体(Santa Cruz Biotechnology,美国;1∶500),兔多克隆重组人B 细胞淋巴瘤因子2 xL(recombinant human B-cell leukemia/lymphoma 2 xL,Bcl-xL)抗体(ABclonal,中国;1∶2 000),兔多克隆X-连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)抗体(Proteintech,美国;1∶2 000),鼠单克隆Ubiquitin抗体(CST,美国;1∶2 000),荧光二抗(LI-COR Biosciences,美国;1∶10 000),MTT(Sigma,美国),Annexin V FITC Apop Dtec Kit I 100Tst(BD Pharmingen,美国),Protein A/G免疫沉淀磁珠(Bimake,美国),MG132(Selleck,美国)。
1.2 细胞培养
人HNSCC 细胞系WSU-HN4 (HN4)、WSU-HN30(HN30)由美国马里兰大学牙医学院赠送。HN4、HN30细胞均用高糖DMEM 培养基(含10%胎牛血清、青霉素100 U/mL、链霉素100µg/mL)培养,放置于37 ℃、5%CO2的饱和湿度培养箱中培养。
1.3 DDP耐药株构建
采用浓度逐步递增法构建人HNSCC细胞的DDP耐药株,DDP浓度依次为5、7.5、10、15、20 μmol/L。具体操作方法是在细胞传代时向培养基中加入终浓度为5 μmol/L的DDP,连续传代培养至细胞可以在此DDP浓度的培养基中稳定生长。再按前文所述的浓度梯度增加DDP剂量。将耐受DDP的HN4和HN30细胞株分别命名为HN4/DDP和HN30/DDP。
1.4 USP47基因过表达细胞株的构建
采用慢病毒感染法构建USP47 基因过表达细胞株(USP47 基因过表达及对照慢病毒均购于上海汉尹公司)。细胞用胰酶消化、计数后,重悬成单细胞悬液并接种至6 孔板,以24 h 后贴壁细胞密度为20%~30%为宜;待细胞密度为40% 左右,根据感染复数(multiplicity of infection,MOI)值计算加入病毒悬液的体积,同时加入聚凝胺(终浓度为10 μg/mL)摇匀;72 h后用含10 μg/mL的嘌呤霉素进行筛选,连续培养1 个月后进行相应实验。USP47 基因过表达和对照组细胞分别命名为USP47 和Vector。
1.5 USP47基因敲除细胞株构建
采用慢病毒感染法构建USP47 基因敲除细胞株(敲除对照慢病毒及敲除慢病毒购于上海汉尹公司),USP47基因敲除组和对照组细胞分别命名为KO USP47 和KO NC。具体步骤见“1.4”。
1.6 小干扰RNA转染
使用XIAP 和Bcl-xL 基因各自特异的小干扰RNA(small interfering RNA,siRNA) 序列(Genomeditech,中国)分别敲减USP47 基因过表达细胞中XIAP mRNA 和Bcl-xL mRNA 的 表 达。 使 用LipofectamineTM2000 Transfection Reagent进行siRNA 的转染。细胞接种至6 孔板中,以贴壁后细胞密度为30%~40%为宜;转染前,换双无培养基;按照每孔siRNA 终浓度为50 pmol/L 的量进行转染。XIAP和Bcl-xL基因特异的siRNA序列见表1。
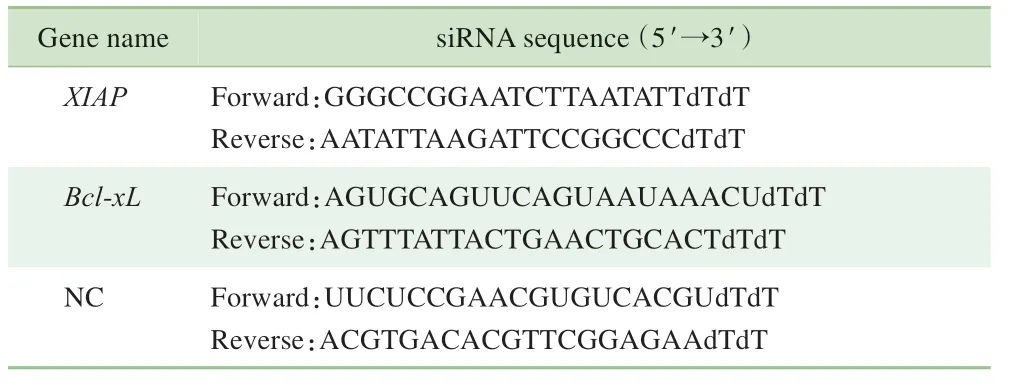
表1 XIAP和Bcl-xL基因特异的siRNA序列Tab 1 siRNA sequences specific for XIAP and Bcl-xL genes
1.7 MTT法检测细胞DDP半数抑制浓度
细胞的DDP 半数抑制浓度(half maximal inhibitory concentration,IC50)主要通过MTT 法进行检测。将处于指数生长期的细胞用胰酶消化、计数后,重悬成单细胞悬液,并接种至96孔板中,每孔100 μL,细胞数为3 000个;以相同体积培养基孔为空白对照;设置10 个DDP 浓度梯度,每个浓度设置3个复孔;放入培养箱中常规培养24 h后,将正常培养基换成含有DDP 的培养基;72 h 后,向每孔中加入10 μL MTT溶液,37 ℃孵育4 h,小心弃去上清,每孔加入150 μL DMSO,避光摇匀;用酶标仪检测490 nm 波长下各孔的吸光度[D (490 nm)]。利用Graphpad prism 7软件计算IC50。
1.8 免疫印迹实验
用全细胞裂解液提取细胞总蛋白并测定蛋白浓度;取蛋白裂解产物(40 μg/孔)置于4%~20%SurePAGE 蛋白预制胶中进行电泳;电泳结束后,再用90 V恒压电转;5%脱脂牛奶室温封闭1 h,分别加入USP47(1∶500)、GAPDH(1∶10 000)、XIAP(1∶2 000)、Bcl-xL(1∶2 000)抗体,4 ℃孵育过夜;PBST洗涤3次,10 min/次;加入与一抗相同种属的二抗,室温孵育1 h,PBST洗涤3次后,显影观察。
1.9 实时定量PCR
提取细胞总RNA,使用PrimerScript RT 试剂盒将提取的总RNA 反转录成cDNA,使用SYBR Premix Ex Taq试剂盒进行所有实时定量PCR(real-time PCR,RT-PCR)反应。每组设置3 个复孔,使用β-actin 作为内参基因。运用△△CT法分析实验数据,从而得到目的基因在样本中的相对表达量。用Primer Premier 5软件设计引物序列,由上海生工生物股份有限公司合成,具体序列见表2。

表2 RT-PCR引物序列Tab 2 RT-PCR primer sequences
1.10 细胞增殖实验
将细胞以每孔100 μL、1 000 个细胞的密度接种到96 孔板上,每组设3 复孔。细胞增殖测定采用MTT 法。每天向每组的3个复孔中加入10 μL MTT,培养箱中静置4 h,弃上清液,每孔加入150 μL DMSO,避光摇匀,用酶标仪检测D(490 nm)。
1.11 细胞平板克隆形成实验
将细胞接种到6 孔板中(每孔约500 个细胞),置于培养箱中培养8~15 d,直至形成可见的克隆。PBS 洗涤2~3 次,用4%多聚甲醛固定30 min,并用0.1%结晶紫染色30 min。染色后,洗涤、风干、拍照。
1.12 细胞凋亡检测
采用流式细胞术检测细胞的凋亡比例。用不含EDTA的胰酶消化收集细胞,用PBS 洗涤细胞2 次(5 000×g,4 ℃离心5 min),加入1×结合缓冲换液重悬,300×g,4 ℃离心10 min,弃上清,加入Annexin V和PI(1×结合缓冲换液=1∶50),混匀、冰上避光反应15 min;加入400 μL 1×结合缓冲换液重悬,转移至流式管中,立即进行检测。
1.13 泛素化测定
提取细胞总蛋白并稀释至蛋白质量浓度为2 μg/μL,取30 μL样品留作对照Input。将上述稀释好的蛋白样品等分成2份(每份蛋白总量至少1 mg),用RIPA裂解液稀释5倍;向稀释好的2份样品中各加入70 μL 蛋白A/G免疫磁珠,4 ℃旋转30 min后,1 000×g离心1 min取上清;将上清等分为2份,一份加入目的抗体,一份加入等体积的同种属的IgG抗体,4 ℃旋转过夜;第2日,向两份样品中各加入60 μL蛋白A/G免疫磁珠,室温旋转4 h,1 000×g 离心1 min,弃液取沉淀;沉淀用洗杂液反复漂洗5次后加入60 μL 1×上样缓冲液,105 ℃金属浴煮10 min。实验所得样品进行后续的免疫印迹实验。
1.14 统计学分析
采用SPSS 19.0 软件进行统计学分析。2 组之间比较采用独立样本t 检验,3 组及3 组以上的比较采用单因素方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 HNSCC细胞DDP耐药株的构建
以HN4 和HN30 为亲本细胞,采用梯度增加DDP 浓度的方法构建DDP 耐药株HN4/DDP 和HN30/DDP。6 个月后,DDP 处理浓度达到20 μmol/L。利用MTT 法分别检测DDP 对亲本细胞和耐药细胞的IC50。亲本细胞HN4的IC50为6.62 μmol/L,而 耐 药 细 胞HN4/DDP 的IC50为49.56 μmol/L(为HN4的7.49倍);亲本细胞HN30的IC50为4.37 μmol/L, 而 耐 药 细 胞HN30/DDP 的IC50为42.14 μmol/L(为HN30的9.64倍)(图1A)。为了进一步验证耐药性的持续能力,将HN4/DDP 和HN30/DDP 在正常培养基中培养48 h 后,检测各自的IC50。结果显示:HN4/DDP 的IC50仍高达36.74 μmol/L,而HN30/DDP 的IC50也达到34.98 μmol/L(图1B)。
2.2 DDP耐药株中USP47蛋白表达的变化
通过免疫印迹实验检测HN4、HN30、HN4/DDP和HN30/DDP中USP47蛋白的表达水平。结果显示,与亲本细胞相比,HN4/DDP和HN30/DDP中USP47蛋白表达水平显著上调(图2),且表达量与DDP耐受浓度呈正相关。
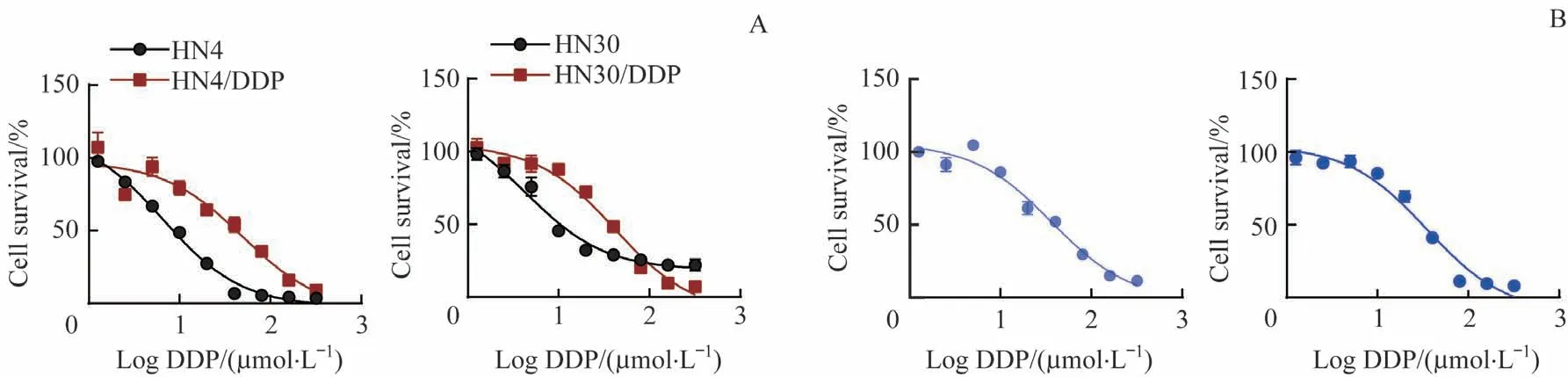
图1 DDP耐药HNSCC细胞株的构建Fig 1 Construction of DDP-resistant strains of HNSCC
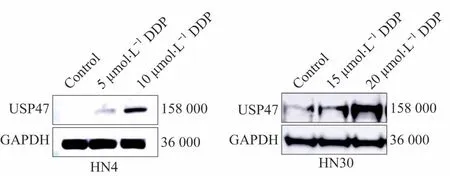
图2 DDP耐药细胞株HN4/DDP和HN30/DDP中USP47蛋白的表达Fig 2 USP47 protein expressions in DDP-resistant HN4/DDP and HN30/DDP cell lines
2.3 USP47基因过表达对HNSCC细胞DDP耐药性的影响
免疫印迹实验及RT-PCR 结果显示,USP47 基因过表达稳转细胞株构建成功(图3A、3B)。运用MTT 法检测DDP对USP47基因过表达稳转细胞株的IC50(图3C),结果发现过表达USP47 基因后,DDP 对HN4 细胞的IC50由2.98 μmol/L 升至12.34 μmol/L,而DDP 对HN30 细胞的IC50由3.76 μmol/L升至7.41 μmol/L。
2.4 敲除USP47 基因提高HNSCC 细胞对DDP 的敏感性
RT-PCR 和免疫印迹实验检测USP47 的敲除效率,结果表明HN4/DDP 和HN30/DDP 中USP47 的蛋白及mRNA表达水平显著下降,差异具有统计学意义(图4A、4B)。通过MTT 法检测DDP 对处理组和对照组细胞的IC50,发现敲除USP47 基因后,耐药株HN4/DDP 和HN30/DDP 的IC50均 下 降;HN4/DDP 细 胞 的IC50由39 μmol/L 降 至26.02 μmol/L,而HN30/DDP 细胞的IC50由33.45 μmol/L降至20.26 μmol/L(图4C)。
2.5 过表达USP47 对HNSCC 细胞增殖、克隆形成及凋亡的影响
细胞增殖实验和平板克隆形成实验结果显示,过表达USP47后,HNSCC细胞的增殖能力显著减弱(图5A),克隆形成能力也下降(图5B)。通过流式细胞技术检测过表达USP47 后HNSCC 细胞的凋亡变化,结果发现,过表达USP47 后,HN4 和HN30 的基础凋亡率与对照组相比无明显改变(图5C);而在DDP的作用下,过表达USP47的HN4和HN30 细胞,其凋亡率出现明显下降(图5D)。
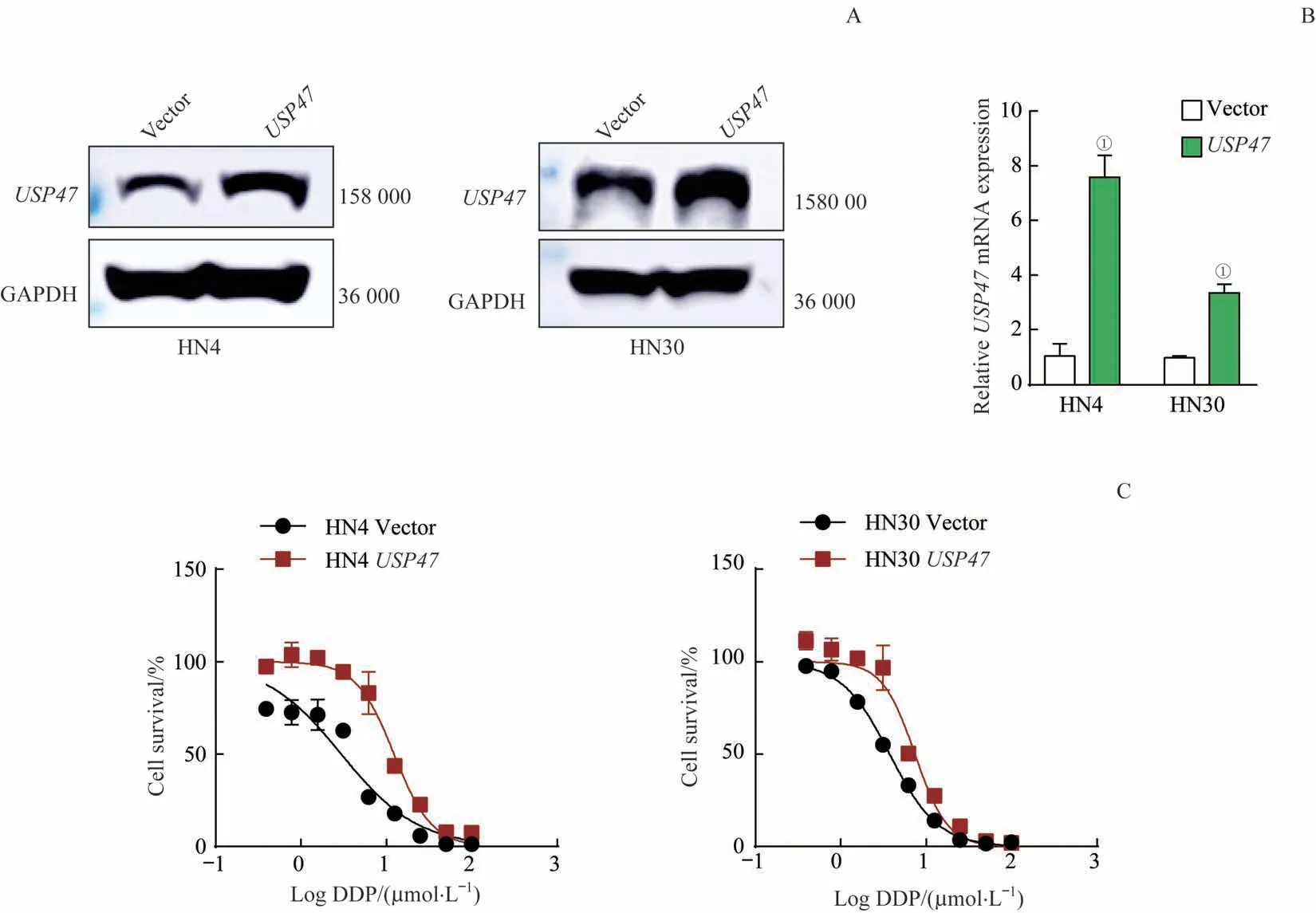
图3 USP47基因过表达增强HNSCC细胞对DDP的抵抗能力Fig 3 Overexpression USP47 gene increases cell′s resistance to DDP
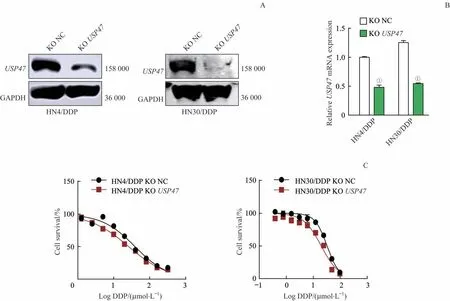
图4 敲除USP47基因逆转HNSCC细胞对DDP的耐药Fig 4 Knocking out USP47 gene reverses cell′s resistance to DDP

图5 过表达USP47对HNSCC细胞的增殖、克隆形成和凋亡的影响Fig 5 Effect of USP47 gene overexpression on cell proliferation,colony formation and apoptosis
2.6 过表达USP47促进抗凋亡蛋白的表达
免疫印迹实验结果显示,在HN4 和HN30 细胞中过表达USP47后,抗凋亡蛋白XIAP和Bcl-xL表达水平均显著升高(图6A);相应地,敲除HN4/DDP 和HN30/DDP细胞中USP47 基因后,XIAP 和Bcl-xL 的表达水平则明显下降(图6B)。进一步的泛素化实验结果显示,敲除USP47 后,XIAP 和Bcl-xL 蛋白的泛素化水平升高,蛋白自身表达水平下降(图6C);而在抑制泛素化蛋白的降解“场所”——蛋白酶体的活性后,XIAP 和Bcl-xL 的表达水平相比对照组明显升高(图6D)。
案例12:立体几何引言容易上得平淡无味,可由下列活动导入:大家动手试一试用3支铅笔看能摆出几个直角?用6支新铅笔又能摆出几个以他们为边的正三角形?
2.7 抗凋亡蛋白表达下调阻断USP47 基因过表达诱导的DDP耐药性
在USP47 基因过表达稳转细胞中,利用siRNA 技术降低抗凋亡蛋白XIAP 和Bcl-xL 的表达量,观察DDP 对其IC50的影响,结果显示(图7):HN4 USP47 对照组细胞(HN4 USP47+si NC) 的DDP IC50为12.09 μmol/L,而实验组细胞(HN4 USP47+si XIAP 和HN4 USP47+si Bcl-xL)的DDP IC50分别为2.80 和3.71 μmol/L; HN30 USP47 对照组细胞(HN30 USP47+si NC)的DDP IC50为7.41 μmol/L,而实验组细胞(HN30 USP47+si XIAP 和HN30 USP47+si Bcl-xL)的DDP IC50分 别 为3.25 和3.80 μmol/L。抗凋亡蛋白XIAP 和Bcl-xL 表达降低阻断了USP47 基因过表达诱导的DDP 耐药性。
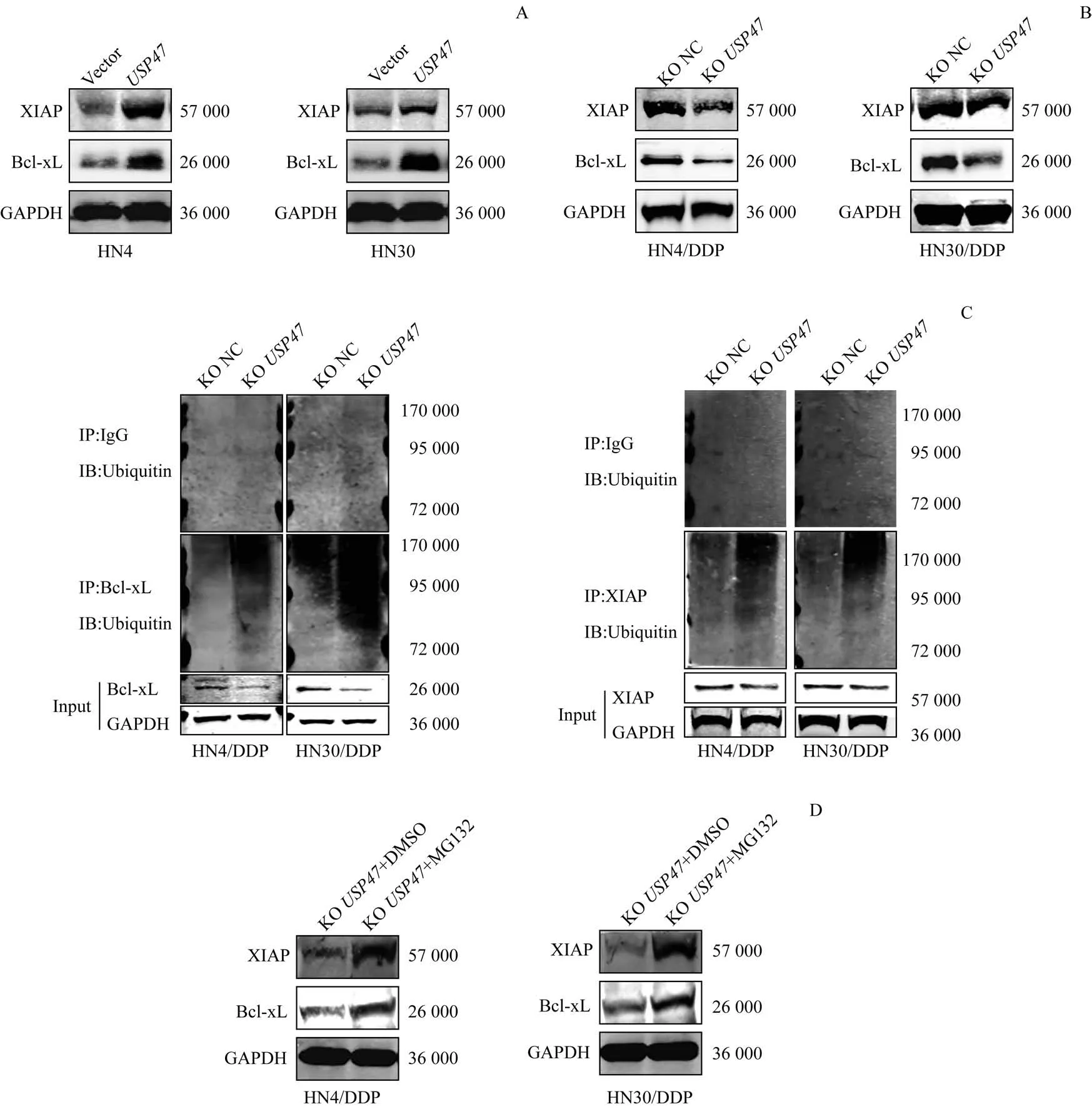
图6 免疫印迹实验检测USP47过表达对抗凋亡蛋白表达的影响Fig 6 Effect of USP47 overexpression on expression of anti-apoptotic proteins by Western blotting
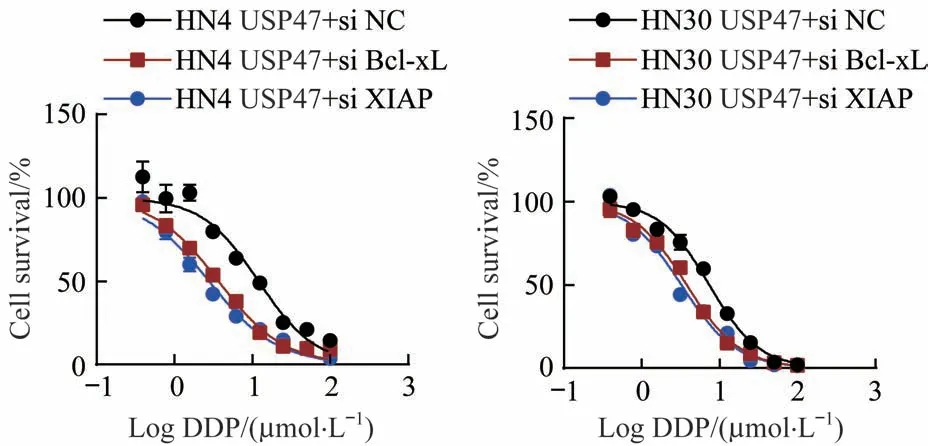
图7 抗凋亡蛋白表达下调阻断USP47基因过表达诱导的DDP耐药性Fig 7 Down-regulation of anti-apoptotic protein blocks DDP resistance induced by overexpression of USP47 gene
3 讨论
大多数耐药株的诱导方式是反复间歇性给予高浓度药物。在本研究中,若一开始即使用高浓度的DDP 刺激细胞,会导致细胞大量死亡,很难诱导成耐药株。因此,本研究采用渐进式升高DDP 浓度的方法,并且每一个浓度都至少传代3次,以保证提高浓度时大部分细胞可以很好地生存。整个诱导周期在6 个月左右。采用MTT 法检测DDP对HNSCC细胞的IC50,判断DDP耐药株的诱导情况。诱导成功的2个细胞株均在正常培养基中培养,经检测,2个细胞株对DDP的耐药性是稳定的。
DDP 作为治疗肿瘤的一线药物,由于内源或获得性的耐药性而严重限制了其在临床中的使用,也因此导致了HNSCC患者总体预后较差。针对DDP耐药性分子机制的研究较多,例如药物积累的减少、DNA 损伤修复的增加、凋亡信号通路的抑制等。研究[8,13]表明,去泛素化酶在参与转移及凋亡途径中发挥调节作用,因而被认为是癌症治疗中有希望的新型药物靶标。
在本研究中,我们发现HNSCC 耐药细胞中去泛素化酶USP47 表达量升高,且与DDP 耐受浓度呈正相关。本研究证实了USP47 可以提高DDP 对HNSCC 细胞的IC50,而抑制USP47的表达可以降低IC50。同时,本研究还发现USP47 过表达会抑制细胞的凋亡,同时抑制细胞的增殖和克隆形成能力。机制研究显示,USP47 基因过表达可以显著提高抗凋亡蛋白XIAP和Bcl-xL的蛋白表达量;泛素化测定实验证实了USP47 基因通过降低抗凋亡蛋白XIAP 和Bcl-xL 的泛素化水平导致其表达量升高;敲低抗凋亡蛋白XIAP 和Bcl-xL 的表达明显阻断了USP47 基因过表达诱导的DDP耐药性。
XIAP是已知的功能强大的调控凋亡的蛋白[14],可以直接抑制半胱天冬氨酸蛋白酶(caspases) 家族的活性[15-16]。XIAP 在大多数肿瘤细胞中过表达,其表达水平与肿瘤的恶性进展、复发、预后以及肿瘤化疗耐药密切相关[17]。Bcl-xL 蛋白属于Bcl-2 家族,位于线粒体外膜上,通常与Bcl-2形成同源二聚体抑制细胞凋亡[18]。有研究[19-20]表明,在DDP耐药的肿瘤细胞中检测到Bcl-xL的表达显著升高。本研究结果证实了XIAP和Bcl-xL 是去泛素化酶USP47 的潜在底物;USP47 通过降低XIAP 和BclxL 蛋白的泛素化修饰水平,提高二者的蛋白表达水平,从而发挥促进HNSCC细胞化疗耐药的生物学效应。
综上所述,USP47 过表达可以抑制HNSCC 细胞的增殖和克隆形成,通过降低抗凋亡蛋白XIAP和Bcl-xL的泛素化水平导致其表达量升高进而抑制细胞凋亡,提高HNSCC细胞的DDP耐药性。该研究结果提示USP47可能有望成为治疗HNSCC 的潜在靶基因,探讨其作用机制可为DDP耐药的临床研究提供新思路。
参·考·文·献
[1] Siegel RL,Miller KD,Jemal A. Cancer statistics,2019[J]. CA Cancer J Clin,2019,69(1):7-34.
[2] Chinn SB, Myers JN. Oral cavity carcinoma: current management,controversies, and future directions[J]. J Clin Oncol, 2015, 33(29): 3269-3276.
[3] Hedberg ML, Goh G, Chiosea SI, et al. Genetic landscape of metastatic and recurrent head and neck squamous cell carcinoma[J]. J Clin Invest,2016,126(4):1606.
[4] Amable L. Cisplatin resistance and opportunities for precision medicine[J].Pharmacol Res,2016,106:27-36.
[5] Gibson MK, Li Y, Murphy B, et al. Randomized phase III evaluation of cisplatin plus fluorouracil versus cisplatin plus paclitaxel in advanced head and neck cancer (E1395): an intergroup trial of the Eastern Cooperative Oncology Group[J]. J Clin Oncol,2005,23(15):3562-3567.
[6] Clague MJ, Barsukov I, Coulson JM, et al. Deubiquitylases from genes to organism[J]. Physiol Rev,2013,93(3):1289-1315.
[7] Harrigan JA, Jacq X, Martin NM, et al. Deubiquitylating enzymes and drug discovery: emerging opportunities[J]. Nat Rev Drug Discov, 2018, 17(1):57-78.
[8] Naghavi L, Schwalbe M, Ghanem A, et al. Deubiquitinylase USP47 promotes RelA phosphorylation and survival in gastric cancer cells[J].Biomedicines,2018,6(2):E62.
[9] Amerik AY, Hochstrasser M. Mechanism and function of deubiquitinating enzymes[J]. Biochim Biophys Acta,2004,1695(1-3):189-207.
[10] Pfoh R, Lacdao IK, Saridakis V. Deubiquitinases and the new therapeutic opportunities offered to cancer[J]. Endocr Relat Cancer, 2015, 22(1): T35-T54.
[11] Shi JD, Liu YJ, Xu XH, et al. Deubiquitinase USP47/UBP64E regulates β-catenin ubiquitination and degradation and plays a positive role in wnt signaling[J]. Mol Cell Biol,2015,35(19):3301-3311.
[12] Choi BJ, Park SA, Lee SY, et al. Hypoxia induces epithelial-mesenchymal transition in colorectal cancer cells through ubiquitin-specific protease 47-mediated stabilization of Snail:a potential role of Sox9[J]. Sci Rep,2017,7(1):15918.
[13] Global Burden of Disease Cancer Collaboration, Fitzmaurice C, Allen C,et al. Global,regional,and national cancer incidence,mortality,years of life lost, years lived with disability, and disability-adjusted life-years for 32 cancer groups, 1990 to 2015: asystematic analysis for the global burden of disease study[J]. JAMA Oncol,2017,3(4):524-548.
[14] Mansouri A, Zhang QX, Ridgway LD, et al. Cisplatin resistance in an ovarian carcinoma is associated with a defect in programmed cell death control through XIAP regulation[J]. Oncol Res,2003,13(6):399-404.
[15] Qian H, Huang T, Chen Y, et al. X-linked inhibitor of apoptosis protein inhibitor Embelin induces apoptosis via PI3K/Akt pathway and inhibits invasion in osteosarcoma cells[J]. J Cancer Res Ther,2018,14(Supplement):S648-S655.
[16] DPDCTirapelli, Lustosa IL, Menezes SB, et al. High expression of XIAP and Bcl-2 may inhibit programmed cell death in glioblastomas[J]. Arq Neuropsiquiatr,2017,75(12):875-880.
[17] Yang TW, Gao YX, Liu DJ, et al. ASPP2 enhances chemotherapeutic sensitivity through the down-regulation of XIAP expression in a p53 independent manner in hepatocellular carcinoma[J]. Biochem Biophys Res Commun,2019,508(3):769-774.
[18] Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J].Cell,2011,144(5):646-674.
[19] Yang XK, Zheng F, Xing H, et al. Resistance to chemotherapy-induced apoptosis via decreased caspase-3 activity and overexpression of antiapoptotic proteins in ovarian cancer[J]. J Cancer Res Clin Oncol, 2004,130(7):423-428.
[20] Williams J, Lucas PC, Griffith KA, et al. Expression of Bcl-xL in ovarian carcinoma is associated with chemoresistance and recurrent disease[J].Gynecol Oncol,2005,96(2):287-295.

