微冻贮藏对牛肉保水性的影响
卢 骁,董鹏程,张一敏,毛衍伟,梁荣蓉,杨啸吟,朱立贤,,罗 欣,2,
(1.山东农业大学食品科学与工程学院,山东 泰安 271018;2.江苏省肉类生产与加工质量安全控制协同创新中心,江苏 南京 210095)
温度是决定肉品货架期和品质的主要因素,目前肉品保鲜主要是通过低温贮藏抑制微生物生长繁殖和内源酶活性实现的[1]。低温保鲜因贮藏成本低廉并且对组织结构破坏程度低而成为肉品贮藏最常用的技术手段,目前最常用的方法是冷藏和冷冻。微冻是一种温度介于冷藏和冻藏之间的贮藏方法,通常将食品温度控制在低于冰点1~2 ℃,在此温度下,大多数微生物的生长繁殖受到抑制,从而达到延长食品保质期的目的[2]。Liu Qian等[3]发现,-3 ℃微冻贮藏能将鲤鱼酱的货架期延长至35 d。刘明爽等[4]研究表明,4 ℃冷藏的鲈鱼货架期仅为9 d,而-2 ℃微冻贮藏样品的货架期可达到15 d。微冻作为一种新兴的低温贮藏方法,已广泛应用于水产品的保鲜,但是对肉类食品尤其是对牛肉的研究并不多见。
保水性是肉品最重要的品质特性之一,也是评价肉品价值的重要指标[5]。保水性不仅影响肉的营养、嫩度、多汁性和色泽等品质特性,还会对加工肉制品的质地、产量有较大影响。对于冷藏条件下的肉品来说,pH值、肌原纤维蛋白降解速率以及氧化程度是影响肌肉保水性的重要因素[6]。冻藏过程中,影响肉品保水性的因素主要是冰晶的生长和蛋白质冷冻变性[7]。本课题组之前的研究发现,微冻条件下牛肉的汁液损失率和蒸煮损失率均显著高于冷藏和冷冻处理组[8],但是目前关于微冻贮藏过程中牛肉保水性的变化还鲜有报道。因此,本研究以冷藏和冷冻贮藏为对照,从肌原纤维蛋白结构和水分迁移等方面分析了微冻贮藏过程中牛肉保水性的变化机制,为微冻贮藏在牛肉中的应用和推广提供科学理论根据。
1 材料与方法
1.1 材料与试剂
本实验随机选取4 头18~24 月龄、体质量620~680 kg的鲁西黄牛杂交牛,经放血屠宰后冷却成熟48 h,取左右半胴体的腰背最长肌,然后将取下的肌肉分割成厚2.54 cm的牛排,每一块牛排独立真空包装,将所有样品置于冰上运回实验室。
乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、BCA蛋白浓度测定试剂盒、尿素、溴酚蓝、十二烷基硫酸钠、β-巯基乙醇、氯化钠、氯化钾、磷酸氢二钠、磷酸二氢钠 北京索莱宝科技有限公司;Tris-base北京Novon Scientific公司;5,5’-二硫代-2-硝基苯甲酸(5,5’-dithiobis-2-nitrobenzoate,DTNB) 上海阿拉丁试剂有限公司。
1.2 仪器与设备
SSN11E温度记录仪 深圳宇问加壹传感系统有限公司;AB104-S分析天平 瑞士Mettler Toledo公司;5804R高速冷冻离心机 德国Eppendorf公司;Mini-Protean II小型垂直电泳仪、ChemiDoc MP凝胶成像仪美国Bio-Rad公司;T18 Ultra-Turrax高速分散机德国IKA公司;SpectraMax M5酶标仪 美国Molecular Devices公司;SU2080扫描电子显微镜 日本Hitachi公司;NMI20-015V-I低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)仪 上海纽迈电子科技有限公司;BD-145HDE冷藏冷冻转换柜 青岛海尔特种电冰柜有限公司。
1.3 方法
1.3.1 原料处理
将样品进行3 种贮藏处理:冷藏(2 ℃)、微冻(-4 ℃)和冷冻(-18 ℃)。在贮藏的第0、4、8、12周测定相应指标,微冻和冷冻贮藏的牛排在测定各项指标之前放入4 ℃冰箱解冻24 h。
1.3.2 牛肉冰点的测定
取5 cm×5 cm×5 cm的肉样,剔除可见脂肪和结缔组织,然后将温度记录仪的金属探头插入肉样的几何中心,放入-18 ℃的冰柜中,每隔30 s记录温度的变化,当温度变化出现平台期时,此温度即为牛肉的冰点。
1.3.3 汁液损失率的测定
包装前对牛排进行称质量(m1/g),牛排经过贮藏后打开包装,用滤纸擦干表面的汁液,再对其称质量(m2/g)。汁液损失率按公式(1)计算。
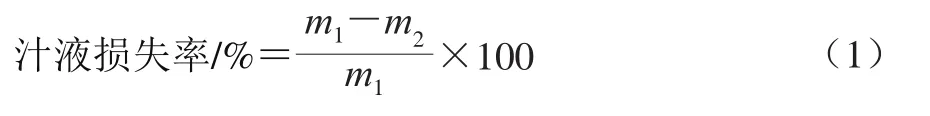
1.3.4 蒸煮损失率的测定
打开包装后,用滤纸擦去牛排表面的汁液,称其质量(m1/g)。再将肉样放入蒸煮袋中,温度计探头插入牛排的中心位置,然后置于80 ℃水浴锅中,加热至牛排中心温度70 ℃,室温冷却后放于4 ℃冰箱过夜。用滤纸擦干牛排表面汁液后称质量(m2/g)。蒸煮损失率按公式(2)计算。
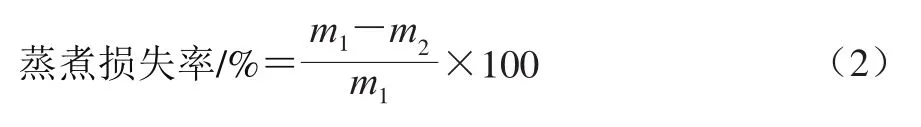
1.3.5 水分分布及核磁共振成像的测定
利用LF-NMR进行水分分布(横向弛豫时间T2)的测定及核磁共振成像,具体参考参考孙文彬等[9]的方法,并稍作修改。
横向弛豫时间T2的测定:仪器预热30 min后开始使用,测试温度为32 ℃。在测试样品前使用标准油样的FID序列对仪器进行校准,所用FID参数为:SF=21、TW=2 000、NS=4、SW=100、RFD=0.05、RG1=20、DRG1=3。肉样沿肌纤维方向切成1 cm×1 cm×2 cm肉条,称质量后缓缓放入核磁试管底部,32 ℃水浴加热至样品恒温,擦干管壁后进行测定。测试样品所使用的为CPMG序列参数为:SF=21、SW=250、TW=2 500、TE=0.6、NECH=10 000、NS=8。
核磁共振成像:测试温度为32 ℃,仪器预热30 min后开始使用。测试样品前,使用标准油样进行校准,样品定位预扫描后进行正式成像。主要成像参数:TR=500、TE=20、AVERAGES=4,成像大小为50 mm×50 mm,肉样成像厚度为3 mm,成像方式为横断面,图像保存后再进行伪彩处理。
1.3.6 肌原纤维蛋白的提取
肌原纤维蛋白的提取参考Liu Rui等[10]的方法,并稍作修改。取0.5 g剔除脂肪和结缔组织的肉样,加入5 mL试剂I(100 mmol/L Tris-base、10 mmol/L EDTA,pH 8.3),15 000 r/min匀浆两次,每次30 s,然后于4 ℃、15 000×g离心40 min。倒掉上清液,向沉淀中加入5 mL试剂II(20 mmol/L磷酸盐缓冲液、0.6 mol/L NaCl,pH 6.5),匀浆后4 ℃、2 000×g离心10 min,上层溶液即为肌原纤维蛋白。用BCA试剂盒测定蛋白浓度后,再用试剂II将肌原纤维蛋白质量浓度调整为8 mg/mL和2 mg/mL。2 mg/mL的蛋白溶液用于测定巯基含量和蛋白质表面疏水性。8 mg/mL的蛋白溶液与等体积试剂III(100 mmol/L Tris-base、40 g/L十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、20%丙三醇、0.8%β-巯基乙醇、0.005%溴酚蓝、5 mmol/L EDTA,pH 6.8)充分混合,95 ℃金属浴5 min,室温冷却后分装样品,-80 ℃贮存用于SDS-聚丙烯酰氨凝胶电泳(polyacrylamide gel electrophoresis,PAGE)。
1.3.7 总巯基和活性巯基含量的测定
总巯基和活性巯基含量的测定采用Fu Qingquan等[11]的方法,并略作修改。取1 mL 2 mg/mL蛋白样品,加入9 mL缓冲液(50 mmol/L磷酸盐缓冲液、8 mol/L尿素、0.6 mol/L氯化钾、10 mmol/L EDTA,pH 7.0),然后加入0.4 mL 1 g/L DTNB溶液,混匀后在40 ℃反应25 min,然后于412 nm波长处测定吸光度。测定活性巯基含量时所用的缓冲液中不加入尿素,与蛋白溶液4 ℃反应60 min,其他步骤与测定总巯基含量相同。使用摩尔吸光系数13 600 L/(mol·cm)来计算总巯基和活性巯基含量,结果以蛋白质量计。
1.3.8 蛋白质表面疏水性的测定
表面疏水性的测定参考Chelh等[12]的方法,并稍作修改。取1 mL 2 mg/mL的肌原纤维蛋白溶液,加入40 μL 1 mg/mL的溴酚蓝溶液,在室温下混合反应15 min。反应结束后样品离心(3 000×g、15 min、4 ℃),取上清液在595 nm波长处测定吸光度。另取1 mL 20 mmol/L磷酸盐缓冲液(0.6 mol/L NaCl,pH 6.5)替代肌原纤维蛋白溶液为对照组。以溴酚蓝的结合量表征表面疏水性指数,具体按公式(3)计算。

1.3.9 蛋白组成的测定
SDS-PAGE的测定参考Xia Xiufang等[13]的方法,并稍作修改。分离胶质量分数为10%,浓缩胶质量分数为5%,上样量15 μg。浓缩胶恒压80 V电泳30 min,进入分离胶后恒压120 V继续电泳,直到样品移至分离胶底部。然后用考马斯亮蓝染色1 h,脱色后拍照观察。
1.4 数据处理与分析
实验采用裂区设计,采用SAS 9.2系统中的混合模型(MIXED procedure)进行数据分析。模型中以贮藏方式、贮藏时间以及它们之间的交互作用作为固定效应,以牛个体作为随机效应。采用type-3法分析固定效应显著性,差异显著水平为P<0.05。采用SigmaPlot 12.0软件作图。
2 结果与分析
2.1 牛肉冰点的确定
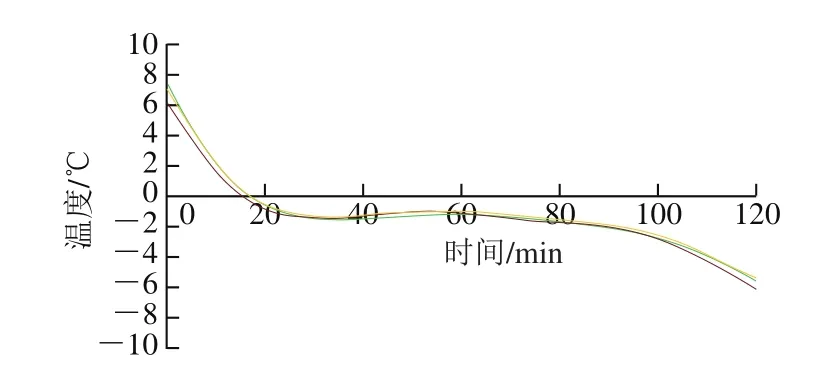
图1 牛肉冻结曲线Fig.1 Freezing curve of beef muscle
牛肉的冻结曲线如图1所示,在整个冻结过程中,牛肉的中心温度在冻结初期快速下降,当中心温度下降到-1.9 ℃~-2.1 ℃时出现了平台期,此后温度继续下降,由此确定该温度范围为牛肉的冰点。微冻贮藏通常是将食品温度控制在冰点以下1~2 ℃,因此本实验选择-4 ℃作为牛肉微冻贮藏的温度。
2.2 牛肉贮藏过程中汁液损失率和蒸煮损失率的变化

表1 冷藏、微冻、冷冻贮藏对牛肉汁液损失率和蒸煮损失率的影响Table 1 Effects of chilled, superchilled and frozen storage on juice loss rate and cooking loss rate of beef muscle
汁液损失率和蒸煮损失率是反映肉品保水性的常用指标。如表1所示,贮藏温度、贮藏时间和它们的交互作用对汁液损失率和蒸煮损失率均有显著影响(P<0.05)。随着贮藏时间的延长,冷藏和微冻牛肉的汁液损失率都呈现显著上升的趋势,微冻组的汁液损失率明显高于冷藏组,而冷冻贮藏的牛肉汁液损失率在12 周贮藏期内没有发生显著变化。3 种贮藏方式下牛肉的蒸煮损失率都呈现显著上升的趋势,微冻组上升速率最快,冷藏组次之,冷冻组最慢。
实验结果表明,微冻贮藏的牛肉保水性最差。对于微冻和冷冻条件下的牛肉来说,冻结温度越低,解冻后牛肉的保水性越好,这与李侠等[14]的结果一致。蛋白质冷冻变性导致蛋白质的水合能力下降,此外,冻结过程中形成的冰晶会对肌纤维结构造成机械损伤,也是导致肌肉解冻后保水性下降的重要原因[15]。对于冷藏条件下的样品,贮藏过程中由于钙激活酶等内源性蛋白酶的作用,较大程度地降解了肌原纤维蛋白,导致肌原纤维蛋白的网络结构被破坏,大大减弱了肌原纤维蛋白束缚水分的能力,使得水分从肌纤维内部向外部迁移,导致了汁液损失[16]。
2.3 牛肉贮藏过程中水分状态的变化

图2 冷藏(A)、微冻(B)、冷冻(C)贮藏对牛肉水分横向弛豫特性的影响Fig.2 Effects of chilled (A), superchilled (B) and frozen (C) storage on transverse relaxation characteristics of water in beef muscle
LF-NMR仪通过测定肉品中氢原子核在磁场中的弛豫特性可以分析肉品中水分的分布和状态[17]。根据横向弛豫时间T2可以区分牛肉中不同状态的水分,T2越大,水分自由度越高。由图2可知,3 种贮藏方式下牛肉样品的横向弛豫时间T2图谱中都出现了3 个特征峰,分别对应牛肉中的结合水T21(0~10 ms)、不易流动水T22(10~100 ms)和自由水T23(100~1 000 ms),这与Cheng Shasha等[18]的研究结果一致。
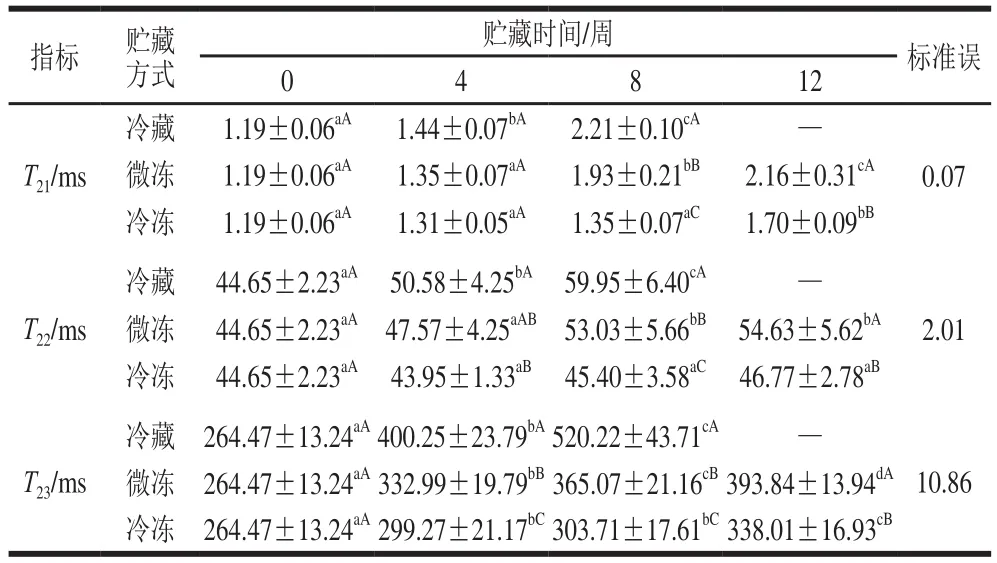
表2 冷藏、微冻、冷冻贮藏对牛肉水分T2弛豫时间的影响Table 2 Effects of chilled, superchilled and frozen storage on T2 relaxation time of water in beef muscle
由表2可知,随着贮藏时间的延长,冷藏和微冻处理组的T21、T22和T23都呈现上升的趋势,说明水分流动性增加,冷藏条件下的样品上升速率最快,微冻组次之,而冷冻样品的结合水和不易流动水的弛豫时间没有明显的变化,说明贮藏温度越低,水分的逃逸能力越差,这与栗俊广等[19]对鸡肉的研究结果基本一致。
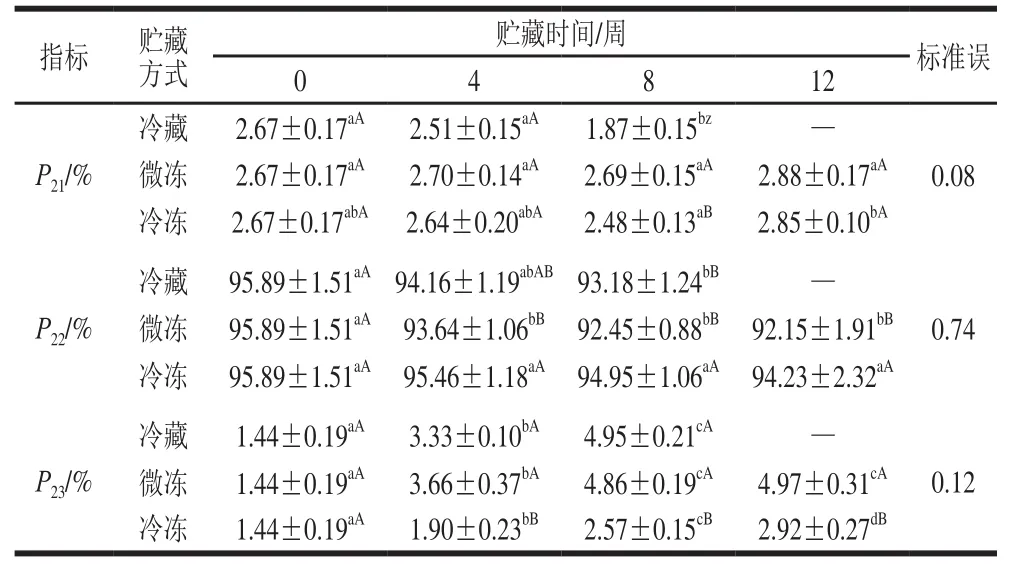
表3 冷藏、微冻、冷冻贮藏对牛肉水分组成的影响Table 3 Effects of chilled, superchilled and frozen storage on moisture composition of beef muscle
牛肉样品在贮藏过程中结合水、不易流动水和自由水相对含量分别用P21、P22以及P23来表示。由表3可知,冷藏条件下牛肉的结合水和不易流动水相对含量在贮藏过程中呈现显著下降的趋势,自由水相对含量显著上升(P<0.05);微冻贮藏过程中结合水相对含量保持稳定,不易流动水相对含量显著下降,自由水相对含量显著上升(P<0.05);而冷冻条件下的样品其结合水和不易流动水的相对含量在贮藏过程中均没有出现显著变化,自由水相对含量显著上升(P<0.05)。冷藏条件下,肌原纤维蛋白可能发生较大程度的降解,不但使蛋白质水合能力下降,还会形成汁液损失通道,导致部分结合水和不易流动水转化为自由水,使自由水相对含量增加,从而导致汁液损失率的上升[20]。结合水是肉品中与肌原纤维蛋白结合最紧密的水分,其含量的下降表明牛肉的品质逐渐劣变,这与冷藏牛肉较短的货架期相吻合。在微冻贮藏过程中,肌原纤维蛋白未出现明显的降解,蛋白质功能相对完整,所以结合水的相对含量未出现变化;但是冰晶破坏了肌原纤维的结构,导致肌原纤维蛋白网络中的不易流动水向自由水转变,因此自由水的相对含量上升[21]。在冷冻贮藏过程中,肌原纤维蛋白的变性程度较小,蛋白质的水合能力较好,因此结合水和不易流动水相对含量在贮藏过程中未出现显著变化。在本实验中,保水性较差的微冻贮藏的样品,自由水相对含量始终保持在较高的水平。有研究表明,自由水相对含量越高,肉的保水性越差[22-23],这与本实验的结果相一致。
2.4 牛肉贮藏过程中核磁共振成像的变化

图3 冷藏、微冻、冷冻贮藏对牛肉水分分布核磁共振成像的影响Fig.3 Effects of chilled, superchilled and frozen storage on magnetic resonance imaging of water distribution in beef steaks
核磁共振成像技术可以获得肉品中H质子的密度图像,其能够直观地呈现出肌肉中水分的空间分布状态。图像越红,说明肉品中H质子密度越高,水分含量越高;图像越绿,说明肉品中H质子密度越低,水分含量越低。如图3所示,随着贮藏时间的延长,不同贮藏方式下的牛肉核磁共振成像图有明显变化。贮藏初期新鲜牛肉的图像多呈现红色,说明牛肉中水分含量丰富;在贮藏中后期,冷藏和微冻贮藏的样品较多地呈现绿色,说明这两个处理组的牛肉汁液损失较多,水分含量下降;而冷冻的样品分布有较多的红点,说明该处理组的牛肉含水量仍然较多。这与汁液损失和水分分布的实验结果相一致。汪春玲等[24]研究了微冻贮藏过程中罗非鱼片的水分迁移规律,结果发现-4 ℃微冻贮藏的样品核磁共振成像图出现绿色,水分含量相对较低,与本研究的结果相一致。
2.5 牛肉贮藏过程中总巯基和活性巯基含量的变化
肌球蛋白和肌动蛋白是肌原纤维蛋白的主要组成部分,这两种蛋白分子中含有大量的巯基,在贮藏过程中,肌原纤维蛋白中的巯基容易发生氧化反应形成二硫键,导致巯基含量的下降,因此,巯基含量可用于评价蛋白质氧化的程度[25]。贮藏温度、贮藏时间和它们的交互作用对总巯基和活性巯基含量均有显著影响(P<0.05)。由图4可知,随着贮藏时间的延长,3 种贮藏方式下肌原纤维蛋白的总巯基含量和活性巯基含量均呈现显著下降的趋势。贮藏初期,牛肉肌原纤维蛋白中总巯基含量和活性巯基含量分别为97.8 nmol/mg和79.0 nmol/mg,贮藏至第8周,冷藏条件下的牛肉总巯基和活性巯基含量分别下降到了39.5 nmol/mg和26.7 nmol/mg,显著低于微冻和冷冻贮藏的样品;微冻贮藏的样品在第12周的总巯基和活性巯基含量分别为45.7 nmol/mg和33.7 nmol/mg;冷冻贮藏样品在贮藏末期的总巯基和活性巯基分别为71.0 nmol/mg和50.8 nmol/mg,显著高于微冻处理组。钱书意等[26]研究表明,牛肉的贮藏温度越低,肌原纤维蛋白的巯基含量越高,这与本实验的结果基本一致。

图4 冷藏、微冻、冷冻贮藏对牛肉总巯基(A)和活性巯基(B)含量的影响Fig.4 Effects of chilled, superchilled and frozen storage on total sulphydryl (A) and free sulphydryl (B) contents in beef muscle
巯基对于肌原纤维蛋白的稳定性起着重要作用,微冻贮藏过程中,肌原纤维蛋白总巯基和活性巯基含量的下降可能是由于冰晶破坏了肌球蛋白的构象,暴露出分子内部的活性巯基,进而氧化形成二硫键[27]。在贮藏末期,微冻条件下总巯基和活性巯基含量较低,说明微冻贮藏牛肉的蛋白质氧化较为严重,降低了肌原纤维蛋白的水合能力。
2.6 牛肉贮藏过程中蛋白质表面疏水性的变化
蛋白质表面疏水性是评价蛋白质变性程度的一个有效指标,溴酚蓝可以与蛋白质的疏水性残基结合,通过检测溴酚蓝与蛋白质的结合量能够反映蛋白质表面疏水性,表面疏水性越大说明蛋白质变性程度越高[12]。如图5所示,贮藏温度、贮藏时间和它们的交互作用对蛋白质表面疏水性影响显著(P<0.05)。随着贮藏时间的延长,3 种贮藏方式下蛋白质表面疏水性均呈现显著上升的趋势,这与兰洋[28]对兔肉的研究结果基本一致。贮藏初期,肌原纤维蛋白的溴酚蓝结合量为9.0 μg,冷藏的样品在贮藏第8周达到了18.6 μg,微冻和冷冻贮藏的样品在贮藏末期的溴酚蓝结合量分别为20.1 μg和13.6 μg。

图5 冷藏、微冻、冷冻贮藏对牛肉蛋白质表面疏水性的影响Fig.5 Effects of chilled, superchilled and frozen storage on protein surface hydrophobicity of beef muscle
实验结果表明,贮藏温度越低,越有利于延缓蛋白质表面疏水性的上升。贮藏过程中牛肉肌原纤维蛋白由于物理或化学作用导致蛋白质分子链展开,使得蛋白质分子内部的非极性氨基酸残基暴露出来,进而导致蛋白质表面疏水性的上升[29]。蛋白质表面疏水性的上升会减弱肌原纤维蛋白的水合能力,使得部分结合水和不易流动水态变为自由水,从而造成肉品保水性的下降。本实验中,在贮藏末期,微冻条件下样品的溴酚蓝结合量快速上升,说明肌原纤维蛋白变性程度较大,推测是微冻贮藏过程中形成的冰晶破坏了肌原纤维蛋白的结构,使得疏水基团和亲水基团的位置发生了变化,导致蛋白质表面疏水性的上升。
2.7 牛肉贮藏过程中肌原纤维蛋白SDS-PAGE图谱的变化

图6 冷藏、微冻、冷冻贮藏对牛肉肌原纤维蛋白SDS-PAGE图谱的影响Fig.6 Effects of chilled, superchilled and frozen storage on sodium dodecyl sulfate-polyacrylamide gel electrophoresis profile of myofibrillar protein in beef muscle
从图6可以看出,从上到下的主要条带依次是肌球蛋白重链(220 kDa)、副肌球蛋白(100 kDa)和肌动蛋白(43 kDa)。在8 周贮藏期内,冷藏条件下的样品在55 kDa处的蛋白条带消失,在30 kDa和35 kDa左右产生了新的蛋白条带,说明冷藏过程中牛肉肌原纤维蛋白出现了严重的降解。微冻贮藏的肌原纤维蛋白样品降解程度较小,仅在30 kDa处发现了新的蛋白条带,并且强度较低。冷冻贮藏的牛肉样品,肌原纤维蛋白在整个贮藏期内都未发现明显的变化,说明蛋白降解程度最低。
3 讨 论
有很多学者研究证实,肉品在微冻贮藏过程中保水性较差[8,30-31]。造成这一现象的原因主要来自两方面,首先,在冻结过程中,肌肉中的大部分水分形成冰晶,冰晶的生长会对肌纤维产生压迫作用,破坏肌纤维结构,从而导致解冻时汁液损失的增加[32]。其次,冻藏过程中肌原纤维蛋白发生冷冻变性,蛋白质空间结构发生改变,导致蛋白质与水分子间作用力减弱,从而降低了肌肉的保水性[33]。
在本实验中,微冻贮藏牛肉的汁液损失率和蒸煮损失率显著高于冷藏和冷冻处理组,说明微冻牛肉的保水性最差。微冻贮藏的牛肉肌原纤维蛋白在12 周贮藏期内仅出现了轻微的降解,在贮藏后期肌原纤维蛋白的变性程度较高。LF-NMR结果显示,微冻贮藏过程中牛肉的结合水相对含量没有发现显著变化,部分不易流动水转化为自由水。本课题组前期研究发现,冰晶的作用导致牛肉在微冻贮藏过程中肌纤维间的分离程度逐渐变大[34],因此推测冰晶对肌纤维结构的破坏和较高的蛋白质变性程度提升了肌原纤维蛋白网络中不易流动水的自由度,使得部分不易流动水转化为自由水,形成汁液损失,最终导致了微冻牛肉较差的保水性。冷冻贮藏的牛肉在12 周贮藏期内肌原纤维蛋白降解程度最低,变性程度最小,使得汁液损失和蒸煮损失都处于较低的水平,LF-NMR的结果也验证了该处理组牛肉较好的保水性。
4 结 论
微冻贮藏牛肉的汁液损失率和蒸煮损失率显著高于冷藏和冷冻处理组,保水性最差。3 种贮藏方式下,牛肉中的水分逐渐向自由水迁移,流动性增加,其中冷藏和微冻样品的不易流动水向自由水转化,冷冻样品的水分迁移程度最小。随着贮藏时间的延长,3 种贮藏方式下牛肉的总巯基含量和活性巯基含量均显著下降,蛋白质表面疏水性显著上升,贮藏温度越低,变化速率越慢。冷藏条件下,肌原纤维蛋白发生了严重的降解,导致蛋白质水合能力下降,牛肉中的部分结合水和不易流动水转化为自由水,造成汁液损失率的上升。微冻贮藏过程中,牛肉肌原纤维蛋白降解程度较低,贮藏后期肌原纤维蛋白变性程度显著上升,提升了不易流动水的流动性,使得部分不易流动水转化为自由水,导致了微冻牛肉较差的保水性。冷冻贮藏的牛肉在整个贮藏期内肌原纤维蛋白降解程度最低,变性程度最小,使得汁液损失率和蒸煮损失率都处于较低的水平,保水性较好。

