壳聚糖复合保鲜对草鱼肌肉品质变化的影响
李佳艺,陈 赛,刘永乐,俞 健,李向红,黄轶群,王发祥
(长沙理工大学化学与食品工程学院,湖南省水生资源食品加工工程技术研究中心,湖南 长沙 410114)
随着人们对食品安全问题的普遍关注,淡水鱼保鲜技术发展迅速,安全、高效的生物保鲜剂成为食品保鲜领域的研究趋势[8-10]。当前,将生物保鲜剂复配应用于水产品保鲜的研究逐渐增多,如沈秋霞等[11]采用壳聚糖、茶多酚和柠檬汁复配对虹鳟鱼片进行保鲜,可延缓鱼片的感官变化及含氮物质分解,同时在一定程度上抑制了微生物生长;Zhang Lina等[12]研究发现,采用壳聚糖、乙酸和茶多酚涂膜处理草鱼可以减缓微生物生长和脂质氧化,有效防止冷藏过程中草鱼的腐败变质;Bakry等[13]发现壳聚糖-葡萄糖美拉德反应产物可以抑制冷藏期间草鱼片的细菌生长、延缓蛋白质和脂肪氧化,有效地保持草鱼片的新鲜度;Sun Xinyu等[14]发现复配了姜黄素和β-环糊精乳液的鱼明胶膜对草鱼片保鲜效果很好,可以抑制鱼片的总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量、硫代巴比妥酸(thiobarbituric acid,TBA)值和微生物数量等的增加,从而延长草鱼片的货架期。本课题组前期也开展了部分草鱼壳聚糖复合保鲜研究[15-16],发现保鲜处理能减缓微生物菌落总数、TVB-N含量的上升,维持肌肉蛋白质的结构和性质的稳定。本研究基于前期研究结果[16],进一步研究了壳聚糖复合保鲜液(10 mg/mL壳聚糖+5 mg/mL茶多酚+2 000 U/mL溶菌酶)对草鱼肉鲜度(K值)和ATP关联物含量、汁液流失率、质构特性、挥发性气味等指标的影响,探讨其减缓草鱼冷藏过程中品质变化的作用,为制定草鱼保鲜解决方案提供参考。
1 材料与方法
1.1 材料与试剂
新鲜草鱼(Ctenopharyngodon idellus)购于长沙本地菜市场,每尾质量(1.5±0.2)kg。
壳聚糖(生物试剂)(脱乙酰度≥95%)、茶多酚(生物试剂)(纯度≥98%) 上海笛柏化学品技术有限公司;溶菌酶(生物试剂)(酶活力≥20 000 U/mg)、醋酸(分析纯) 国药集团化学试剂有限公司;ATP关联物标准品(基准试剂) 美国Sigma公司。
1.2 仪器与设备
PEN3型电子鼻 德国AIRSENSE公司;TA.XT Plus型物性测定仪 英国Stable Micro Systems公司;DELTA 320 pH计 梅特勒-托利多(上海)有限公司;LC-20A高效液相色谱仪 日本岛津公司。
1.3 方法
1.3.1 壳聚糖复合保鲜液的配制
称取壳聚糖10.0 g,加入约200 mL无菌水预溶,再加入3.0 mL醋酸,充分搅拌,加热并持续搅拌至溶液呈黄色透明,冷却至室温。加入以无菌水预溶的茶多酚(5.0 g)和溶菌酶(0.1 g)溶液,定容至1 000 mL,超声脱气直至溶液呈透明状,即为10 mg/mL壳聚糖+5 mg/mL茶多酚+2 000 U/mL溶菌酶复合保鲜液。
1.3.2 样品的处理
参照陈赛等[16]的方法,鲜活草鱼置于冰水中暂养2 h左右,致死后去头、尾、鳞和内脏,以预冷(4 ℃)的无菌水清洗干净后剔除鱼骨并切成鱼片(5.0 cm×3.0 cm×0.2 cm)。分别用无菌水(对照组)和复合保鲜液(保鲜组)浸泡10 min,料液比约为1∶5(m/V),沥水3 min后用自封袋包装,置于(4±1)℃冰箱中保藏,于第0、3、6、9、12天取样进行指标测定。
停止采空区注砂后,拔出注砂管,继续向注砂孔内注砂至地表,采用振动棒将孔内砂料振捣密实后,采用水泥砂浆封堵注砂孔。
1.3.3 ATP关联产物含量和K值的测定
ATP关联产物含量和K值参考SC/T 3048—2014《鱼类鲜度指标K值的测定 高效液相色谱法》测定。
1.3.4 质构特性的测定
将样品切成2.0 cm×2.0 cm×0.2 cm的鱼片,参考王垚等[17]的方法进行2 次压缩质地剖面分析,并稍作修改。测试条件为:探头型号P36R;形变量为50%;触发力10 g;测前速率为1.00 mm/s;测试速率为0.50 mm/s;测后速率为2.00 mm/s;时间间隔为10 s。
1.3.5 汁液流失率的测定
汁液流失率的测定参考李敬等[18]的方法并稍作修改,称量自封袋的质量(m1/kg)、第0天带自封袋的样品总质量(m2/kg)以及冷藏过程中取出样品将样品表面水分吸干后的质量(m3/kg)。汁液流失率按下式计算。

1.3.6 挥发性气味物质测定
参考刘楠等[19]的方法,准确称取5 g绞碎的鱼肉置于顶空进样瓶中,室温下静置30 min,顶空进样,每组样品平行测定3 次。电子鼻分析参数:传感器自清洗60 s;采样150 s;取样间隔1 s;进样气流量为600 mL/min。电子鼻10 种传感器的性能描述见表1。

表1 电子鼻传感器名称及其性能描述Table 1 Performance description of the electronic nose sensors used in this study
1.4 数据处理与分析
每组实验进行3~5 个平行,实验数据采用Excel软件进行计算,结果以平均值±标准差表示;以SPSS 23.0软件进行方差分析(最小显著性差异检验法),P<0.05表示差异显著,采用Origin 9.0软件作图。
2 结果与分析
2.1 壳聚糖复合保鲜对草鱼肉鲜度的影响

图1 草鱼冷藏过程中K值的变化Fig.1 Change in K-value of grass carp during cold storage
K值是指三磷酸腺苷(adenosine triphosphate,ATP)分解产生的低级产物次黄嘌呤核苷(hypoxanthine riboside,HxR)和次黄嘌呤(hypoxanthine,Hx)占ATP及其分解物总量的比例,通常作为水产品新鲜度的评价指标。K值小于20%为一级鲜度,而K值为60%是鱼肉可食用的极限值,超过60%则表示鱼肉已经腐败不能再食用[20-21]。冷藏过程中草鱼肉的K值变化如图1所示,随着冷藏时间的延长,两组样品的K值均不断升高,表明其鲜度逐渐下降。对照组K值上升较快,第6天时已达62.2%,已腐败;而保鲜组第6天时K值显著低于对照组(P<0.05),仅为47.1%,仍可食用。这与徐楚等[22]的研究结果相似,说明壳聚糖复合保鲜能显著抑制ATP及其关联物的降解(原因可能是抑制了核苷酸酶活性[23]),减缓鱼肉鲜度的下降。

图2 草鱼冷藏过程中ATP关联物IMP(A)和Hx(B)含量的变化Fig.2 Changes in ATP-associated inosine monphosphate (A) and hypoxanthine (B) contents of grass carp during cold storage
一般认为,鱼死后鱼肉中的ATP按以下顺序分解:ATP→二磷酸腺苷→腺嘌呤核糖核苷酸→肌苷酸(inosine monphosphate,IMP)→HxR→Hx。其中,IMP是对鱼肉鲜味贡献最大的物质,但其会进一步降解为HxR和Hx,导致鱼肉鲜味下降、风味变差。由图2A可知,对照组IMP含量在冷藏过程中一直下降,而保鲜组IMP含量呈先升后降趋势。李学鹏[24]的研究表明虾类产品的IMP含量在贮藏前期迅速增加,达最高点后逐渐下降,这与本研究的结果相似。对照组第0天的IMP含量为910.73 mg/kg,与保鲜组第3天时的含量(893.62 mg/kg)相当,说明对照组的峰值出现比保鲜组早,可能是因为其ATP和IMP分解较快,因而没有捕捉到上升过程;同时也说明壳聚糖复合保鲜能有效抑制ATP及其关联物的分解,减缓鱼肉品质变化。由图2B可见,第0天时两组样品几乎均不含有Hx,冷藏过程中Hx含量不断上升,这与余达威[25]的研究结果一致;冷藏12 d后,保鲜组Hx含量为474 mg/kg,显著低于对照组(820 mg/kg)(P<0.05),说明壳聚糖复合保鲜能较好抑制Hx等与鱼肉不良风味相关低级产物生成,延长鱼肉保鲜期。
2.2 壳聚糖复合保鲜对草鱼肉汁液流失率变化的影响
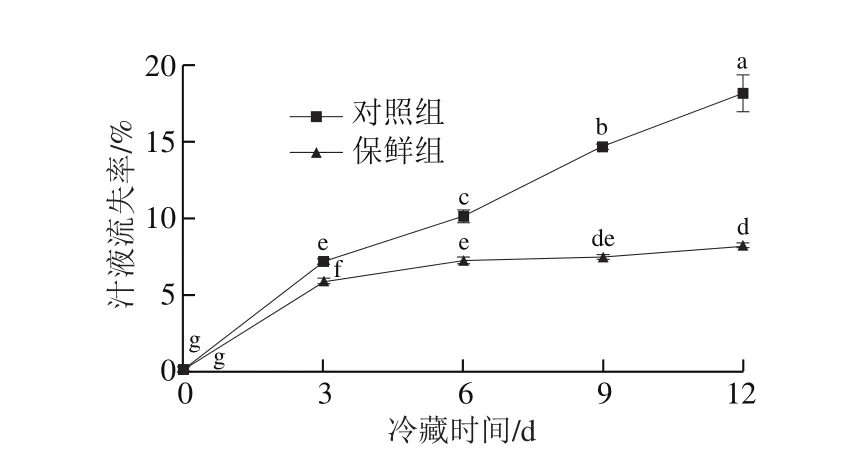
图3 草鱼冷藏过程中汁液流失率的变化Fig.3 Changes in juice loss rate of grass carp during cold storage
如图3所示,随着冷藏时间延长,两组样品的汁液流失率均呈现上升趋势,但与对照组相比,保鲜组的上升速率较为缓慢;冷藏第12天时,对照组汁液流失率达18.11%,而保鲜组显著低于对照组(P<0.05),仅为8.09%,表明壳聚糖复合保鲜能减轻鱼肉水分、蛋白质、无机盐等成分流失,延缓其品质下降和腐败进程[26]。这一定程度上与壳聚糖膜的保水性有关[27],也可能与复合保鲜剂的抑菌抑酶作用[28]减轻了由微生物和内源酶引起的肌肉蛋白降解和组织特性破坏有关,这与TVB-N含量的变化规律[16]相吻合。
2.3 壳聚糖复合保鲜对草鱼肉质构特性变化的影响
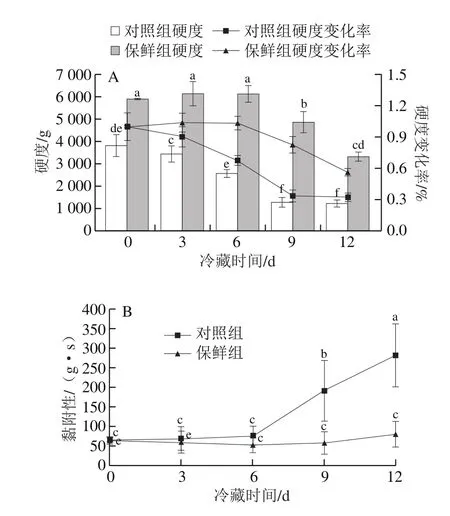
图4 草鱼冷藏过程中肌肉硬度(A)和黏附性(B)的变化Fig.4 Changes in muscle hardness (A) and adhesiveness (B) of grass carp during cold storage
质构是显著影响鱼肉感官质量的特征之一,冷藏过程中草鱼片质构特性变化如图4所示。随着冷藏时间的延长,对照组草鱼的硬度逐渐下降,黏附性逐渐上升,表明鱼肉在内源酶和微生物作用下发生蛋白质等生物大分子降解,肌肉组织结构被破坏,逐渐软化;同时可溶性固形物随着汁液流失过程渗出,导致了黏附性的增加。与对照组相比,保鲜组草鱼的黏附性在12 d内无显著变化(P>0.05),而硬度先略微上升后逐渐下降,但硬度下降变化率明显低于对照组。内源性酶类作用引起的肌原纤维蛋白及胶原蛋白的降解被认为是鱼肉软化的主要原因[29],上述结果表明壳聚糖复合保鲜剂处理能较好地抑制鱼肉内源酶活性,有效减缓其肌肉质构劣化。此外,保鲜组鱼肉的初始硬度较对照组大,可能与形成的壳聚糖膜的硬度有关,前3 d硬度上升的原因则可能是保鲜处理延长了草鱼的死后僵直期。
2.4 壳聚糖复合保鲜对草鱼气味变化的影响

图5 电子鼻传感器对冷藏过程中草鱼肉气味响应值的变化Fig.5 Changes in response values of electronic nose sensors to the volatile flavor compounds of grass carp during cold storage
鱼肉腐败过程往往伴随着异味的产生,气味常被消费者用作鉴别鱼肉品质好坏的指标[30-31]。利用电子鼻技术检测草鱼肉在冷藏期间产生的挥发性气味,得到传感器的响应曲线如图5所示。可见,冷藏前3 d,电子鼻10 个传感器的响应值变化不大,说明草鱼肉的挥发性气味物质产生较少,两组样品的气味差异也不大;随着冷藏时间延长,对照组中传感器W1W、W2W、W5S和W1S的响应值逐渐增加,说明冷藏过程中产生了硫化物、有机硫化物、氮氧化合物和甲烷类物质[32],对照组鱼肉的品质明显下降,尤其是W1W的响应值增加特别明显,第12天较第0天增加了359%,说明了在草鱼冷藏过程中硫化物是草鱼风味变化最明显的成分,因此对硫化物类成分的检测可以作为草鱼新鲜度检测的判别指标之一;保鲜组中各传感器的响应值明显低于对照组,且上升速率较为平缓。由传感器W1W的响应值可以看出,保鲜处理显著降低了硫化物的生成(P<0.05),说明壳聚糖复合保鲜有效抑制了挥发性气体的产生,对延缓鱼肉品质变化作用明显。此外,挥发性气味物质变化规律与草鱼TVB-N含量的变化趋势[16]基本一致,即冷藏9 d后对照组指标值急剧增加,而保鲜组增加相对平缓,保鲜效果明显。

图6 冷藏过程中草鱼肉气味电子鼻响应值的PCAFig.6 Principal component analysis of electronic nose response to the volatile flavor compounds of grass carp during cold storage
对电子鼻测定结果进行主成分分析(principal component analysis,PCA),结果如图6所示。PCA是对测定的各指标进行降维和线性分类,最终以第一主成分(PC1)和第二主成分(PC2)的二维散点图形式将原始数据中的主要信息呈现出来的一种多元统计分析方法[33]。由图6可见,对照组和保鲜组的PC1、PC2累计贡献率分别为99.72%和97.51%,说明2 个主成分均可以较好地反映两组样品的多指标信息[34]。从图6A可以看出,对照组各样品的散点位置较分散,且随着冷藏时间延长位置沿第一主轴逐渐右移,尤以第12天最明显,说明气味差异较大;而保鲜组各样品的散点位置互有重叠(图6B),说明草鱼肉保鲜后在冷藏过程中挥发性气味成分变化较小,品质较为稳定。
3 结 论
冷藏过程中,草鱼肉的K值、Hx含量、汁液流失率、黏附性和挥发性气味等指标随时间延长有不同程度增加,表明这些指标能较好地反映鱼肉品质,但保鲜组样品的增加幅度明显小于对照组,说明壳聚糖复合保鲜效果良好,能有效减缓鱼肉品质变化;对照组草鱼的IMP含量和硬度随冷藏时间延长逐渐下降,而保鲜组则呈先上升后下降趋势且下降变化率明显低于对照组,说明壳聚糖复合保鲜能抑制肌肉内源酶活性,延缓鱼肉的品质劣变进程。因此,壳聚糖复合保鲜(10 mg/mL壳聚糖+5 mg/mL茶多酚+2 000 U/mL溶菌酶)是一种可行的草鱼保鲜解决方案,对加工贮运过程中保持鱼肉品质具有一定的参考价值。

