和调健脾方对腹泻型肠易激综合征模型大鼠的治疗作用及机制研究
陈贤家,符士颖,蔡翠珠,吕迎春
(1.儋州市中医医院脾胃病科,海南 儋州 571700;2.三亚市中医院脾胃科,海南 三亚 572000)
肠易激综合征是一组持续或间歇发作,以腹痛、腹胀、排便习惯和(或)大便性状改变为临床表现,而缺乏胃肠道结构和生化异常的肠道功能紊乱性疾病[1]。大多数报道都集中在胃肠蠕动障碍或远端结肠的内脏超敏反应。此外,研究表明,肠易激综合征大鼠的肠道通透性增加[2-3]。核因子-κB(Nuclear factor-κB,NF-κB)/Notch1通路在肠易激综合征期间调节肠通透性,其作为肠紧密连接蛋白的有效调节细胞因子[4-5]。有报道称肠易激综合征是由应激诱导的脑-肠轴变化引起的,导致肠道通透性过高,从而加剧黏膜下异常免疫反应[6]。然而,尚不清楚导致肠易激综合征肠黏膜屏障功能受损的确切病理生理信号。和调健脾方是中药的经典处方之一。它由多种中药组成:炒柴胡、炒白芍、炒白术、炒党参、广木香、炒陈皮、佛手片、广藿香、焦薏苡仁、干荷叶、淡干姜。目前尚未见关于和调健脾方治疗肠易激综合征动物模型以探讨其药效学和机制的文献。本研究拟探讨和调健脾方对腹泻型肠易激综合征模型大鼠的治疗作用及NF-κB/Notch1通路的影响,为腹泻型肠易激综合征的治疗提供理论依据。
1 材料与方法
1.1 实验动物 SPF级SD大鼠,雌雄不限,10周龄,体重260~280 g,购自四川大学实验动物中心,动物生产许可证号:SCXK(川)2018-0001,动物使用许可证号:SYXK(川)2018-0004,动物质量合格证号:SD203671,大鼠饲养环境为:温度(22~26 ℃)、光照(12 h∶12 h光照-黑暗循环)、湿度60%~70%。
1.2 主要药物、试剂与仪器 和调健脾方成分为:炒柴胡、炒党参各18 g,炒白芍12 g,炒白术、佛手片、焦薏苡仁、干荷叶各9 g,广藿香6 g,炒陈皮4.5 g,广木香、淡干姜各3 g(以上中药材均购自四川国强中药饮片有限公司),以上中药煎煮2次,每次1 h,混合2次药液,过滤,浓缩成生药浓度为0.282、0.564 g/ml的汤剂;番泻叶(批号 301876);匹维溴铵片(规格50 mg/片,批号:20200402);白细胞介素-2(Interleukin-2,IL-2)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、二胺氧化酶(Diamine oxidase,DAO)酶联免疫吸附(ELISA)试剂盒(上海佰晔生物科技中心,批号分别为:CP-3012R、CP-4007、CP-5116);苏木精-伊红(Hematoxylin eosin,HE)染色试剂盒、放射免疫沉淀缓冲液(上海碧云天生物技术研究所,批号分别为:DP1063、DP3315);TRIzol试剂(美国Invitrogen公司,批号:15547012);反转录试剂盒(日本Takara公司,批号:RR117);SYBR Green荧光定量PCR试剂盒(德国QIAGEN公司,批号:WE85532);BCA蛋白质检测试剂盒(美国Pierce公司,批号:XC59963.32);NF-κB单克隆抗体、Notch1单克隆抗体、GAPDH单克隆抗体、山羊抗鼠二抗(美国Abcam公司,批号分别为:ab40754、ab31108、ab39005、ab10018);增强的ECL化学发光试剂盒(美国Pierce公司,批号:SD-306D)。酶标仪(山东恒美电子科技有限公司,型号:HM-SY96A);显微镜(日本尼康公司,型号:E200 POL);实时PCR检测系统(美国Bio-Rad公司,型号:CFX96Touch);凝胶成像仪(北京君意华鑫科技有限公司,型号:JY-Clear ECL)。
1.3 造模及分组 将大鼠适应性喂养1周后进行实验,参照文献[7]的方法进行腹泻型肠易激综合征造模,将大鼠给予番泻叶水煎液(浓度0.3 g/ml)灌胃,灌胃体积10 ml/kg,每天灌胃1次,每次灌胃后1 h,用绳子将大鼠四肢束缚1 h,再将大鼠放入冷水池中刺激30 min,连续两周。当大鼠出现体重减轻,排稀便,精神萎靡不振,食欲减退,倦怠少动等症状,则表示造模成功[7]。将造模成功的48只大鼠按随机数字表法分成模型组、匹维溴铵组、和调健脾方低剂量组、和调健脾方高剂量组,每组12只;另取12只健康大鼠作为对照组,对照组大鼠每天灌胃10 ml/kg的蒸馏水。
1.4 给 药 造模成功后第1天,匹维溴铵组大鼠给予2 mg/kg匹维溴铵[8]灌胃(匹维溴铵与蒸馏水配制成浓度为0.2 mg/ml的溶液,灌胃体积10 ml/kg),和调健脾方低剂量组、和调健脾方高剂量组大鼠分别给予2.82、5.64g/kg和调健脾方[9]灌胃(浓度分别为0.282、0.564 g/ml的生药,灌胃体积10 ml/kg),对照组和模型组大鼠灌胃等体积蒸馏水,每天给药1次,连续给药14 d。
1.5 检测指标
1.5.1 大鼠排便频率、粪便含水量的测定:给药周期结束后,将大鼠放在笼中24 h,自由进食和饮水,计算大鼠每小时的平均排便次数作为排便频率。收集粪便颗粒进行称重(m0),然后将粪便颗粒在烤箱中干燥后再次称重(m1),计算粪便含水量,粪便含水量=(m0-m1)/m0×100%。
1.5.2 大鼠血清IL-2、TNF-α、DAO水平的测定:实验结束后,大鼠尾静脉采血,3000 r/min离心分离血清,采用ELISA试剂盒检测血清IL-2、TNF-α、DAO水平。
1.5.3 大鼠结肠组织形态学观察:颈脱臼处死大鼠,获取结肠组织,用生理盐水冲洗并在4%多聚甲醛中固定过夜,然后用连续的脱水步骤处理结肠组织,并包埋在石蜡块中,将结肠组织切成薄片并进行标准HE染色,从每组中选择3个样本,并从每个样本中选择4个区域观察,以评估黏膜层的肠黏膜屏障完整性和炎性细胞浸润。
1.5.4 大鼠结肠组织NF-κB、Notch1 mRNA水平的测定:用TRIzol试剂提取结肠组织总RNA,对于总RNA逆转录,使用反转录试剂盒将500 ng总RNA反转录为cDNA,基因表达通过SYBR Green荧光定量PCR试剂盒在实时PCR检测系统上操作。将NF-κB、Notch1 mRNA的相对表达水平标准化为GAPDH表达,使用2-△△Ct方法计算mRNA表达的相对倍数变化。引物由武汉金开瑞生物工程有限公司合成,引物序列如下:NF-κB为(正向)5’-ACACCAGACCGCAGCTCCATCAAGT-3’和(反向)5’-TCCATTGCTGCTGTCTGATTTGTAG-3’;Notch1为(正向)5’-TGTACGTGAAGCATGCCGTGACT-3’和(反向)5’-GGTGACGTGATTTTCTGTTCGTA-3’;GAPDH为(正向)5’-GCCAGTGGACTCCACGACTGGA-3’和(反向)5’-CAACTACATGGTTTACATGTTC-3’。重复该实验至少3遍。PCR扩增条件如下:95 ℃持续10 min,然后进行40个95 ℃持续10 s和60 ℃持续30 s的循环。
1.5.5 大鼠结肠组织NF-κB、Notch1蛋白水平的测定:将结肠组织在放射免疫沉淀缓冲液中裂解,收集蛋白质并使用BCA蛋白质检测试剂盒进行定量,用10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离40 μg蛋白质样品,并将其转移到聚偏二氟乙烯膜上,将膜在5%脱脂牛奶中室温下封闭1 h。加入NF-κB(1∶1000)、Notch(1∶1000)、GAPDH(1∶1000)单克隆抗体与膜在4 ℃孵育过夜,然后将膜用PBS缓冲液洗涤3次,并与山羊抗鼠二抗(1∶5000)在室温下孵育1 h。使用增强的ECL化学发光试剂盒显示蛋白印迹,通过使用凝胶成像仪对条带的强度进行定量。
1.6 统计学方法 使用SPSS 23.0统计学软件进行分析,实验结果采用均数±标准差表示,多组间比较采用单因素方差分析,两两比较采用SNK-q检验,P<0.05表示差异有统计学意义。
2 结 果
2.1 各组大鼠排便频率、粪便含水量比较 见表1。与对照组比较,模型组大鼠排便频率、粪便含水量明显升高(P<0.05);与模型组比较,匹维溴铵组、和调健脾方低剂量组、和调健脾方高剂量组大鼠排便频率、粪便含水量降低(P<0.05);且和调健脾方高剂量组大鼠排便频率、粪便含水量低于和调健脾方低剂量组(P<0.05);和调健脾方高剂量组大鼠排便频率、粪便含水量与匹维溴铵组比较,差异无统计学意义(P>0.05)。

表1 各组大鼠排便频率、粪便含水量比较
2.2 各组大鼠血清IL-2、TNF-α、DAO水平比较 见表2。与对照组比较,模型组大鼠血清IL-2、TNF-α、DAO水平明显升高(P<0.05);与模型组比较,匹维溴铵组、和调健脾方低剂量组、和调健脾方高剂量组大鼠血清IL-2、TNF-α、DAO水平降低(P<0.05);且和调健脾方高剂量组大鼠血清IL-2、TNF-α、DAO水平低于和调健脾方低剂量组(P<0.05);和调健脾方高剂量组大鼠血清IL-2、TNF-α、DAO水平与匹维溴铵组比较,差异无统计学意义(P>0.05)。

表2 各组大鼠血清IL-2、TNF-α、DAO水平比较
2.3 各组大鼠结肠组织病理观察 对照组结肠黏膜组织结构正常;模型组肠绒毛变短、增厚、脱落,肠黏膜上皮细胞脱落,可见明显炎症细胞浸润;匹维溴铵组及和调健脾方高剂量组结肠黏膜上皮细胞脱落减轻,炎症细胞浸润减少;和调健脾方低剂量组仍可见明显充血及炎症细胞浸润(图1)。

A:对照组;B:模型组;C:匹维溴铵组;D:和调健脾方低剂量组;E:和调健脾方高剂量组图1 各组大鼠结肠组织病理结构观察(HE染色,×400)
2.4 各组大鼠结肠组织NF-κB、Notch1 mRNA相对表达水平比较 见表3。与对照组比较,模型组大鼠结肠组织NF-κB、Notch1 mRNA表达水平明显升高(P<0.05);与模型组比较,匹维溴铵组、和调健脾方低剂量组、和调健脾方高剂量组大鼠结肠组织NF-κB、Notch1 mRNA表达水平降低(P<0.05);且和调健脾方高剂量组大鼠结肠组织NF-κB、Notch1 mRNA表达水平低于和调健脾方低剂量组(P<0.05);和调健脾方高剂量组大鼠结肠组织NF-κB、Notch1 mRNA表达水平与匹维溴铵组比较,差异无统计学意义(P>0.05)。
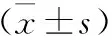
表3 各组大鼠结肠组织NF-κB、Notch1 mRNA相对表达水平比较
2.5 各组大鼠结肠组织NF-κB、Notch1蛋白相对表达水平比较 见表4(图2)。与对照组比较,模型组大鼠结肠组织NF-κB、Notch1蛋白表达水平明显升高(P<0.05);与模型组比较,匹维溴铵组、和调健脾方低剂量组、和调健脾方高剂量组大鼠结肠组织NF-κB、Notch1蛋白表达水平降低(P<0.05);且和调健脾方高剂量组大鼠结肠组织NF-κB、Notch1蛋白表达水平低于和调健脾方低剂量组(P<0.05);和调健脾方高剂量组大鼠结肠组织NF-κB、Notch1蛋白表达水平与匹维溴铵组比较,差异无统计学意义(P>0.05)。
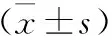
表4 各组大鼠结肠组织NF-κB、Notch1蛋白相对表达水平比较
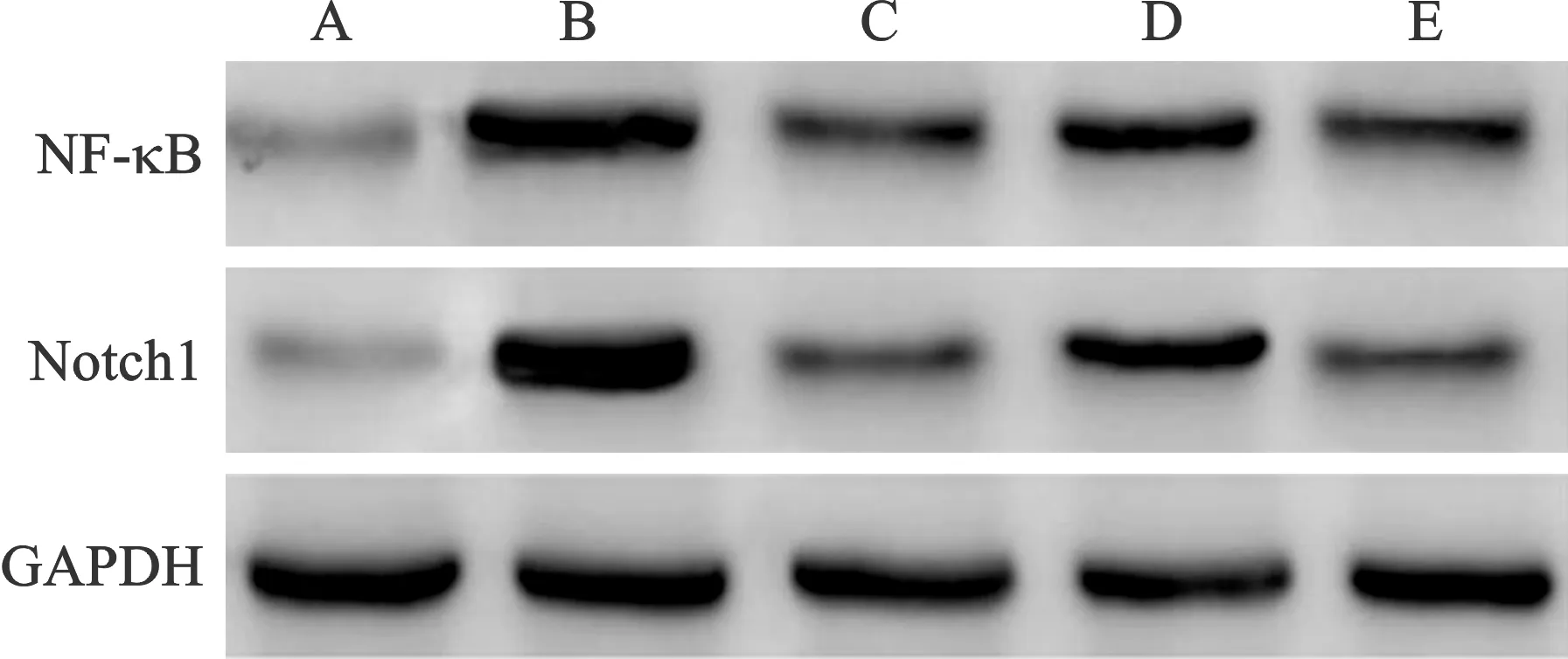
A:对照组;B:模型组;C:匹维溴铵组;D:和调健脾方低剂量组;E:和调健脾方高剂量组图2 各组大鼠结肠组织NF-κB、Notch1蛋白电泳图
3 讨 论
肠易激综合征呈持续或间歇发作,是一种缺乏胃肠道结构和生化异常的肠道功能紊乱性疾病。近年来,有关肠易激综合征的相关研究越来越多,然而,肠易激综合征的确切病理机制仍不清楚,心理和压力因素被认为是影响肠易激综合征的重要因素[10]。另外,越来越多的学者认识到低度炎症在继发性肠易激综合征中起重要作用[11]。作为天然的物理屏障,结肠上皮细胞在防止细菌、病原体和其他抗原侵入肠道黏膜中起着重要的保护作用。肠道屏障的完整性稳定了整个肠道生态系统[12]。已经证明,肠黏膜屏障功能破坏是肠易激综合征的重要致病因素[13]。因此,恢复肠黏膜屏障功能可能是肠易激综合征治疗的新目标。
和调健脾方是著名的中药处方之一,可以有效缓解腹痛和腹泻,恢复患者体内消化道的平衡。和调健脾方中的23种成分已被成功验证,包括单萜糖苷、色酮、内酯、有机酸类黄酮和甾类化合物等[9]。然而,关于和调健脾方在腹泻型肠易激综合征治疗中的药理作用和机制的研究仍然很有限。因此,本研究旨在探讨腹泻型肠易激综合征大鼠模型中和调健脾方的治疗机制,并进一步研究和调健脾方对肠黏膜屏障的保护作用及其机制。在本项研究中,模型组大鼠排便频率、粪便含水量、血清IL-2、TNF-α、DAO明显高于对照组;和调健脾方低、高剂量组大鼠排便频率、粪便含水量、血清IL-2、TNF-α、DAO低于模型组。这说明,腹泻型肠易激综合征大鼠血清炎症因子水平较高,并伴有高粪便含水量和高排便频率,用和调健脾方治疗后,腹泻型肠易激综合征大鼠的粪便含水量、排便频率和血清炎症因子水平降低,肠蠕动频率减少,表明肠通透性降低。此外结合本研究病理结果,匹维溴铵组及和调健脾方高剂量组结肠黏膜上皮细胞脱落减轻,炎症细胞浸润减少,说明和调健脾方可减轻结肠黏膜组织炎症反应。
研究表明,NF-κB是一种核转录因子,其信号通路参与许多生理过程,包括炎症反应和先天免疫的调节[14-17]。NF-κB信号通路的异常激活促进炎症因子,如Notch1、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和TNF-α的表达,诱发炎症级联反应和大量中性粒细胞聚集,可引发一系列病理损伤变化,例如肠上皮细胞损伤和小血管炎,这导致黏膜免疫细胞和趋化因子增加,继而引起肠通透性增加[18-20]。本研究结果显示,模型组大鼠结肠组织NF-κB、Notch1 mRNA蛋白表达水平高于对照组,经和调健脾方治疗后,和调健脾方低、高剂量组大鼠结肠组织NF-κB、Notch1 mRNA蛋白表达水平降低,且呈剂量依赖性;说明和调健脾方可能通过抑制NF-κB、Notch1 mRNA和蛋白表达进而抑制NF-κB/Notch通路的激活,从而改善腹泻型肠易激综合征大鼠腹泻症状,减轻大鼠血清和结肠组织炎症反应。另外,腹泻型肠易激综合征大鼠的黏膜炎症增加,引起肠黏膜破坏,肠黏膜屏障功能受损,肠通透性增加,用和调健脾方治疗可以抑制NF-κB信号传导,从而调节肠道通透性。
综上所述,和调健脾方可改善腹泻型肠易激综合征模型大鼠腹泻症状,减轻大鼠血清和结肠组织炎症反应;其机制可能与和调健脾方抑制NF-κB、Notch1 mRNA和蛋白表达水平进而抑制NF-κB/Notch1通路的激活有关。

