获得性免疫缺陷综合征合并隐球菌性脑膜炎预后影响因素分析*
涂文瑶,何娟,龙海,吴君,梁跃东,**
(1.贵州医科大学附属医院 感染科,贵州 贵阳 550004;2.贵阳市公共卫生救治中心 艾滋病科,贵州 贵阳 550004)
获得性免疫缺陷综合征(acquired immune deficiency syndrome,AIDS)是由人类免疫缺陷病毒(human immunodeficiency virus,HIV)侵入机体后导致T细胞免疫功能缺陷为主的一种免疫系统缺陷病,易引起各种机会性感染[1]。隐球菌性脑膜炎(cryptococcal meningitis,CM)是AIDS患者常见的机会性感染[2]。据统计,全球3 670万例HIV感染者中每年约有96万例感染CM,在一些抗逆转录病毒和抗真菌治疗条件有限的地区,AIDS合并CM死亡率可高达60%[3];如未经抗真菌治疗,死亡率可达100%[4];即使在发达地区,AIDS合并CM 死亡率也可达15%~25%[5-6]。AIDS合并CM的首发症状没有特异性,临床常发生误诊和漏诊、导致患者错过最佳治疗时间。对AIDS合并CM不同预后影响因素的研究,有助于个体化、有针对性的治疗,在一定程度上降低患者死亡风险。探索AIDS合并CM临床流行病学特征及预后影响因素,是早期识别疾病、及时对症治疗及降低该病发病率的关键[7]。目前,关于AIDS合并CM患者临床特征及预后影响因素的研究较少,因此,本研究对137例AIDS合并CM患者的临床资料进行回顾性分析,探讨AIDS合并CM患者的临床特征及预后影响因素,为进一步提高AIDS合并CM的早期诊断率,及时制定全面、合理的治疗方案提供参考。
1 资料与方法
1.1 一般资料
收集2015年1月1日—2019年12月31日收治的AIDS合并CM共213例患者的病历资料,纳入标准:AIDS诊断符合《中国艾滋病诊疗指南(2018版)》诊断标准[8],CM诊断标准[9]为脑脊液隐球菌墨汁染色涂片、脑脊液培养及脑脊液CrAg检测三项中任意一项阳性即可诊断。根据标准纳入213例患者,排除重复住院病人11例、合并病毒性脑膜炎9例、合并结核性脑膜炎12例、合并化脓性脑膜炎8例、合并其他恶性肿瘤2例及临床资料不齐患者34例,最终纳入研究137例,其中男112例、女25例,年龄10~85岁,平均(42.73±13.79)岁。
1.2 方法
1.2.1分组 采用对患者病历资料的查阅、艾滋病门诊随诊记录及电话回访相结合的方式进行随访,随访时间从首次诊断为AIDS合并CM至死亡之日或结束随访之日止,于2020年6月30日结束随访。根据随访结束时生存状况(生存/死亡)将137例患者分为生存组(111例)和死亡组(26例)。
1.2.2观察指标 收集137例患者年龄、性别、临床症状(头痛、发热、呕吐及意识障碍)、影像学检查(胸部CT、头颅CT或MRI)及血常规、C反应蛋白、红细胞沉降率、降钙素原、血(1,3)-β-D葡聚糖、细菌内毒素、血液CrAg阳性率、CD4+T淋巴细胞、HIV病毒载量、脑脊液氯化物、脑脊液葡萄糖及脑脊液蛋白指标。所有实验室检查及影像学检查入院3 d内完成。
1.3 统计学处理
使用Excel 2013收集数据,SAS 9.4统计分析软件进行数据处理与统计分析。计数资料采用n(%)表示,组间计数资料单因素分析采用χ2或Fisher精确概率检验,采用多因素COX比例风险回归模型,确定AIDS合并CM的独立预后影响因素。Kaplan-Meier法测定患者生存率,Log-rank检验各影响因素差异的显著性。以P<0.05为差异有统计学意义。
2 结果
2.1 AIDS合并CM情况
截止2020年6月30日随访结束,共纳入137例患者,随访率为100%,随访时间(25.33±15.64)个月,年龄10~85岁、平均(42.73±13.79)岁,;死亡组26例、占19.00%,生存组111例、占81%,单因素分析结果显示:2组AIDS合并CM患者的年龄、CD4+T淋巴细胞、HIV病毒载量、血(1,3)-β-D葡聚糖及血液CrAg阳性率等因素比较,差异均有统计学意义(P<0.05)。性别、入院症状、影像学检查、单核细胞数、红细胞沉降率、降钙素原、细菌内毒素检测、脑脊液氯化物、脑脊液葡萄糖及脑脊液蛋白等指标比较,差异无统计学意义(P>0.05)。见表1。
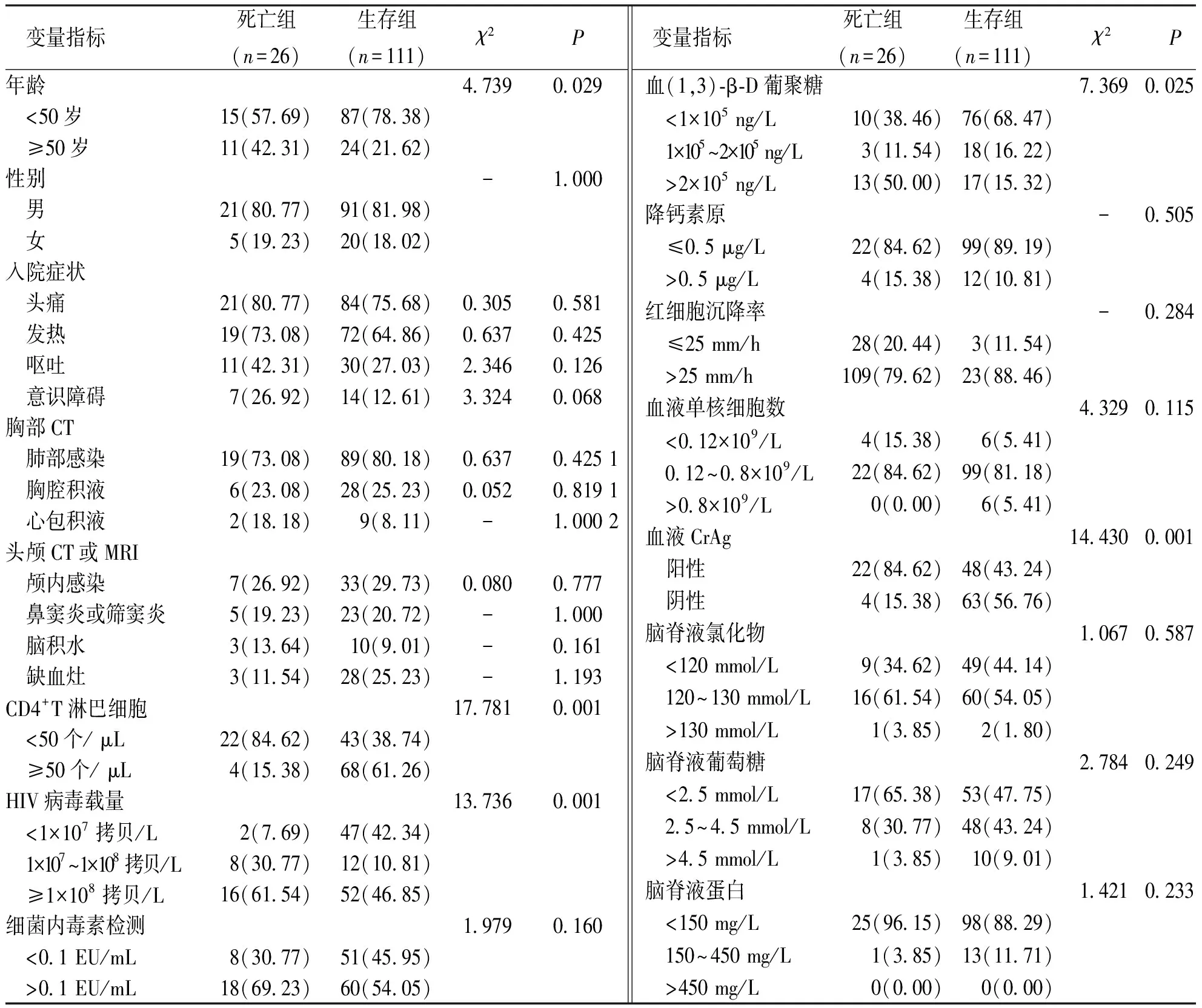
表1 AIDS合并CM患者临床特征的单因素分析[n(%)]
2.2 AIDS合并CM患者多因素COX分析
以患者预后(0=死亡,1=生存)为因变量,将单因素分析有统计学意义的变量(年龄、CD4+T淋巴细胞、HIV病毒载量、血(1,3)-β-D葡聚糖及血液CrAg阳性率)纳入COX比例风险模型进行多因素分析,结果显示患者年龄(HR=4.375,95%CI为1.855~10.319,P=0.001)、CD4+T淋巴细胞(HR=4.110,95%CI为2.351~12.553,P=0.013)、HIV病毒载量(HR=5.040,95%CI为1.119~22.699,P=0.035)及血液CrAg阳性(HR=8.135,95%CI为2.353~26.113,P=0.001)是AIDS合并CM独立预后影响因素,见表2。
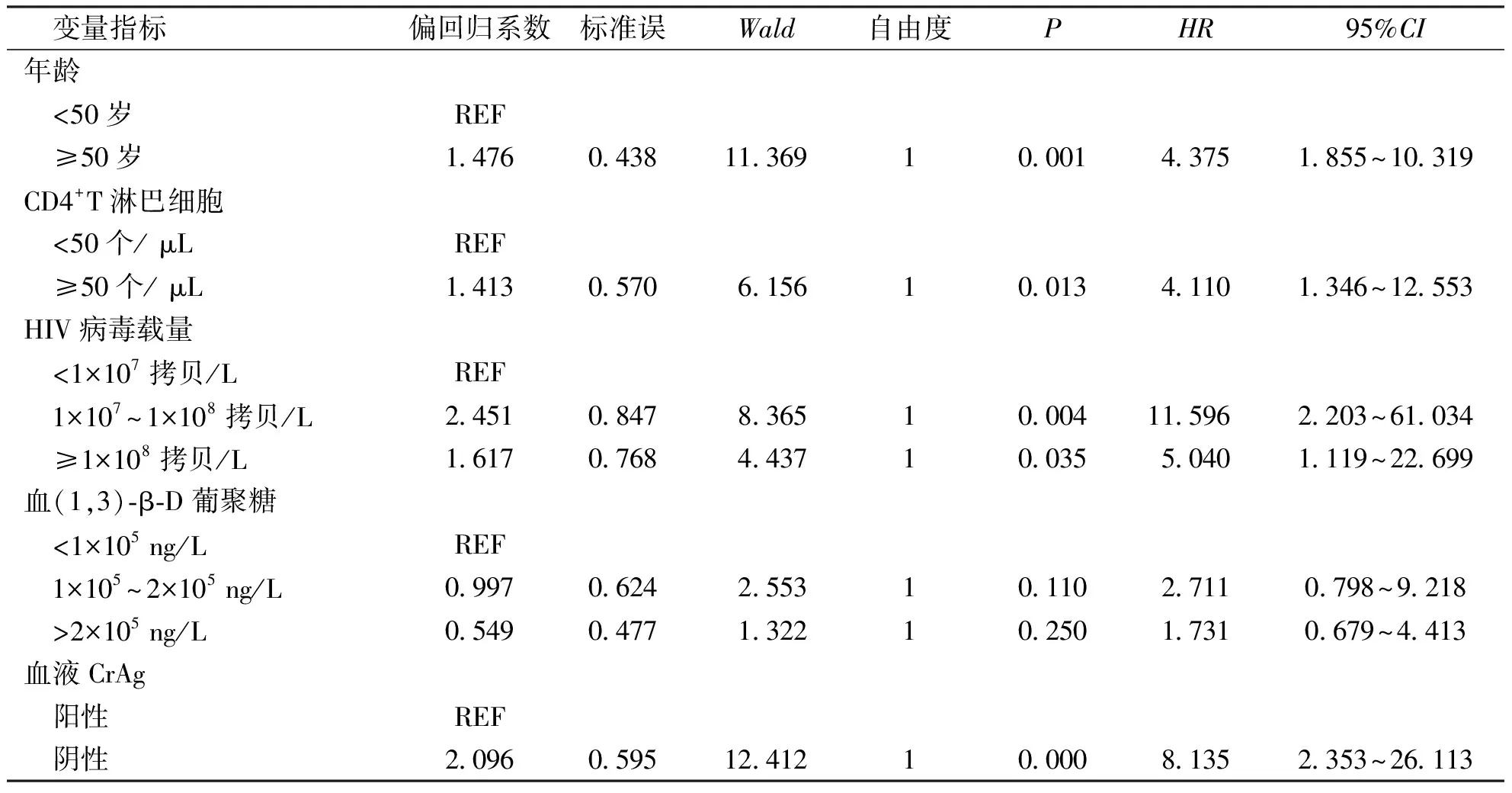
表2 影响AIDS合并CM患者预后的Cox比例风险回归模型分析结果
2.3 不同AIDS合并CM患者的生存分析
截至2020年6月30日,共随访137例患者,随访率为100%,随访时间(25.33±15.64)个月。随访患者中26例死亡(含院内死亡及院外死亡),获得随访的患者1 年、2年及3年生存率分别为91.2%、84.6%及83.8%,平均生存时间为(52.27±1.89)个月(95%CI为48.55~55.99)。Log-rank检验及Kaplan-Meier法测定的生存曲线显示:患者年龄、CD4+T淋巴细胞、HIV病毒载量及血液CrAg检测对生存率均有影响(P<0.05),年龄≥50岁、CD4+T淋巴细胞<50个/μL、HIV病毒载量≥1×107拷贝/L及血液CrAg阳性这4种影响因素可导致患者整体生存率明显下降,死亡风险增加。见图1。
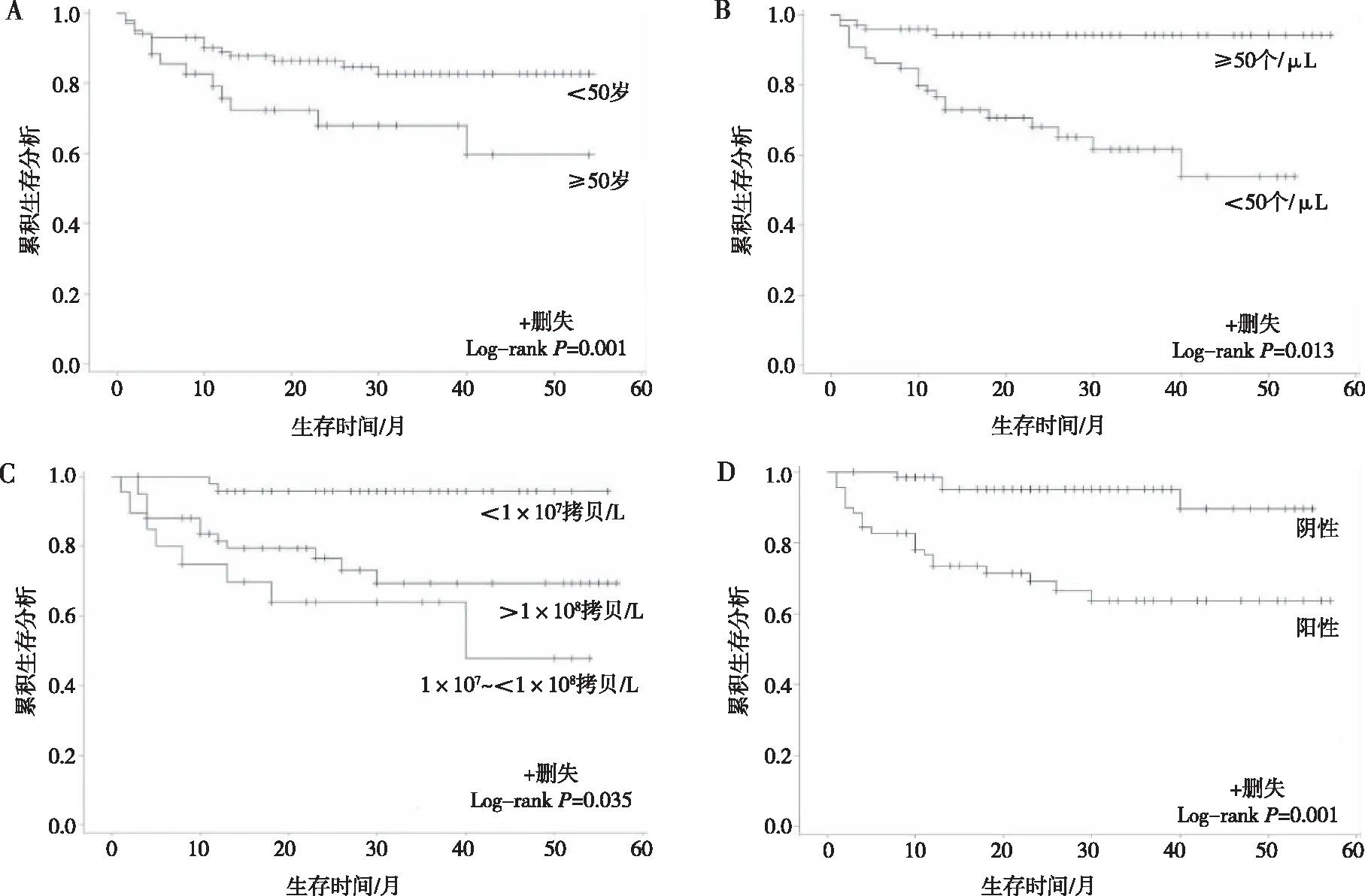
注:A为不同年龄AIDS合并CM患者生存曲线,B为不同CD4+T淋巴细胞AIDS合并CM患者生存曲线,C为不同HIV病毒载量AIDS合并CM患者生存曲线,D为血液隐球菌抗原阳性和阴性AIDS合并CM患者生存曲线
3 讨论
CM是由隐球菌引起的中枢神经系统深部真菌病,是AIDS常见的机会性感染之一,现已成为艾滋病患者住院和死亡的一个重要原因,AIDS合并CM患者病情较重,治疗疗程长,死亡率高[2]。其误诊、诊断不及时是导致AIDS合并CM患者高死亡率的原因之一[10],因此探究AIDS合并CM临床流行病学及预后影响因素,有助于早期识别疾病,为临床干预寻找好的突破口,进而改善患者预后,降低死亡率。
隐球菌易侵犯免疫功能受损的宿主,尤其是AIDS患者,当隐球菌侵入患者中枢神经系统引起CM时,其因感染的严重程度和患者的免疫状况不同而引起不同的临床症状[11]。研究发现AIDS合并CM患者最常见的临床症状为头痛、发热、恶心、呕吐及意识障碍[12-14],本研究的患者也大多以头痛、发热、呕吐及意识障碍等临床症状就诊。但在临床,这些临床症状也出现在其他中枢神经系统病变的患者[7,14],在预测AIDS合并CM方面缺乏特异性。提示临床医生更应该重视出现头痛、发热、呕吐及意识障碍等症状的患者,尽早进行血浆及脑脊液检查,尽可能避免漏诊、误诊CM,为AIDS合并CM患者提供及时的治疗,以改善患者预后,降低病死率。
AIDS合并CM患者预后受多方面因素影响,长期累计生存率较低。本研究的单因素分析结果显示:年龄、CD4+T淋巴细胞、HIV病毒载量、血(1,3)-β-D葡聚糖及血液CrAg阳性是AIDS合并CM预后影响因素。多因素COX比例风险回归模型显示:年龄、CD4+T淋巴细胞、HIV病毒载量及血液CrAg阳性是AIDS合并CM独立预后影响因素。经Log-rank检验及Kaplan-Meier法测定的生存曲线证实AIDS合并CM患者整体生存率低,年龄≥50岁、CD4+T淋巴细胞<50个/μL、HIV病毒载量≥1×107拷贝/L及血液CrAg阳性可导致患者整体生存率明显下降,死亡风险增加。鲁雁秋和鲁梦舒等[15-16]对AIDS合并CM患者预后影响因素的研究也发现年龄是AIDS合并CM患者预后影响因素,支持本研究结果。提示医务人员临床上须重视高龄AIDS患者CM的早期诊断。CD4+T淋巴细胞是具有免疫功能的T辅助细胞,是一种能直接反应机体免疫力的指标。Tugume等[17]研究发现在AIDS合并CM患者中,高CD4+T淋巴细胞比CD4+T淋巴细胞<50个/μL预后好。鲁梦舒等[16]对80例AIDS合并CM患者的预后影响因素研究发现及HIV病毒载量及CD4+T淋巴细胞是AIDS合并CM预后影响因素,本研究与他们研究结果一致。多因素COX分析显示CD4+淋巴细胞及HIV病毒载量是AIDS合并CM的独立预后影响因素,可作为AIDS合并CM预后判断和监测疗效的重要指标。本研究Kaplan-Meier生存曲线结果也显示CD4+T淋巴细胞<50个/μL的AIDS合并CM患者生存率明显低于CD4+T淋巴细胞≥50/μL患者,HIV病毒载量≥1×107拷贝/L的AIDS合并CM患者预后明显较低病毒水平的患者差,可能与HIV病毒能破坏CD4+T淋巴细胞的结构和功能,导致免疫功能严重抑制,机体的抵抗力下降有关。因此有学者建议AIDS合并CM患者在抗真菌治疗后4~6周后应积极启动抗病毒治疗、降低HIV病毒载量、增加CD4+T淋巴细胞以延缓病情的进展[1]。血液CrAg早期检测对快速识别隐球菌病、及时抗真菌治疗意义重大,可预防AIDS合并CM患者临床感染的发展,是降低死亡率的关键[18-20]。Ssebambulidde等[21]认为当未做CSF隐球菌墨汁染色涂片及培养或CSF隐球菌墨汁染色涂片及培养均阴性,而血液CrAg阳性时,提示可能是早期CM。有学者也认为血液CrAg检测是降低AIDS合并CM相关死亡率和发病率的一种手段,他们建议将血液CrAg检测纳入HIV治疗指南[22]。与他们研究结果相同,本研究显示AIDS合并CM患者血液CrAg阳性检测率高,对早期识别AIDS合并CM诊断有辅助作用。此外,本研究还发现血液CrAg阳性患者生存率明显低于CrAg阴性患者,是AIDS合并CM患者独立预后影响因素,这与Borges等[23]的研究结果一致,也进一步证明了对AIDS合并CM患者检测血液CrAg的必要性。Rhein等[24]报道,脑脊液(1,3)-β-D-葡聚糖对诊断深部真菌敏感性高,能辅助AIDS合并CM的早期诊断,当脑脊液(1,3)-β-D-葡聚糖>5×105ng/L时AIDS合并CM患者死亡率增加。Obayashi等[25]也在6例CM死亡患者体内检测到血浆(1,3)-β-D-葡聚糖,其平均水平高达5.38×105ng/L。与他们研究结果相似,本研究在137例AIDS合并CM患者血浆中检测到(1,3)-β-D葡聚糖,且浓度有不同程度升高,单因素分析显示血(1,3)-β-D-葡聚糖是AIDS合并CM患者预后影响因素,血(1,3)-β-D-葡聚糖>2×105ng/L与不良预后相关。目前国内外关于血(1,3)-β-D-葡聚糖浓度高低对AIDS合并CM预后影响的研究较少。本研究显示血(1,3)-β-D-葡聚糖浓度是AIDS合并CM预后影响因素,但因研究样本量相对较少,血(1,3)-β-D-葡聚糖对AIDS合并CM预后影响有待进一步深入研究。
综上所述,患者年龄、CD4+T淋巴细胞、HIV病毒载量、血(1,3)-β-D葡聚糖及血液CrAg是影响AIDS合并CM预后影响因素,其中年龄、CD4+T淋巴细胞、HIV病毒载量及血液CrAg是独立预后影响因素,临床上应积极加强对这些影响因素的检测、干预及治疗,以降低病死率,提高患者生存质量。

