从江香猪miR-143-3P 克隆及组织表达
吴巧群,许厚强,崔小芝,杨丽红,谌颖莲
(1.贵州大学高原山地动物遗传育种与繁殖教育部重点实验室,贵州贵阳 550025;2.贵州大学贵州省动物遗传育种与繁殖重点实验室,贵州贵阳 550025;3.贵州大学动物科学学院,贵州贵阳 550025;4.贵州大学生命科学学院,贵州贵阳 550025;5.贵州大学医学院,贵州贵阳 550025)
MicroRNAs(miRNA)是由20~25 个核苷酸组成的非编码RNA 小分子,其通过与靶mRNA 的3'-UTR端区域结合来抑制目的基因的翻译或降解目的基因[1],从而参与动物、植物、病毒、细菌[2-5]中多种生理或病理过程的调控。随着对miRNA 的深入了解,牛[6]、羊[7]、猪[8]等家畜也不断被作为研究对象,目前miRNA 在猪方面的研究主要集中在对脂肪、肌肉、生殖系统以及疾病的发生发展方面,但当中的具体调控机制还有待研究。对miRNA 的研究方法主要通过高通量测序、微阵列芯片、RT-qPCR 等技术来提高检测的特异性与灵敏度[9],虽然软件的预测准确性不断提高,可仍需要实验手段才能得以验证。从江香猪属于地方型猪种,具有肉质细嫩、抗病性强、基因纯合度高等特点,但该猪种体型矮小,生长缓慢[10]。本课题组前期研究发现,PRKAA1基因在从江香猪各组织中均有表达且在肺组织的表达量最高[11]。吴小敏通过在线软件筛选出PRKAA1基因相关的2 条LncRNAs,分别是ALNCI 和ALNC2,并通过构建相应真核表达载体干扰、荧光定量PCR 以及检测蛋白等证实这2 个LncRNAs 可促进脂肪形成和脂肪前体细胞分化[12]。因此,本实验以PRKAA1基因为研究背景,筛选相应miRNAs,研究筛选出的miRNA 对从江香猪生物机制的调控。为了研究差异表达miRNAs 的生物学功能,本实验筛选出多个miRNAs 后,选取表达量相对较高的miRNA-143-3P 为研究对象,了解该miRNA 在从江香猪组织中的表达规律,为后期研究miR-143-3P对从江香猪生长和生物功能的调控机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验材料 在贵州大学种猪场采集2 月龄从江香猪的胃、大肠、舌、脑、肾、肝、肺、脾、小肠各组织样30 g,分装放入液氮中,随后将其转移至-80℃冰箱中保存。
1.1.2 主要仪器与试剂 普通PCR 仪(Bio-Rad)、CFX-96荧光定量PCR 仪(Bio-Rad);DH5α感受态细胞由贵州大学高原山地动物遗传育种与繁殖教育部重点实验室保存。pMD-19-T 载体购自宝生物工程(大连)有限公司,逆转录试剂盒购自美国Thermo Fisher 公司;2×EsTaq Master Mix 购自康为世纪生物科技有限公司;DM 2000 Marker 购自擎科生物技术有限公司;Trizol 试剂购自英骏生物技术有限公司;氯仿、异丙醇、无水乙醇、75%的酒精购自宏达尔生物科技有限公司;超微量紫外分光光度计购自美国Thermo Scientific 公司。
1.2 实验方法
1.2.1 miR-143-3P 的预测 根据NCBI(https://www.ncbi.nlm.nih.gov/)中猪的PRKAA1基因(登录号:XM-0210 76522)3'-UTR 端序列,利用R 软件(http://cran.r-project.org)编写SWChen 2.3 程序以Simth-Waterman 算法预测出候选的miRNAs,将预测的结果与高通量测序的部分结果运用在线软件Venny2.1 做韦恩图取三者交集,选出表达量相对较高的miRNAs。
1.2.2 引物设计 从NCBI 数据库中查找猪的miR-143-3P 序列(登录号:NR_038529.1),采用茎环法设计引物选取特异性茎环用于逆转录,以GAPDH作为内参基因,引物合成均由生工生物工程股份有限公司完成。具体引物序列见表1。

表1 引物序列
1.2.3 从江香猪miR-143-3P 序列克隆 根据Trizol 试剂盒说明书提取从江香猪胃、大肠、舌、脑、肺、肾、肝、脾、小肠组织的总RNA,将各样本RNA 进行浓度测定。根据逆转录试剂盒说明,反应体系为20 μL。第一步,在无酶的PCR 管中加入1 μL 的DNA 酶,10×RT Buffer 1 μL,各RNA 样与水共加8 μL,共10 μL,放入PCR仪中37℃ 2 min,55℃ 5 min。第二步,加入茎环引物1 μL,内参下游1 μL,dNTP Μixture 1 μL,再加水2 μL,65℃ 5 min。第三步,加入5×RT Buffer 4 μL,逆转录酶加1 μL,25℃ 10 min,50℃ 30 min,85℃ 5 min。以脾脏的cDNA 为模板进行PCR 扩增。反应体系为20 μL:cDNA 模板1 μL,上下游引物各1 μL(10 mmoL),2×EsTaq Μaster Μix 10 μL,加水7 μL。PCR 反应条件:预变性95℃ 5 min,变性95℃ 30 s,退火59℃ 30 s,25 个循环,延伸72℃ 5 min。产物经1%琼脂糖凝胶电泳,与maker 比对,将与目的条带相近的部分进行胶回收,再与pMD-19-T 载体连接,并转化到DH5α感受态细胞中,在氨苄板中挑选出阳性菌落,送至生工生物工程股份有限公司测序。
1.2.4 miR-143-3p 序列保守性分析 利用MegAlign 软件将miR-143-3P 的成熟序列与人(Homo sapiens,hsa)、猪(Sus scrofa,sus)、山羊(Capra hircus,chi)、小鼠(Mus muscμLus,mmu)、鲤鱼(Cyprinus carpio,ccr)、马(Equus caballus,eca)、鸡(Gallus gallus,gga)、牛(Bos taurus,bta)的前体序列进行同源性分析。
1.2.5 实时荧光定量PCR 将逆转录各组织的cDNAs 进行Real-time qPCR 反应,反应体系为10 μL:2×ΜLtra SYBR Mixture(High ROX)5 µL,上下游引物各1.5 µL(10 mmoL)、cDNA 1 µL、水1 µL;反应程序:95℃预变性3 min,95℃变性30 s,59℃退火45 s,40 个循环;每个样品都有3 个重复,检测结果运用2-ΔΔCt公式计算,用SPSS19.0 软件分析,当P<0.05 时表示差异显著,P<0.01 时表示差异极显著。
2 结果
2.1 靶基因的预测 利用R 软件编写SWChen 2.3 程序以PRKAA1 基因3'-UTR 端筛选出的miRNAs 选取803个,再以miRNA 的种子区筛选出825 个,选取高通量测序部分结果中的40 个,利用Draw Venn Diagram 在线(http://bioinformatics.psb.ugent.be)软件选取三者(图1)共有的8 个miRNAs,其中包含有miR-143-3P。

图1 以PRKAA1 的3'-UTR 预测的miRNAs 交集结果
2.2 从江香猪miR-143-3P 的克隆及保守性分析 以从江香猪脾脏的cDNA 为模板进行PCR 扩增,成功克隆出从江香猪miR-143-3P 序列,扩增总长度为88 bp(图2),测序结果比对也完全一致(图3),其中miR-143-3P 的序列长度为21 bp。
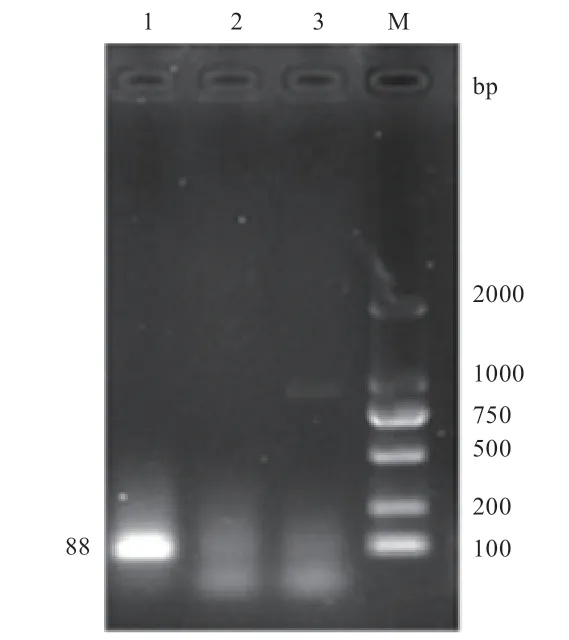
图2 从江香猪miR-143-3P 克隆菌液PCR 结果
MegAlign 软件对从江香猪miR-143-3P 成熟序列与不同物种间的同源性分析结果如图4 所示,从江香猪中miR-143-3P 的成熟序列与山羊、牛、人、鲤鱼、猪、马、鸡、小鼠前体miRNA-143 的序列相似性都是100%。
2.3 miR-143-3P 在从江香猪各组织中的表达差异 由图5可知,熔解曲线峰值单一,表明实验数据可用。检测结果(图6)显示,miR-143-3P 在从江香猪各组织中均有表达,其中在肝中表达量最高,在舌组织中表达量最低;在肝、胃、脾、肺、小肠中表达量均极显著高于大肠、舌、脑、肾(P<0.01);在肺和小肠中表达差异不显著(P>0.05);在舌、脑、肾之间的表达量差异不显著(P>0.05)。
3 讨 论

图3 从江香猪miR-143-3P 测序结果图

图4 miR-143-3P 成熟序列与不同物种miRNA-143 的前体序列比对
近年来,越来越多的研究表明miRNA 参与动物的基本生理功能,例如在冷应激下,大鼠肝脏中的miRNA-383、miRNA-92a 表达有极显著升高[13],在奶牛热应激中miRNA-19a 与miRNA-19b 都参与了调控[14];miRNA 还参与了猪生殖器官的发育,如Wright 等[15]证实了miRNA-21 表达会影响卵母细胞的成熟率;miRNA 还参与了绒山羊绒毛的生长,在绒毛生长的不同时期,miRNA-1298-5P 具有差异性表达,还可通过负调控TGF-βRI基因对绒山羊绒毛的生长起调节作用,促进绒毛生长[16]。这些都体现出miRNA 在动物机体中参与的调控较多,起重要作用。从江香猪的肌内脂肪含量高于大白猪[17],肌内脂肪含量又是影响肉质品质的重要因素,有研究表明miRNA 能够调控猪脂肪代谢[18],由此推测miRNA 可能参与从江香猪生长发育的调控。
研究动物的miRNA 靶基因预测软件较多,有TargeScan、RNAhybrid、MiRBase、miRTarBase、miRWalk 等,但这些软件也可通过某个具体基因来预测相应的miRNAs,预测机制各有不同,有通过基因的3'-UTR 与软件数据库中miRNAs 靶向结合来预测[19],也有通过基因与miRNA 之间形成二聚体来预测基因的miRNAs[20]。这些软件预测的结果都存在着假阳性,应结合多个软件预测,取交集选用共有的miRNAs 或靶基因来减少假阳性。
miR-143 为广泛性表达的基因,该miRNA 与肉品质以及代谢多方面的调控作用存在密切联系,所以一直都是研究热点。为了解miR-143-3P 在从江香猪的表达规律,本实验以从江香猪中脾脏的cDNA 为模板成功克隆出miRNA-143-3P 的成熟序列,比对分析发现其与人、猪、鼠、牛、马、鲤鱼、鸡、山羊的前体序列完全一致,这说明miR-143-3p 序列在各物种间为高度保守,与高玲玲[21]研究has-miR-143、赵冉[22]研究广西巴马小型猪miR-143-5p 的保守性一致,这提示了该基因在生物学功能的相似性和重要性。本实验利用实时荧光定量PCR 检测时发现,该基因在从江香猪的9 个组织中均有表达,且表达水平存在差异,其中在肝、脾、胃中的表达高于其他组织。miR-143-3P 在从江香猪各组织的表达水平与李东伟[23]、张晓东[24]等人分别在牛、白山羊中的研究结果不同,以往研究显示在肝脏中的表达量较低,在脾脏与胃的表达量丰富;与云青[25]在长白猪的研究存在差异,该研究中的miRNA-143-3P 在心脏表达水平高,其次是肝脏,而在脾脏中的表达量较低。进一步证实了miRNA 的表达水平在不同物种、不同品种动物中的同一组织存在较大差异[26],导致这样结果的原因可能与各器官在不同品种中的功能性强弱有关。这也提示了miRNA-143-3P 可能在从江香猪肝脏中的发育及功能发挥中起重要作用。
4 结 论
本实验通过PRKAA1基因3'-UTR 成功筛选出相关miR-143-3P,以从江香猪的脾cDNA 为模板成功克隆出miR-143-3P 序列,实时荧光定量PCR 检测出该miRNA 在各组织中均有表达,且在肝中的表达量最高,其次是胃与脾;对miR-143-3P 进行生物信息学分析,结果显示miRNA 具有较高的保守性。

