miRNA 调节乳腺组织脂肪代谢的研究进展
马青山,王长法,刘桂芹,李 艳
(聊城大学农学院,山东省黑毛驴高效繁育与生态饲养工程技术研究中心,山东省驴产业科技协同创新中心,山东聊城 252000)
乳脂作为乳制品中主要成分之一,其组分种类及含量是影响乳口感及营养价值的重要因素。乳脂代谢涉及到一个庞大、复杂的分子调控网络,受众多激素及信号分子调控[1-2]。随着研究的不断深入,越来越多的研究表明microRNA(miRNA)也是乳腺组织脂肪代谢的重要调控因子[3-5]。miRNA 为一类单链非编码小分子RNA,能够从转录后水平负调控基因表达,参与动物的生殖、生长及发育等多种生命活动[6],还是肝脏和脂肪等脂质代谢旺盛组织中脂肪代谢的关键调控因子[7]。本文对近年来miRNA 调控乳腺组织脂肪代谢的研究做一综述,为从miRNA 层次研究乳脂代谢,进而改善乳品质提供参考。
1 miRNA 简介
miRNA 是一类内源性、长度约在21~22 个核苷酸的非编码RNA(Non-Coding RNA,ncRNA),通过完全或不完全碱基配对的方式结合靶基因上的miRNA识别位点,导致目标mRNA 翻译抑制、脱腺苷化或发生降解,从而在转录后调控基因表达[6]。研究表明,miRNA 参与调控细胞增殖、分化和凋亡等过程,并同糖代谢、脂代谢、蛋白质代谢、胰岛素抵抗及器官发育等多种机体生命活动密切相关[8]。
编码miRNA 的基因可存在于基因间(Intergenic)或基因内(Intragenic)。研究显示,大多数miRNA 的基因位于编码/非编码蛋白基因的内含子区域或非翻译区(Untranslated Region,UTR)及基因组重复区域[9]。其中,内含子区域的miRNA 可共享宿主基因的启动子及调控元件,从mRNA 转录本上完成剪接[10]。miRNA在细胞内的生物合成过程极为复杂,受到多种催化酶及辅助蛋白的协同调控,合成过程:①Pri-miRNA 生成,在细胞核内RNA 聚合酶Ⅱ催化下,miRNA 基因及相关转录因子转录形成局部发夹结构的初级miRNA 转录本(Primary miRNA Transcript,Pri-miRNA,长度>1 kb)[11],发夹结构通常包含于ncRNA 或mRNA 的内含子中[12];②Pre-miRNA 生成,在核Drosha-DGCR8 异二聚体作用下,Pri-miRNA 在发夹基部裂解形成60~70 个核苷酸的茎环中间体,称为前体miRNA(PrecursormiRNA,Pre-miRNA)[13];③Pre-miRNA 转运,核膜转运蛋白5(Exportin-5,EXP-5)识别Pre-miRNA 发夹3'突出部分的2 个核苷酸后[12],在Ran-GTP 的辅助下将Pre-miRNA 转运到细胞质[14];④Dicer 酶切割,在细胞质中,Dicer-RNase-III 酶与Pre-miRNA 发夹基部的5'磷酸盐和3'突出具有特殊的亲和力,能够识别Pre-miRNA 的双链部分[15],在离发夹底部约2 个螺旋处切割Pre-miRNA,形成22 个核苷酸的双链miRNA(miRNA Duplex)[16];⑤miRNA 成熟及RISC 组装,双链miRNA 在解旋酶作用下产生成熟miRNA(约为20 个核苷酸),互补链(miRNA*)多被降解,成熟miRNA 结合到由Argonaute 家族蛋白组成的复合物中,组装形成RNA 诱导沉默复合体(RNA-Induced Silencing Complex,RISC)[17],RISC 可与靶基 因mRNA 3´UTR 或CDS 序列的特异性位点结合,进而调控靶基因表达[15]。
随着研究的深入,越来越多的miRNA 被发现和鉴定,miRNA、靶基因以及miRNA 同其他RNAs 互作的海量信息构成了研究miRNA 的重要数据库。常用数据库包括miRBase、TargetScan、ENCORI、PITA、PicTar、RNAhybrid、miRWalk、DIANA-microT、miRNAMap 及Deepbase 等。其中,miRBase(v22,http://www.mirbase.org/)是存储miRNA 信息最主要的公共数据库之一,可提供miRNA 序列、注释信息及靶标基因预测等全方位数据,该数据库已收录271 个物种共38 589 个发夹前体和48 860 条成熟的miRNA 序列[18]。TargetScan(v7.2,http://www.targetscan.org/vert_72/)是预测miRNA 哺乳动物靶基因较为常用的数据库,该数据库通过寻找与miRNA 种子区匹配的保守8mer、7mer 和6mer位点对miRNA 的生物学靶点预测[19],已覆盖人、小鼠、大鼠、猩猩、恒河猴、奶牛、狗、负鼠、鸡和青蛙等动物miRNA 靶基因信息。在研究miRNA 互作方面,ENCORI(2019 版本,http://starbase.sysu.edu.cn/index.php)数据库覆盖了包括32 种癌症的10 882 个RNAseq 和10 546 个miRNA-seq 数据,可提供基于CLIPseq 和降解组测序挖掘的miRNA-ncRNA、miRNAmRNA、ncRNA-RNA、RNA-RNA、RBP-ncRNA 及RBP-mRNA 之间的相互作用分析[20],这对研究miRNA功能及其调控网络具有重要帮助。
2 乳脂代谢
乳脂代谢涉及到一个庞大、复杂的分子调控网络,受到众多激素及信号分子等调控,包括脂肪酸、甘油三酯的摄入、转运、活化及合成,脂滴的形成和分泌等过程,相应的关键基因:①脂蛋白酯酶(Lipoprotein Lipase,LPL)为血液及乳腺组织与脂肪酸摄入相关基因;②脂肪酸结合蛋白3(Fatty Acid Binding Protein 3,FABP3)和白细胞 分化抗原36(Cluster of Differentiation 36,CD36)为胞内脂 肪酸转运相关基因;③长链酰基辅酶A 合成酶1(Acyl Coenzyme A Long-Chain l Synthetase,ACSL1)和乙酰辅酶A 合成酶1/2(Acetyl Coenzyme A Synthetase 1/2,ACSS1/2)为长链及短链脂肪酸活化胞内活化相关基因;④乙酰辅酶A 羧化酶α(Acetyl-CoA Carboxylase Alpha,ACCα)和脂肪酸合酶(Fatty Acid Synthase,FASN)为脂肪酸从头合成相关基因;硬脂酰辅酶A 去饱和酶(Stearoyl Coenzyme A Desaturase,SCD)和脂肪酸去饱和酶1(Fatty Acid Desaturase 1,FADS1)为脂肪酸去饱和相关基因;1-酰基甘油磷酸酰基转移酶6(1-Acylglycerol-3-Phosphate O-Acyltransferase 6,AGPAT6)、线粒体甘油-3-磷酸酰基转移酶(Glycerol-3-Phosphate Acyltransferases,Mitochondrial,GPAM)和脂素1(LPIN1)为甘油三酯合成关键基因;⑤脂滴形成、分泌相关基因包括嗜乳脂亚家族1 成员A1(Butyrophilin Subfamily 1,Member A1,BTN1A1)、黄嘌呤脱氢酶(Xanthine Dehydrogenase,XDH)、脂滴包被蛋白2(Perilipin2,PLIN2)、脂肪分化相关蛋白(Adipocyte Differentiation Related Protein,ADRP)及黄嘌呤氧化还原酶(Xanthine Oxidoreductase,XOR),由上述基因组成的复杂网络参与并调控乳脂代谢[1,21]。另外,调控机体脂质代谢重要的转录因子对乳脂代谢通路中的关键酶及蛋白表达起到调控作用,如过氧化物酶体增殖物激活受体γ(Peroxisome Proliferators-Activated Receptorsγ,PPARγ)、固醇调节元件结合蛋白-1(Sterol Regulatory Element-Binding Protein 1,SREBP-1)、胰岛素诱导基因1(Insulin Induced Gene 1,INSIG1)和肝X 受体(Liver X Receptor,LXR)等[1,22]。随着候选基因筛选策略和比较基因组学研究方法的发展,更多的乳脂代谢相关的基因及调控因子被学者发现并验证功能,miRNA 便是其中一种重要的调控因子。
3 miRNA 调控脂质代谢
在机体脂质代谢调控领域,研究较多的转录因子包括SREBP-1C、PPARs 和LXRα等[23-25]。而 随着研究的深入,miRNA 在脂质代谢中重要的调控作用也逐渐被发现,研究报道较多的包括miR-33a/b、miR-96、miR-122、miR-182、miR-183、miR-17-5p、miR-10b/21/27b 和miR-130b 等,其调控脂质代谢信号通路如图1 所示。
研究表明,miR-33 可通过多种途径调控脂质代谢,miR-33a/b 可抑制ATP 结合盒转运体A1(ATP-Binding Cassette Transporter A1,ABCA1)的表达丰度,调控胆固醇从细胞输出及高密度脂蛋白的生物合成[26-27],这对维持细胞内胆固醇动态平衡至关重要[28];另外,miR-33a/b 还可调控参与脂肪酸β氧化的基因,如肉毒碱棕榈酰基转移酶1A(Carnitine Palmityl Transferase 1A,CPT1A)、肉碱氧位甲基转移酶(Carnitine Oxymethyl Transferase,CROT)和羟辅酶A脱氢酶β亚基(Hydroxyacyl Coenzyme A Dehydrogenase Bβ-subunit,HADHB),进而降低脂肪酸的分解代谢[29-30],可知miR-33a/b 可结合多个靶基因序列,在不同层面调控宿主脂质代谢。另有研究发现,微生物也可影响miR-33 表达,从而调节宿主脂质代谢,结核分支杆菌(Mycobacterium tuberculosis)可诱导miR-33 及其互补链miR-33*表达,从而抑制巨噬细胞中参与自噬、溶菌酶和脂肪酸氧化的通路,以支持细菌自身复制[31],这表明菌群-miRNA 互作在调控脂质代谢中或许也发挥着重要作用。
miR-96/182/183 组成的miRNA 簇能够通过靶向INSIG-2和F 框/WD-40 域蛋白7(F-Box and WD-40 Domain Protein 7,FBXW7)基因的3' 端非翻译区,实现对其表达的负调控,并通过转录因子SREBP2调控脂肪酸的合成[7],这表明miRNA 不仅可以直接结合脂代谢相关的靶基因,还可调控关键转录因子,从而在不同分子水平影响脂代谢。而miR-122、miR-10b/21/27b、miR-17-5p、miR-130b 和miR-454 都可调控细胞中PPARs表达丰度,从而影响机体胆固醇和脂肪酸代谢[32-36],此外,miR-370 还可通过miR-122 间接作用,调节靶基因SREBP-1c、二酯酰甘油酰基转移酶2(Diacylgycerol Acyltransferase 2,DGAT2)及CPT1的表达丰度,进而导致肝脏中甘油三酯累积[37],这表明miRNA-miRNA 之间存在互作并对靶基因表达产生影响。同时,miR-122 还可通过促炎性因子、AGPAT1及单酰甘油-O-酰基转移酶1(Monoacylglycerol O-Acyltransferase 1,MOGAT1)影响着肝细胞的正常形态及功能[38]。此外,通过高通量miRNA 测序分析前蛋白转化酶枯草杆菌蛋白酶/KEXIN9 型(Proprotein Convertase Subtilisin/Kexin Type 9,PCSK9)和低密度脂蛋白受体(LowDensity Lipoprotein receptor,LDLR)基因敲除的小鼠发现,miR-33、miR-210 和miR-21a 以及之前未报道的miR-434 都与脂类代谢关系密切[39]。以上研究表明,miRNA 对动物脂质代谢存在多层次互作调控,不单单是某个或几个miRNA 对靶基因的直接作用,还存在miRNA-miRNA、miRNA-mRNA 及mRNA-mRNA 等多层次的综合调控。

图1 miRNA 调控机体脂质代谢[7]
4 miRNA 调控乳脂代谢
4.1 参与调控乳脂代谢的miRNA 随着研究的深入,miRNA 在动物乳腺发育及乳脂代谢过程中的重要调控作用日益受到关注。然而,已有报道表明,乳腺组织中脂肪代谢同机体脂质代谢存在明显的差异,miRNA调控方面亦是如此,这或许是由于乳腺细胞表达专属的miRNA 所致[40]。因此,应用高通量测序及基因芯片技术建立不同条件下乳腺组织miRNA 表达谱就显得尤为重要。在人类研究中,Munch 等[41]对母乳脂质进行smRNA-Seq 发现了21 个新miRNA,而且存在于乳中外泌体内的miRNA 对婴儿发育起着重要的调控作用。还有研究发现母乳中的miRNA 主要来源于乳腺上皮细胞,而非母体循环系统[42]。对乳瘀和乳瘀+乳腺肿瘤的人乳样本进行测序,分别发现了271 个和140 个新的miRNA,这些miRNA 可能同乳腺癌的发生有关[43]。在反刍动物中的研究发现,Shen 等[44]对源自乳脂率差异极显著的奶牛中分离的原代乳腺上皮细胞表达谱进行测序分析,共发现292 个已知的miRNA 和116 个新的miRNA。Bu 等[45]也在牛乳腺组织中获得99 条miRNA,其中miR-23a、miR-24、miR-143 和miR-103的表达水平较高。
目前,乳脂代谢相关的miRNA 及其作用的靶基因尚未完全发现,且通过与靶基因结合miRNA 或可影响上、下游相关基因表达。因此miRNA 对乳脂代谢的影响存在复杂的调控网络。miR-33、miR-103、miR-106、miR-200、miR-27、miR-25、miR-125、miR-130a、miR-141、miR-148、miR-183 和miR-454 等是目前研究较多的几个乳脂代谢相关miRNA。研究发现,不同miRNA 对乳脂代谢的调控存在差异,miR-33a、miR-103 过表达可促进乳腺上皮细胞甘油三酯的合成[46-47],miR-141 通过抑制靶基因去乙酰化酶(Sirtuin1,SIRT1)表达,进而上调奶牛乳腺上皮细胞乳脂代谢相关基因的表达[48]。与之相反,miR-25、miR-27a 及miR-454 都可抑制靶基因PPARs的表达,降低细胞内甘油三酯的合成[4,36,49],miR-183 则可靶向山羊乳腺上皮细胞细胞质中的哺乳动物STE 20 激酶1(Mammalian Sterile 20-Like Kinase1,MST1)基因,抑制乳脂合成过程[50]。Chen 等[5]研究发现,过表达的miR-106b 导致奶牛乳腺细胞中甘油三酯和胆固醇含量下降,而抑制miR-106b 表达则使甘油三酯和胆固醇含量增加,进而抑制乳脂合成。还有研究发现,羊乳腺组织中miR-103、miR-200a、miR-27a 及miR-23a 协同调控了乳腺脂肪酸合成过程,而且对相关基因的调控模式也存在差异[51],这表明乳脂代谢过程受到众多miRNA的协同调控,单一miRNA 可以调控多条mRNA,而且同一性状或生理过程也可受到多个miRNA 的调控。
此外,在泌乳的不同阶段miRNA 表达也存在差异。在人类中的研究发现,与足月母乳相比,早产儿母乳中miR-320a 表达丰度较低,而miR-148a 表达丰度较高[52]。沙袋鼠(Macropus Eugenii)不同泌乳阶段乳内miRNA 表达量存在差异表达,这些miRNA 可作为乳腺活动的假定标记和功能候选信号以促进幼仔的生长和发育[53]。对反刍动物的研究发现,奶牛产奶高峰期表达的1 692 810 个reads 中,在干奶期仅有34%表达;差异表达的173 个miRNA 中,在泌乳高峰期有165 个表达量下调[54]。乳山羊乳腺泌乳早期和晚期miRNA 表达谱也同样存在差异[47],这表明miRNA 的表达模式或许随着动物的生理状态、泌乳阶段等而发生变化。
4.2 miRNA 调控乳脂代谢的靶基因 获知miRNA 的靶基因对进一步明确其调控的信号通路至关重要。调控乳腺组织乳脂代谢miRNA 的靶基因功能主要集中在乳脂的合成、转运、氧化及分泌等过程(表1)。
如表1 所示,miRNA 调控乳脂代谢相关的靶基因数目众多,其中miR-135a 作用于极低密度脂蛋白受体(Very Low Density Lipoprotein Receptor,VLDLR)基因[63],miR-214 靶基因为HADHB基因[54],miR-34b 通过靶基因脱帽酶1A(Decapping Enzyme 1A,DCP1A)调节乳脂合成[58],而miR-26 家族靶基因属于PI3K-Akt、MAPK信号通路和脂肪酸生物合成通路[56]。进一步分析可知,单一靶基因可受到多个miRNA 调控,如调控靶基因PPAR的miRNA 包括miR-17-5p、miR-130a,调控靶基因过氧化物酶体增殖物激活受体-γ共激活因子-1(Peroxisome Proliferator-activated ReceptorγCoactivator-1,PGC-1)相关的miRNA 包括miR-17-5p、miR-25,调控靶基因FAS相关的miRNA 包括miR-103、miR-148,调控靶基因HADHB相关的miRNA 包括miR-33a/b、miR-214,调控靶基因ABCA1相关的miRNA 包括miR-33a/b、miR-106,而miR-10a、miR-15b、miR-142-5p 及miR-374b都可能作用于溶质载体家族30 成员4(Solute Carrier Family 30 Member 4,SLC30A4)基因[54],从而对乳脂代谢进行调控。对小鼠乳腺上皮细胞的研究发现,miR-142-3p 的靶基因为催乳素受体(Prolactin Receptor,PRLR),在转录和翻译水平调控PRLR的表达;miR-142-3p 还可以影响SREBP1、丝氨酸/苏氨酸蛋白激酶(Serine/Threonine-Protein Kinase,AKT1)、哺乳动物雷帕霉素靶蛋白(Mammalian Target of Rapamycin,mTOR)、核糖体蛋白S6 激酶(Ribosomal Protein S6 Kinase 1,S6K1)及信号转导和转录激活因子5(Signal Transducers and Activators of Transcription 5,STAT5)等泌乳信号基因的表达,调控小鼠乳腺上皮细胞的增殖及泌乳[62]。此外,miRNA 对靶基因还存在协同调控。研究发现,miR-148a 和miR-17-5p 可协同作用于靶基因PGC-1和PPARA,进而调节乳腺细胞脂质代谢[55]。可见,miRNA 对乳腺组织脂肪代谢相关靶基因具有重要的调控作用,而且存在协同调控机制,但调控网络极其复杂,深入解析miRNA 参与的乳脂代谢调控网络将对调节乳脂率、改善乳品质具有重要帮助。
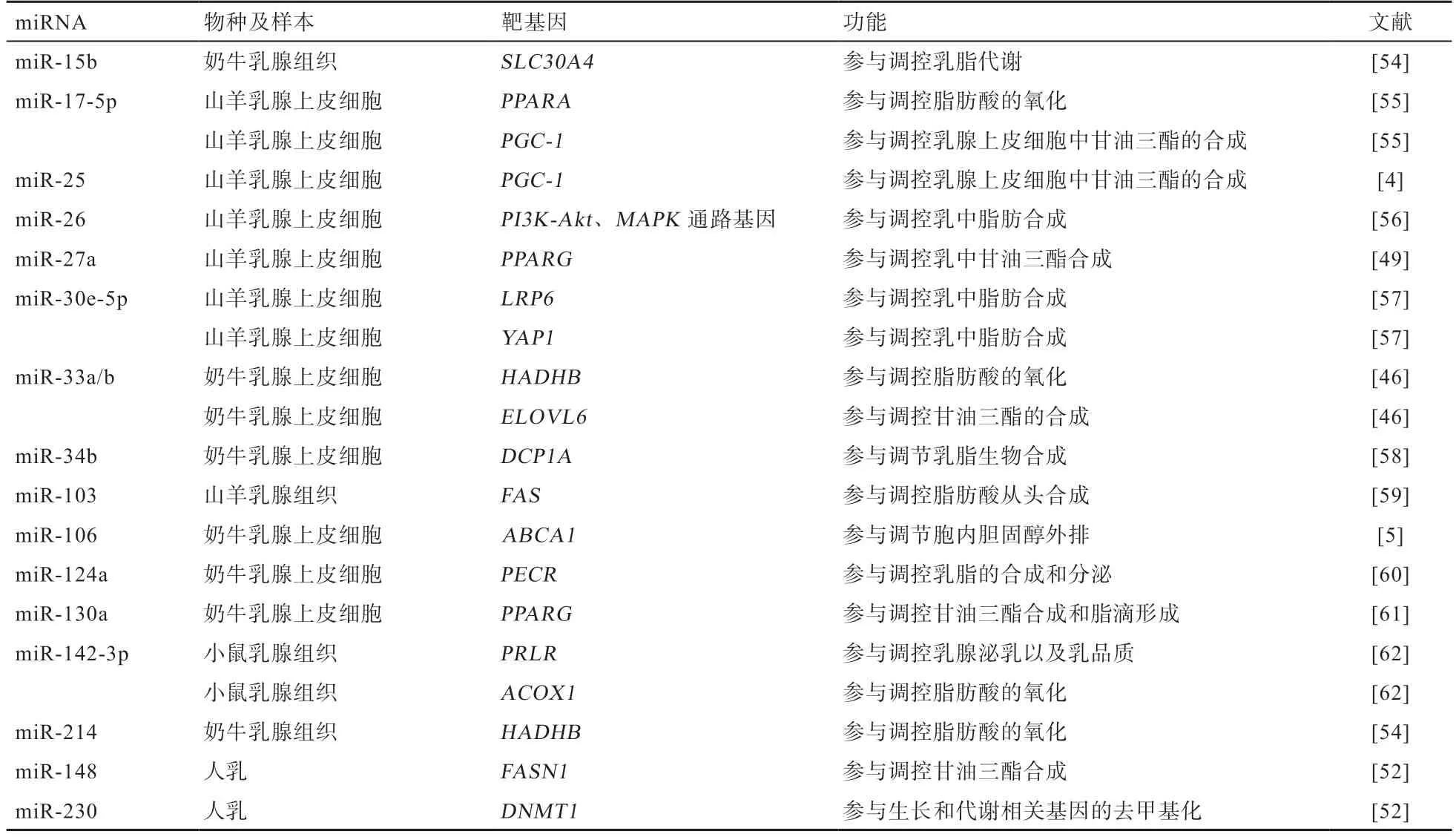
表1 乳脂代谢相关的miRNA 靶基因及其功能
5 miRNA 与乳品质
如前所述,miRNA 在奶牛乳腺发育、泌乳过程及乳品质调控中发挥着重要作用。对不同乳品质奶牛乳腺组织进行分析发现,miR-152 在高乳品质奶牛乳腺中的表达丰度明显高于低乳品质奶牛,其靶基因DNA 甲基转移酶1(DNA methyltransferase 1,DNMT1)表达丰度显著降低[64]。蒋磊[65]研究也发现,miR-148b 在奶牛乳腺组织中呈现出类似的表达丰度。共表达网络分析则证实miR-148a 是影响奶牛泌乳率的重要因素[66]。王学辉[67]通过高通量测序技术分析高乳品质与低乳品质荷斯坦奶牛乳腺组织差异mRNA 及miRNA,发现7 个同乳脂和乳蛋白合成相关的差异基因及其调控miRNA,即KDR(miR-424-5p 及miR-450b)、IRS1(miR-424-5p、miR-214 及miR-154b)、IGF2(miR-9-5p、miR-409、miR-182 及miR-31)、TGFB3(miR-2888)、SREBF1(miR-154b)、PFKFB3(miR-2888)和PCK2(miR-382)。另有研究表明,bta-miR-145 通过调节靶基因肌动蛋白结合蛋白1(Fascin Actin-Bundling Protein 1,FSCN1)提高乳腺上皮细胞增殖活力,进而影响乳腺细胞功能[68]。上述研究进一步证实,在乳腺发育及乳品质调控中,miRNA 起重要作用。此外,Wang 等[69]研究发现,低品质饲料(玉米秸秆和稻草)影响奶牛饲料利用相关miRNA 表达丰度,如瘤胃miR-99b、十二指肠miR-2336、空肠miR-652、肝脏miR-1 和乳腺miR-181a,从而对下游产奶过程及乳品质产生影响,这表明饲料中营养成分也会影响动物miRNA 表达,进而影响乳品质。
虽然目前关于miRNA 调控乳腺组织乳脂代谢的研究主要集中在细胞水平[36,50,58],但相关研究结果可作为指导生产的依据。Jabed 等[70]应用靶向miRNA 技术成功敲除了牛奶中98%的β-乳球蛋白(β-lactoglobulin,BLG),且提升了酪蛋白含量,显著降低了牛奶致敏性,改善了乳品质,这暗示靶向miRNA 表达技术可能是一种改良乳成分的有效策略。然而,在动物体内,miRNA 调控乳脂代谢靶基因的同时,又受到转录因子、细胞因子及环境因素的调节,这些复杂的因素交织成为一个庞大、复杂的调控网络,而目前对该网络尚知之甚少,因此,在养殖动物体内通过miRNA 调控乳脂代谢,进而改善乳品质仍存在较大难度。
6 小 结
综上分析,miRNA 可参与乳腺组织脂质代谢相关基因和/或转录因子的转录后调控,进而影响乳脂率和乳品质,相关研究将为乳脂调控、生物标记物筛选及分子育种开辟新的方法和途径。然而,目前miRNA 对乳脂代谢调控的研究还有很多问题值得深入研究:①由于单个miRNA 可结合多个靶基因,而一个基因又可能被多个miRNA 靶向调控,因此在乳脂代谢中miRNA同mRNA 的调控网络仍然复杂,尚需探索;②乳脂代谢相关miRNA 的功能验证多源自细胞试验,如乳腺上皮细胞。在动物试验及养殖生产中miRNA 的变化规律及所发挥的功能是否能够重现,还需要进一步验证;③循环在细胞外的miRNA 也具有生物调控活性[71],外源miRNA 对动物乳脂代谢的影响、乳中外泌体内miRNA的非营养功能分析及其是否会对初生子代产生影响尚需深入研究。未来,随着转录组学技术、整合蛋白质组学技术、多组学联合技术及系统生物学方法的应用普及,以及国内外miRNA 数据库资源的不断丰富和完善,将更有助于探明miRNA 对乳脂代谢方面的调控机制,进而为调节乳脂率及改善乳品质提供理论依据。

